B群链球菌CAMP阴性株的表型及分子特征初步分析
邓颖颖 孔银波 姜长宏 邓间开 江凌晓★
B 群链球菌(group BStreptococcus,GBS)又名无乳链球菌(Streptococcus agalactiae),是一种革兰氏阳性链球菌。GBS 不仅可正常定植于人体胃肠道及阴道,而且还是新生儿败血症、肺炎、脑膜炎 的重 要 致病 菌[1]。CAMP(christie-atkinsonmunch-peterson)实验是GBS 鉴定的重要实验之一[2]。CAMP 因子与金黄色葡萄球菌产生协同溶血作用而出现β-溶血增强的现象称为CAMP 试验阳性[3]。国内外未见CAMP 实验阴性的人源性侵袭性感染GBS 的报道。本实验室筛查出1 株CAMP 实验阴性的人源性侵袭性感染GBS,拟通过普通培养法、细胞培养技术、流式细胞技术,比较分析CAMP 实验阴性株与阳性株在生长、黏附、抗吞噬、吞噬细胞内存活能力等特征的差异,并通过下一代测序技术分析实验菌株15 个与侵袭/毒力相关基因的差异,以期了解CAMP 因子人源性侵袭性感染过程中的可能作用,为进一步研究其功能和作用机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验菌株/细胞株
金黄色葡萄球菌ATCC25923、407 株GBS、Hep-2 人喉癌上皮细胞和RAW264.7 小鼠巨噬细胞均由南方医科大学珠江医院检验医学部保存。人新鲜全血为南方医科大学珠江医院临床废弃标本。
1.1.2 仪器与试剂
CD45 Per-CP-Cy5.5 抗体购于美国BD 公司,CFDA SE 细胞增殖与示踪检测试剂盒购于上海碧云天生物技术有限公司,细胞培养基购于美国Gibco 公司,平板及肉汤培养基购于广州市迪景微生物科技有限公司。Vitek2 微生物自动化分析仪购自法国Biomeriex 公司,流式细胞仪BD FACS Calibur Flow Cytometer 购自美国BD 公司,倒置显微镜TS100 购自日本Nikon 公司,倒置荧光显微镜AXIO Vert.A1 购自德国Zeiss 公司,CO2培养箱(细胞培养)HERA cell 150i 购自美国Thermo 公司,CO2培养箱(细菌培养)SHELZB2306-2S 购自美国HELLAB 公司。
1.2 方法
1.2.1 CAMP 试验
将本实验室冻存的407 株GBS 菌株分别接种于血琼脂平板上,35℃、5%CO2培养箱培养18~24 h。按CAMP试验操作规程[4]筛选CAMP阴性菌株。
1.2.2 不同环境生长曲线测定
取筛选出的CAMP 阴性株为实验菌株,另以1∶4 的取样配比选同期分离自血液的GBS 为对照实验菌株。取0.5 MCF 实验菌株和对照菌株等量分别接种于营养肉汤中,于pH 7.0 且温度分别为4℃、25℃、35℃培养,在培养4、5、6、7、8、9、10 h 时各自取100 μL 菌液测定细菌浓度,绘制不同温度下各菌株的生长曲线。同样的方法,使5 株菌在pH 4.0、pH 6.0、pH 7.0 但温度同为35℃的条件下培养,间隔一定时间取100 μL 菌液测定细菌浓度,绘制不同pH 下各菌株的生长曲线。
1.2.3 Hep-2 细胞黏附试验
将0.5 MCF 菌液稀释20 倍后,加入Hep-2 细胞浓度为3.0×105/孔的培养板中(底部放置多聚赖氨酸爬片)置于35℃、5%CO2培养箱孵育2 h;弃上清,洗涤3 次,取出细胞爬片,革兰氏染色,晾干后封片;用正置激光共聚焦显微镜对爬片进行镜检及计数,重复3 次,计算黏附率。
1.2.4 RAW264.7 小鼠巨噬细胞吞噬试验
将0.5 MCF 菌液稀释20 倍后,加入RAW264.7细胞浓度为2.9×105/孔的培养板中(底部放置多聚赖氨酸爬片)置于35℃、5% CO2培养箱孵育16 h;弃上清,洗涤3 次,取出细胞爬片,行革兰氏染色,晾干后封片;用正置激光共聚焦显微镜对爬片进行镜检及计数分析,重复3 次,计算吞噬率。
1.2.5 RAW264.7 小鼠巨噬细胞内存活试验
将0.5 MCF 菌液稀释20 倍后,加入RAW264.7细胞浓度为2.9×105/孔的培养板中,置于35℃、5%CO2培养箱孵育24 h;取出细胞板,弃上清,洗涤3次;裂解细胞,将裂解后的细胞溶液梯度稀释,涂布MH(mueller-hinton)平板进行菌落计数,重复3次,计算吞噬细胞内存活率。
1.2.6 人全血白细胞吞噬率试验
依据羧基二乙酸荧光素琥珀酰亚胺酯(carboxyfluorescein diacetate,succinimidyl ester,CFDA SE)细胞增殖与示踪检测试剂盒说明书标记菌悬液,调浊度至0.5 MCF,取200 μL 菌液与等量新鲜全血充分混匀后置于35℃、5% CO2培养箱孵育2 h。取100 μL 菌血混合物与10 μLCD45 Per-CPCy5.5 抗体混合,避光标记15 min,随后加入450 μL 溶血素,立即上机,以侧向散射光SS 和CD45作图,检测有核细胞对不同菌株的吞噬率,重复3次,计算吞噬率。
1.2.7 人全血吞噬细胞内存活率试验
10 μL 0.5 MCF 菌液与190 μL 新鲜全血充分混匀后置于35℃、5%CO2培养箱孵育2 h,加入青霉素80 万单位继续孵育,20 h 后取出菌血混合物50 μL,充分混匀后将菌血混合物裂解、梯度稀释后涂布MH 平板,35℃、5%CO2培养箱培养24 h 后进行菌落计数。重复3 次,计算吞噬细胞内存活率。
1.2.8 基因组序列测定
菌株送广州华银医学检验中心进行序列测定和分析。
1.3 统计学方法
运用SPSS 20.0 软件进行统计分析。计量资料以表示,多组间比较采用单因素方差分析,组间两两比较方差齐时采用LSD 检验,方差不齐时采用Dunnett's T3 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 CAMP 实验
407 株GBS 仅1 株CAMP 实验阴性,该菌株分离自1 名2月龄男婴血液标本。选取这一株为实验菌株,另选4 株同期分离自血液的GBS 为对照实验菌株,菌株信息见表1。

表1 5 株GBS 信息Table 1 The information of five isolates of GBS
2.2 生长曲线测定
5 株GBS 在4℃或pH<4.0 环 境 中 均 不 生长。在pH 7.0 且温度分别为25℃和35℃培养环境中,温度为35℃且pH 分别为pH 6.0、pH 7.0 培养环境中,CAMP 阴性和阳性菌株生长曲线见图1。
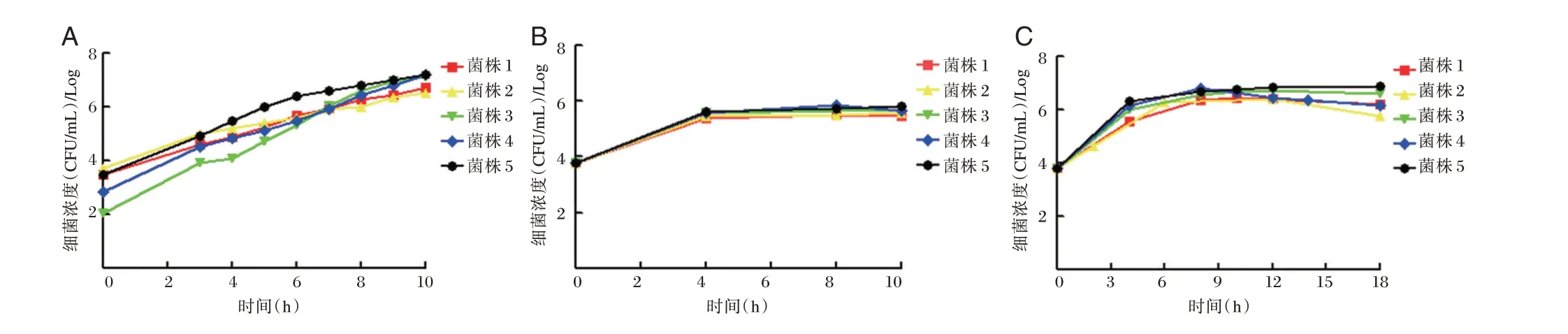
图1 GBS 生长曲线Figure 1 GBS growth curve
2.3 Hep-2 细胞黏附试验
共聚焦显微镜观察显示Hep-2 细胞周围存在GBS(图2)。5 株菌的黏附率分别为11.6%±1.1%、4.3%±0.5%、9.8%±0.7%、7.9%±0.2%、17.0%±0.6%,CAMP 实验阴性菌对Hep-2 细胞的黏附能力最强,差异有统计学意义(P<0.001)。
2.4 RAW264.7 小鼠巨噬细胞吞噬试验
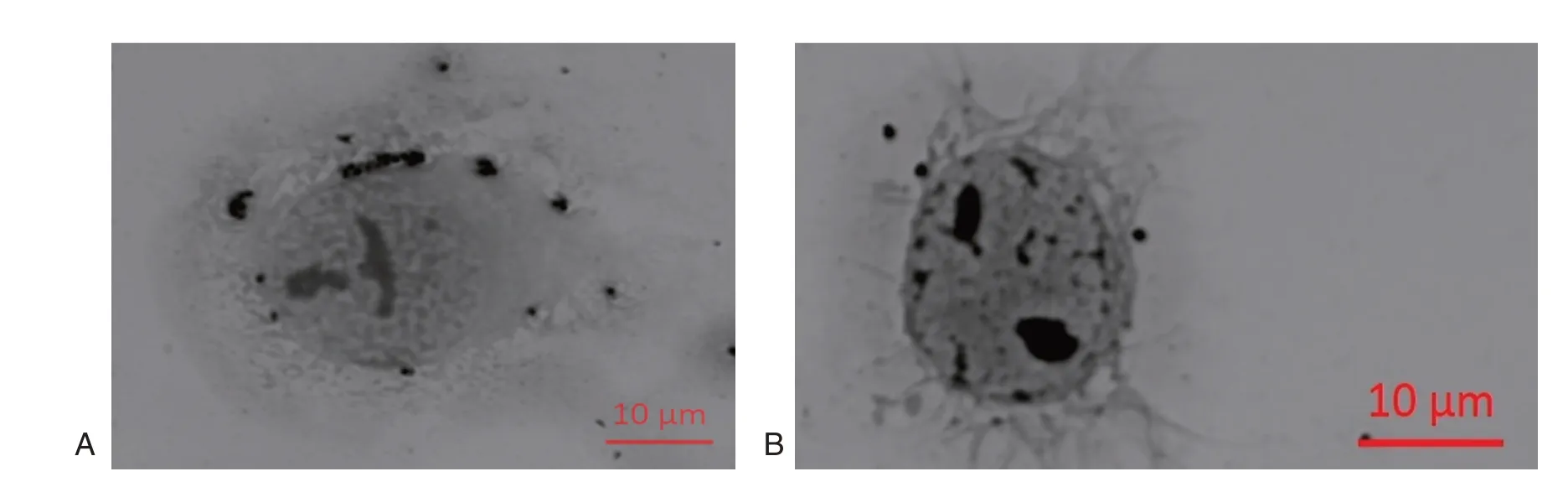
图2 GBS 黏附Hep-2 细胞 (革兰氏染色,×100)Figure 2 Adhesion to Hep-2 cell of GBS(Gram,×100)
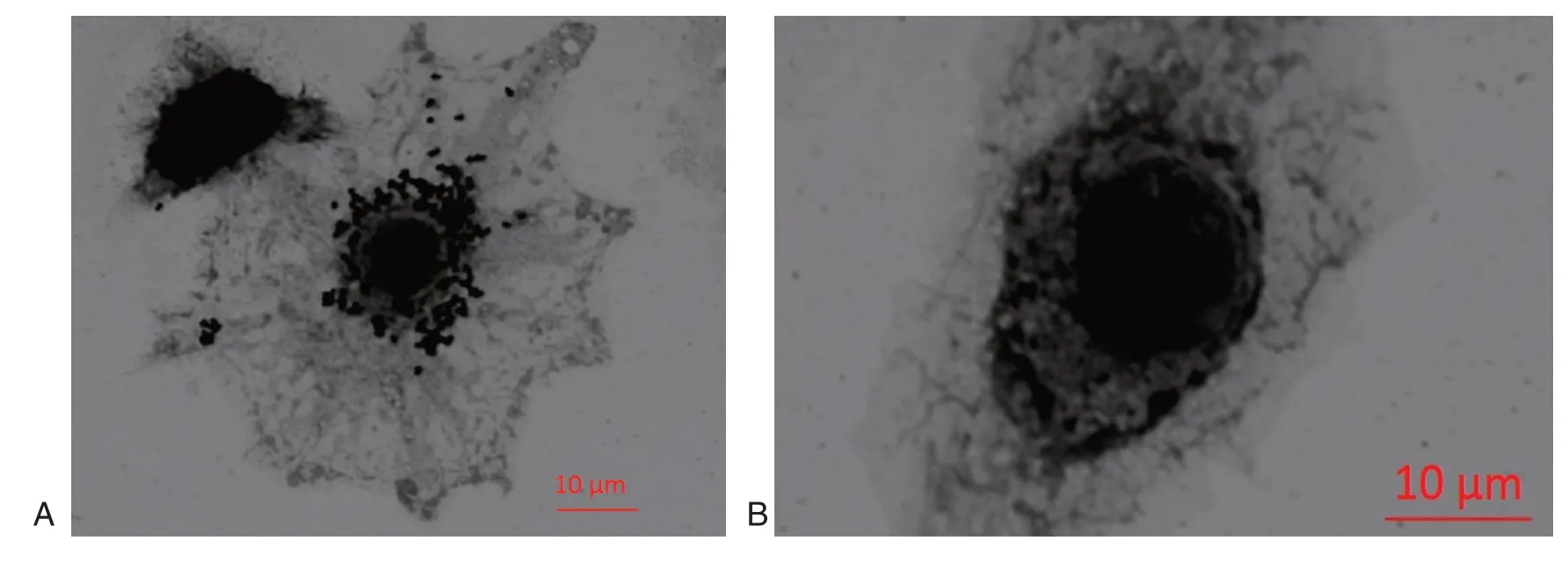
图3 GBS 被RAW264.7 细胞吞噬(革兰氏染色,×100)Figure 3 Phagocytosis to GBS of RAW264.7 cell(Gram,×100)
共聚焦显微镜观察显示RAW264.7 细胞内存在GBS(图3),表明GBS 可被RAW264.7 细胞吞噬。5株菌的吞噬率分别为3.5%±0.2%、3.1%±0.6%、3.7%±0.8%、3.5%±0.2%、13.4%±1.1%,RAW264.7 细胞对CAMP 实验阴性株的吞噬率高于CAMP 实验阳性株,差异具有统计学意义(P<0.001)。
2.5 RAW264.7 小鼠巨噬细胞内活性试验
5 株菌在小鼠巨噬细胞内24 h 存活率分别为10.9%±0.1%、16.1%±0.2%、13.6%±0.7%、15.7%±0.2%、10.9%±1.1%。CAMP 实验阴性株与阳性株菌株1 之间差异无统计学意义(P=0.92),但其小鼠巨噬细胞内24 h 存活率低于其它3 株CAMP 实验阳性株,差异有统计学意义(P<0.001)。
2.6 人全血白细胞吞噬率试验
流式细胞仪计数人全血中性粒细胞对5 株菌的吞噬率分别为10.7%±0.4%、14.1%±0.2%、21.1%±0.7%、9.5%±0.3%、26.2%±0.5%,结果显示CAMP 实验阴性菌最容易被中性粒细胞吞噬,差异有统计学意义(P<0.001)。流式细胞分析结果还显示:单核细胞对5 株菌的吞噬率分别为60.1%±0.6%、61.3%±0.2%、52.3%±1.4%、64.7%±1.9%、86.5%±0.2%。CAMP 实验阴性菌也最容易被单核细胞吞噬,差异有统计学意义(P<0.001)。图4所示为CAMP 实验阴性株和阳性株菌株1 的流式细胞仪检测结果。
2.7 人全血白细胞内存活率试验
5 株菌在人全血白细胞内24h 存活率分别为38.1%±3.3% 、34.4%±4.8% 、41.9%±11.0% 、42.8%±0.3%、19.6%±0.8%,将4 株阳性菌与阴性菌分别进行两两比较,P值分别为P=0.002、P=0.008、P=0.001、P<0.001,CAMP 实验阴性菌在白细胞内存活率最低,差异具有统计学意义(P<0.05)。
2.8 基因组序列测定
5 株菌进行了基因组重测序,并比较了5 株GBS 的fbsA、fbsB、scpB、lmb、bca、hylB、cfb、cyl、gbcA、neuA、neuB、neuC、neuD、rib、sip基因序列,发现CAMP 实验阴性菌株缺失cfb基因。其他毒力基因在5 株菌中均有检出。
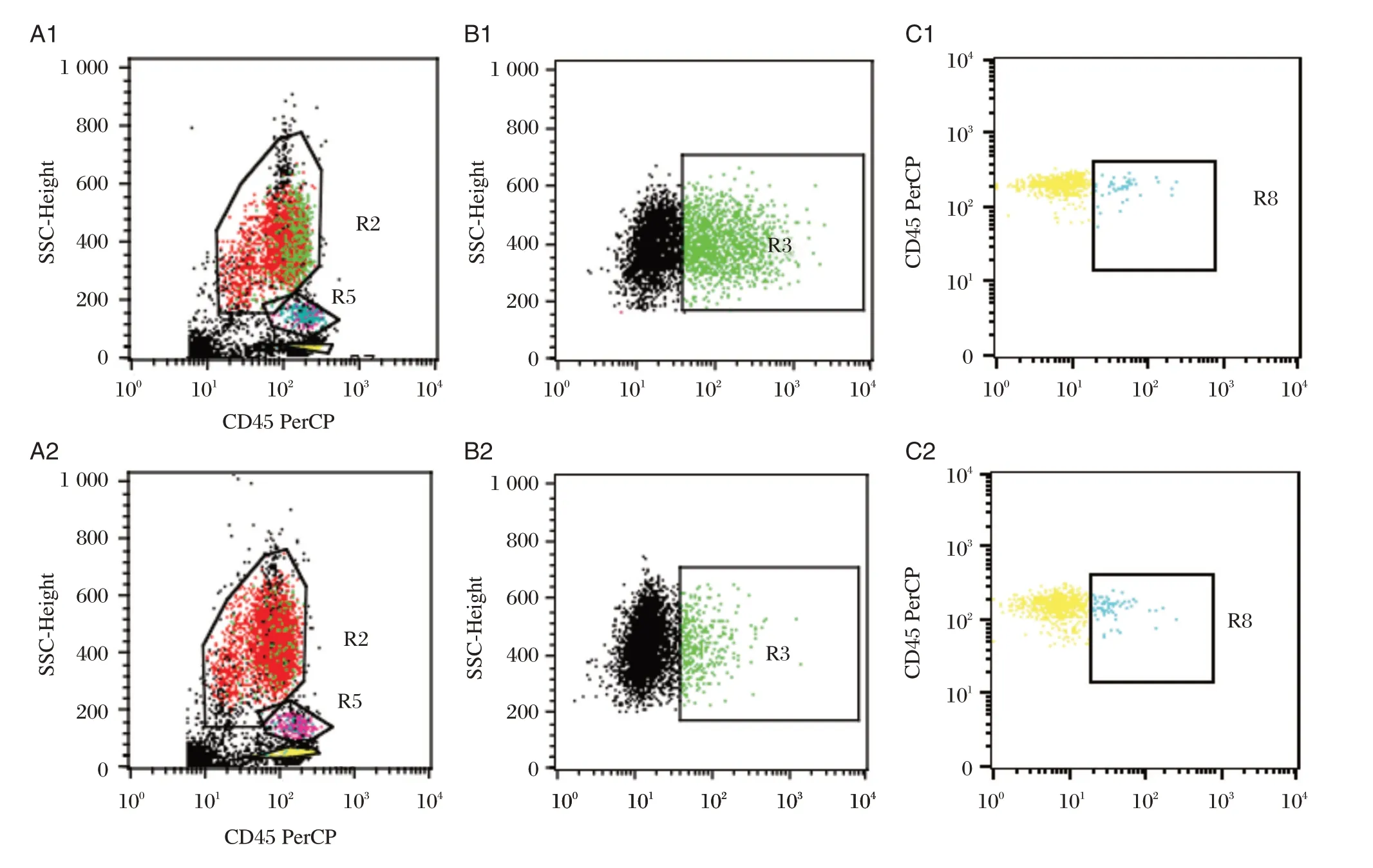
图4 人全血白细胞吞噬GBS 的流式细胞仪检测结果Figure 4 Flow cytometry results of human whole blood leukocytes phagocytizing GBS
3 讨论
GBS 通常正常定植于人体胃肠道及阴道,是一种条件致病菌。成年人感染类型主要包括肺炎、败血症、尿路感染、皮肤软组织感染等。GBS可通过孕产妇产道上行感染引发早产、流产、胎膜早破,也可通过母婴的垂直传播,引发新生儿败血症和脑膜炎[5],是一种围产期重点监测的病原菌。已有研究表明,GBS 致病主要涉及各种黏附因子(如纤维蛋白原结合蛋白、层黏蛋白结合蛋白、丝氨酸重复蛋白、免疫原性细菌黏附蛋白、αC 蛋白等)以及各种毒力因子(如CAMP 因子、细胞溶血素、荚膜多糖等)[6]。其中CAMP 因子是一个促溶血因子,能与金黄色葡萄球菌分泌的β 溶血毒素(神经磷脂酶C)共同作用,引发绵羊红细胞溶血程度增加[7],在血平板上形成伞状的透明溶血区域。由于CAMP 因子对GBS 有很高的特异性,因此广泛的被临床实验室用作鉴定GBS 的重要试验[8],其编码基因cfb常作为临床GBS 检测的分子靶标[9]。
虽然有研究表明CAMP 因子在机体系统感染过程中能削弱宿主的免疫功能[10],是一种重要的致病因子,也在活体动物试验中发现纯化的CAMP 因子可导致兔子及小鼠死亡[3,11-12],但Mary等[13]通过对cfb基因进行等位基因替换后的体外及体内试验研究认为CAMP 因子在GBS 的毒力系统中不是必须的。因此,有关CAMP 因子在侵袭性感染过程中的作用和作用机制还存在争议。
牛源、鱼源性GBS 分离株中有少量CAMP 阴性菌株的报道,但人源性CAMP 阴性GBS 仅见个案报道[14-15]。刘家玲等[15]的初步研究显示CAMP阴性菌株的基因组中含有cfb基因,推测是由于cfb基因突变导致的CAMP 阴性,或是由于调控元件CovR/S 的突变导致的CAMP 阴性。CovR/S 是GBS中重要的毒力因子相关基因的调控元件,可调控CAMP 因子编码基因cfb及细胞溶血素的编码基因cylE等。在CovR/S 突变的GBS 菌株中可看到GBS的β-溶血素增加及对各种上皮细胞的黏附增加,但CAMP 因子的活性下降的现象[16]。这与本实验中观察到的CAMP 阴性菌株对Hep-2 细胞的黏附能力最强现象相一致。由于CAMP 阴性GBS 的生物学意义未被充分认识,因此相关研究未见报道。
除了cfb基因,目前还有一些其他已知的毒力基因[12,17-18]:fbsA(编码纤维蛋白原结合蛋白A)、fbsB(编码纤维蛋白原结合蛋白B)、lmb(编码层黏蛋白结合蛋白)、bca(编码αC 蛋白)、scpB(与C5a肽酶有关)、neuA-D(编码荚膜多糖)、cyl(溶血素的分子基础)、hylB(编码透明质酸裂解酶)及gbcA、rib、sip(编码表面蛋白)等与GBS 对宿主细胞的黏附、侵袭或免疫逃避有关。为分析上述毒力基因在5 株GBS 中的分布差异,本研究应用下一代测序技术对5 株菌进行基因组重测序,测序结果表明,CAMP 阴性株cfb基因完全缺失,但其他已知毒力相关基因(fbsA、fbsB、scpB、lmb、bca、hylB、cyl、gbcA、neuA、neuB、neuC、neuD、rib、sip)在CAMP 阴性菌和4 株CAMP 阳性菌中均有检出。
不同于其他研究者使用基因工程质粒研究CAMP 因子生物学功能,本研究基于人源性侵袭性CAMP 因子天然缺失株,避免了引入外源性质粒本身对实验菌生物学表征的影响。初步研究结果显示CAMP 实验阴性株在黏附、抗吞噬以及吞噬细胞内存活能力等方面与阳性株之间存在显著差异,表明CAMP 因子确实是一种重要致病因子。但该株菌仍能引发严重侵袭性感染,又提示在CAMP 实验阴性GBS 侵袭性感染过程中可能存在代偿机制或途径。本研究为深入探讨CAMP 因子的生物学功能及作用机制奠定了基础。

