耐亚胺培南鲍曼不动杆菌的耐药机制研究和同源性分析
谭坪海 陈利达 郭鹏豪 廖康 伍众文 叶大柠 黄彬★
鲍曼不动杆菌(Acinetobacter baumannii,Ab)是非发酵革兰阴性杆菌[1],近年已成为我国重症监护病房检出率最高的病原菌[2]。Ab 耐药株的出现,给临床抗感染治疗带来很大的困难[3-4]。亚胺培南是碳青霉烯类抗生素的代表性药物,具有超广谱抗菌活性。随着亚胺培南在临床上的广泛应用,对亚胺培南耐药的临床分离菌株越来越多[5]。因此,本研究将对临床分离的耐亚胺培南Ab(imipenem-resistantAcinetobacter baumannii,IRAB)及同期对亚胺培南敏感的Ab 进行亚胺培南的耐药性变迁、耐药机制和暴发流行情况分析,从而为临床抗感染治疗及医院感染控制提供依据。
1 材料与方法
1.1 菌株来源
收集中山大学附属第一医院2011年1月至2014年12月间临床分离的Ab 1 761 株,其中IRAB 1 360 株,所有菌株均为分离自患者的第一株,菌株冻存于-80℃备用。质控菌株大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853 和金黄色葡萄球菌ATCC 29213 购自国家卫生健康委员会临床检验中心,沙门菌H9812 为本室保存。
1.2 主要仪器和试剂
9700 PCR 扩增仪购自美国ABI 公司,DYY-6C型电泳仪购自北京市六一仪器厂,FUSION Fx7 凝胶成像系统购自法国VILBER 公司,Vitek 2 Compact 全自动微生物分析系统购自法国生物梅里埃公司,Eppendorf 5415 离心机购自德国Eppendorf公司,PCR 试剂、DNA marker DL 2000、限制性核酸内切酶ApaI 和XbaI 均购自大连TaKaRa 公司。头孢哌酮/舒巴坦纸片购自英国OXOID公司。
1.3 细菌鉴定和药敏实验
采用Vitek2 Compact 全自动微生物分析系统鉴定细菌,采用K-B 法检测细菌对头孢哌酮/舒巴坦的敏感性,采用MIC 法检测细菌对其他药物的敏感性,药敏结果参照美国临床实验室标准化协会2017 版要求进行抗菌药物敏感性判断(CLSI M100-S27)[6]。
1.4 耐药基因检测
采用热裂解法(95℃,10 min)提取细菌DNA,采用大连TakaRa 公司PCR 试剂,反应体系为Ta-KaRa Taq(5 U/μL)0.25 μL,10×PCR buffer(Mg2+Plus)5 μL,dNTP Mixture(各2.5 mM)4 μL,DNA模板1 μL,引物1(20 μΜ)1 μL,引物2(20 μΜ)1 μL,灭菌蒸馏水加至50 μL。A-D 类β-内酰胺酶基因、外膜孔通道蛋白基因和主动外排泵基因的引物序列及扩增产物大小见表1。
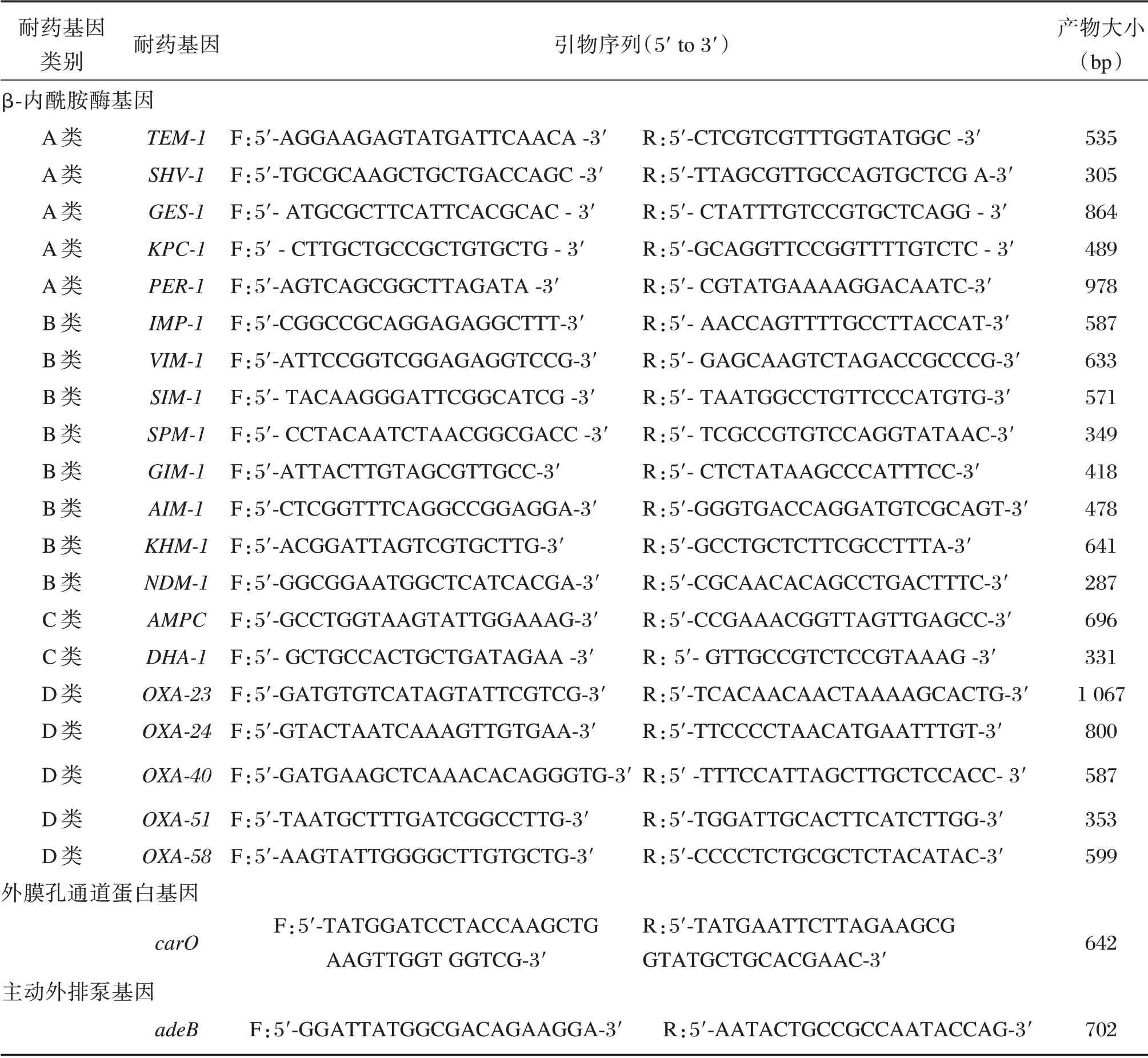
表1 耐药基因的PCR 引物序列及产物大小Table 1 PCR primers and product sizes of drug-resistance genes
PCR 循环参数为:93℃预变性2 min;93℃60 s,55℃60 s,72℃60 s,共35 个循环。扩增产物经1%琼脂糖凝胶电泳观察并记录结果,并送华大基因公司进行Sanger 测序验证。用NCBI 的Blast 软件(http://blast.ncbi.nlm.nih.gov/Blast.cgi)对耐药基因的测序结果进行序列比对。
1.5 Ab 分子分型和同源性分析
采用脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)法,从琼脂平板上收集对数生长期Ab,调节麦氏浊度为4.0。取400 μL 菌悬液37℃孵育5 min,分别加入蛋白酶K 至终浓度0.5 mg/mL,再与等体积低溶点琼脂混合,倒入模具。取出胶块加5 mL 细胞裂解液和25 μL 蛋白酶K,54℃水浴轻摇裂解2 h,用TE 缓冲液50℃水浴15 min 洗胶块6 次。切2 mm 胶块加入195 μL 酶切缓冲液中,再加入5 μLApaI,37℃酶切4 h,沙门菌H9812 用XbaI 酶切,其余实验条件与受试菌株相同。酶切好的胶块粘在梳子上制胶、电泳,电泳温度14℃,电压6 V,夹角120°,脉冲时间5~20 s,电泳18 h。EB 染色20 min,纯水脱色30 min,凝胶成像仪上读取图像。应用聚类分析软件BioNumeric(Version 6.0)对PFGE 条带进行分析。
1.6 统计学分析
采用SPSS 13.0 软件进行统计处理,计量资料采用百分率表示,采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 药敏结果
临床分离的1 761 株Ab,对氨苄西林/舒巴坦、庆大霉素、哌拉西林/他唑巴坦、亚胺培南、头孢吡肟、复方新诺明、环丙沙星、头孢他啶的耐药率逐年下降,其中亚胺培南的耐药率从84%下降至71.8%,见表2。
除替加环素外,临床分离的1 360 株IRAB 对氨苄西林/舒巴坦、哌拉西林/他唑巴坦、头孢他啶、头孢吡肟、环丙沙星、氨曲南和亚胺培南等常用抗生素的耐药率均较高,达到95.0%以上,对左氧氟沙星的耐药率为64.7%,IRAB 表现为多重耐药,见表3。
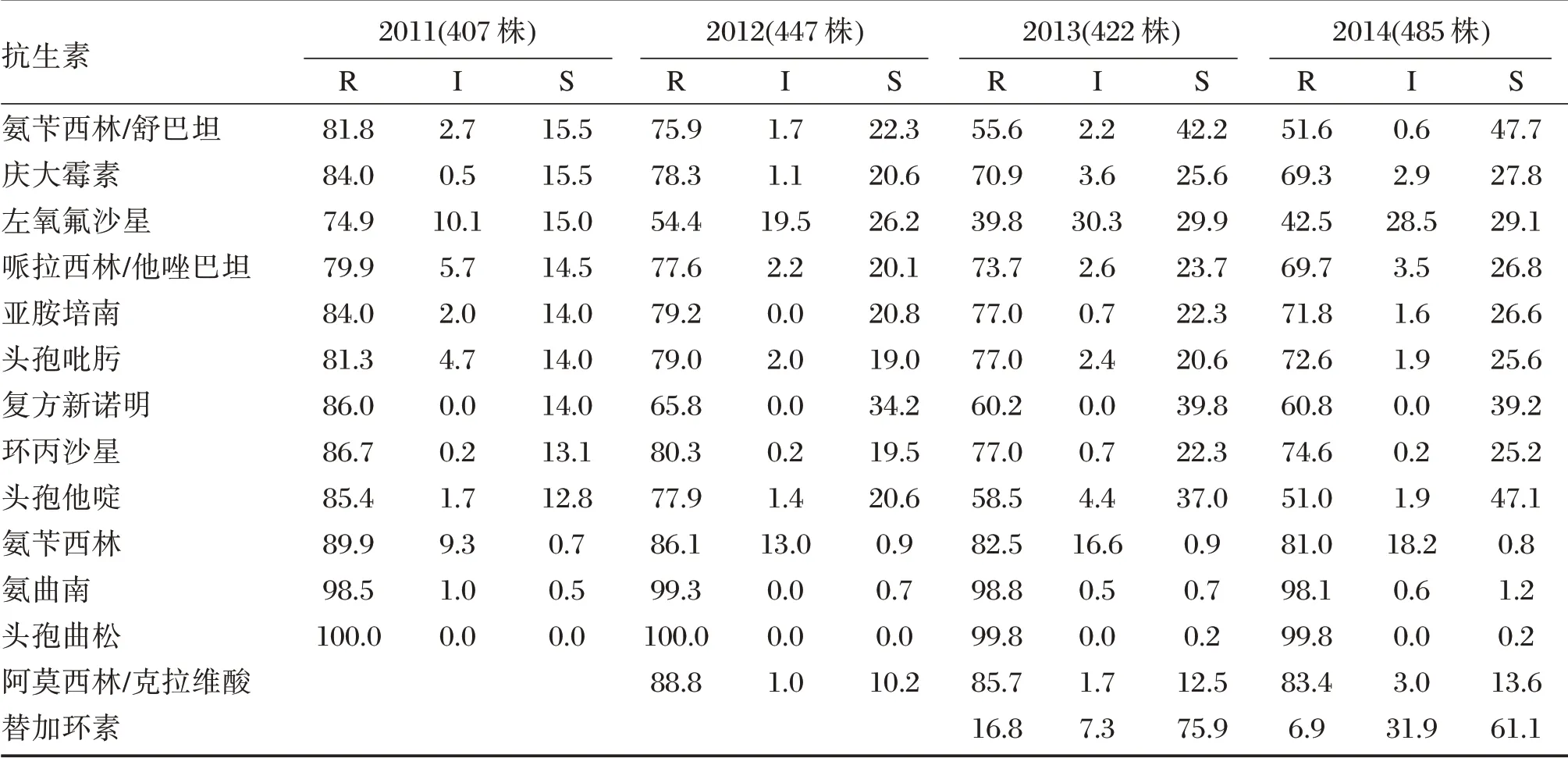
表2 2011 至2014年间1 761 株鲍曼不动杆菌对常用抗生素的药敏结果(%)Table 2 Drug susceptibility results of 1 761 strains of Acinetobacter baumannii from 2011 to 2014(%)
2.2 耐药基因检测结果
耐药组中耐药基因TEM(A 类)、AMPC(C类)、OXA51(D 类)阳性率分别为95.45%、98.48%和96.97%,对照组分别为35.71%、64.29%和71.43%,耐药组均高于对照组,差异均有统计学意义(P<0.05)。D 类β-内酰胺酶基因OXA23、OXA58仅在耐药组中检出,阳性率分别为95.45%和1.52%。在对照组与耐药组中均未检出其他A-D类β-内酰胺酶耐药基因SHV、GES、KPC、PER、IMP、VIM、SPM、GIM、AIM、NDM、AMPC、DHA、OXA24、OXA40和外膜孔通道蛋白基因CARO、主动外排泵基因ADEB。
2.3 Ab 分子分型和同源性分析
PFGE 将66 株IRAB 和14 株对亚胺培南敏感的Ab 分为A~W 共23 个型别,其中P 型26 株,Q 型6 株,R 型19 株,其余型别每个型少于3 株。P 型有P1-P7 7 个亚型,Q 型有Q1-Q3 3 个亚型,R 型有R1-R4 4 个亚型。耐药组主要为P1 型(16 株)、R1 型(4 株)和R2(12 株)型,对照组分布分散,其中R4 型同时有耐药菌和敏感菌。PFGE 结果见图1,聚类分析图见图2。
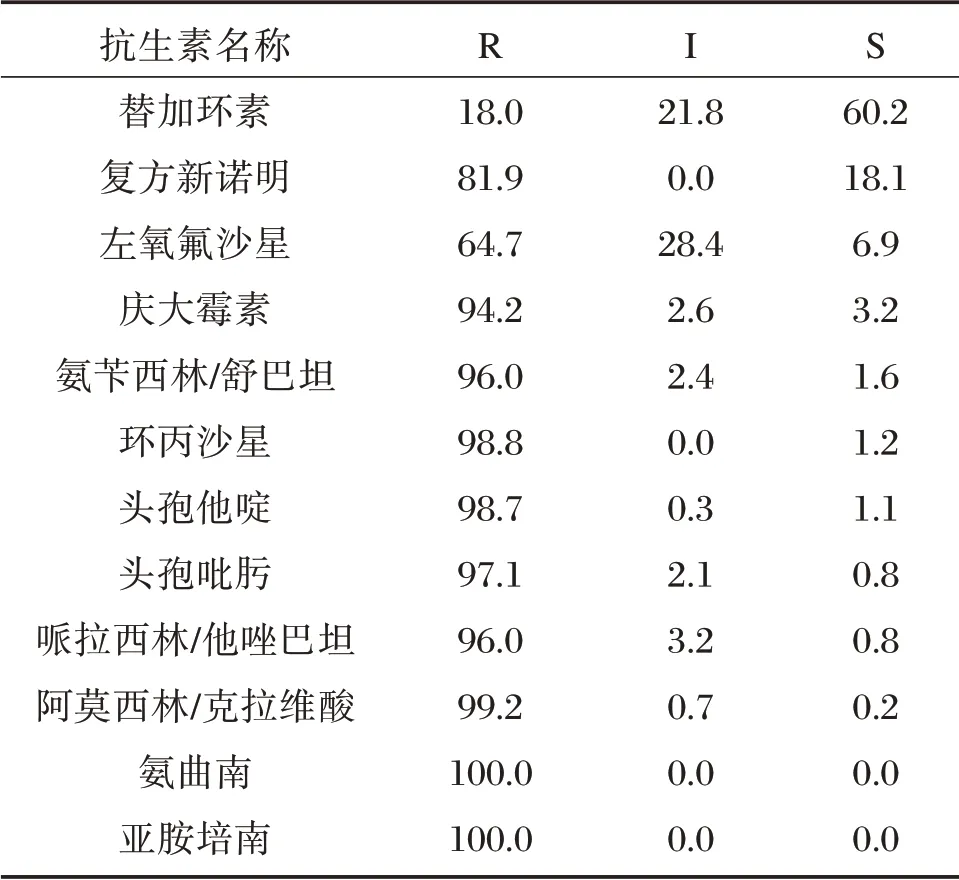
表3 2011 至2014年间1 360 株IRAB 对常用抗生素的药敏结果(%)Table 3 Drug susceptibility results of 1 360 strains of IRAB from 2011 to 2014(%)
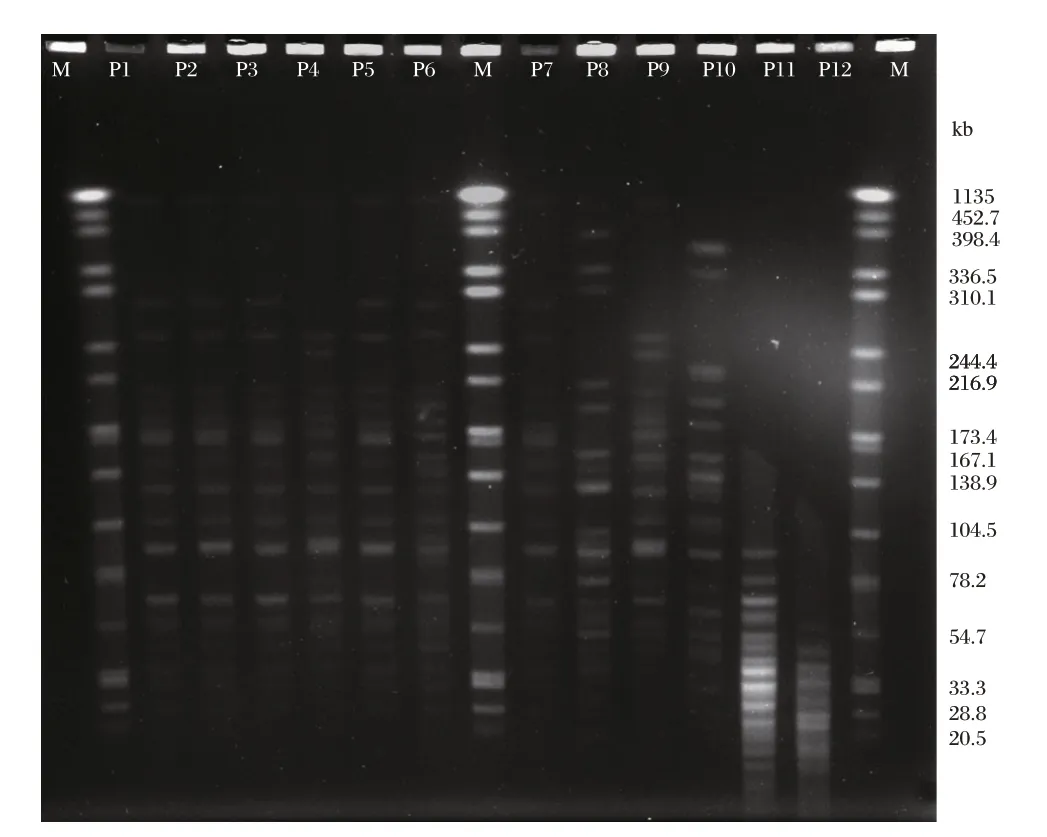
图1 部分Ab 脉冲场凝胶电泳图Figure 1 Results of pulsed-field gel electrophoresis of Acinetobacter baumannii
2011 至2014年间IRAB 引起院感暴发5 次,2012年2 次,分别为P1 型(9月-11月)(内科重症监护室,medical intensive care unit,MICU)、(外科重症监护室,surgury intensive care unit,SICU),R2 型(9月-11月)(MICU);2013年2 次,分别为P1 型(4月-6月)(MICU、SICU、神经科),R1 型(2013年12月-2014年2月)(MICU、神经科);2014年1 次,为R2 型(2月-4月)(MICU、SICU、神经科)。
3 讨论
Ab 是医院感染的重要病原菌,近年来出现严重的耐药性[7]。以亚胺培南为代表的碳青酶烯类抗生素曾被誉为“最后一道防线”[8],然而,IRAB 的分离率逐年上升[9-10],患者感染死亡率增加[11]。对本院2011 至2014年间临床分离的IRAB 进行了药敏、耐药机制和分子流行病学研究,以期为临床合理用药和控制院感暴发提供依据。
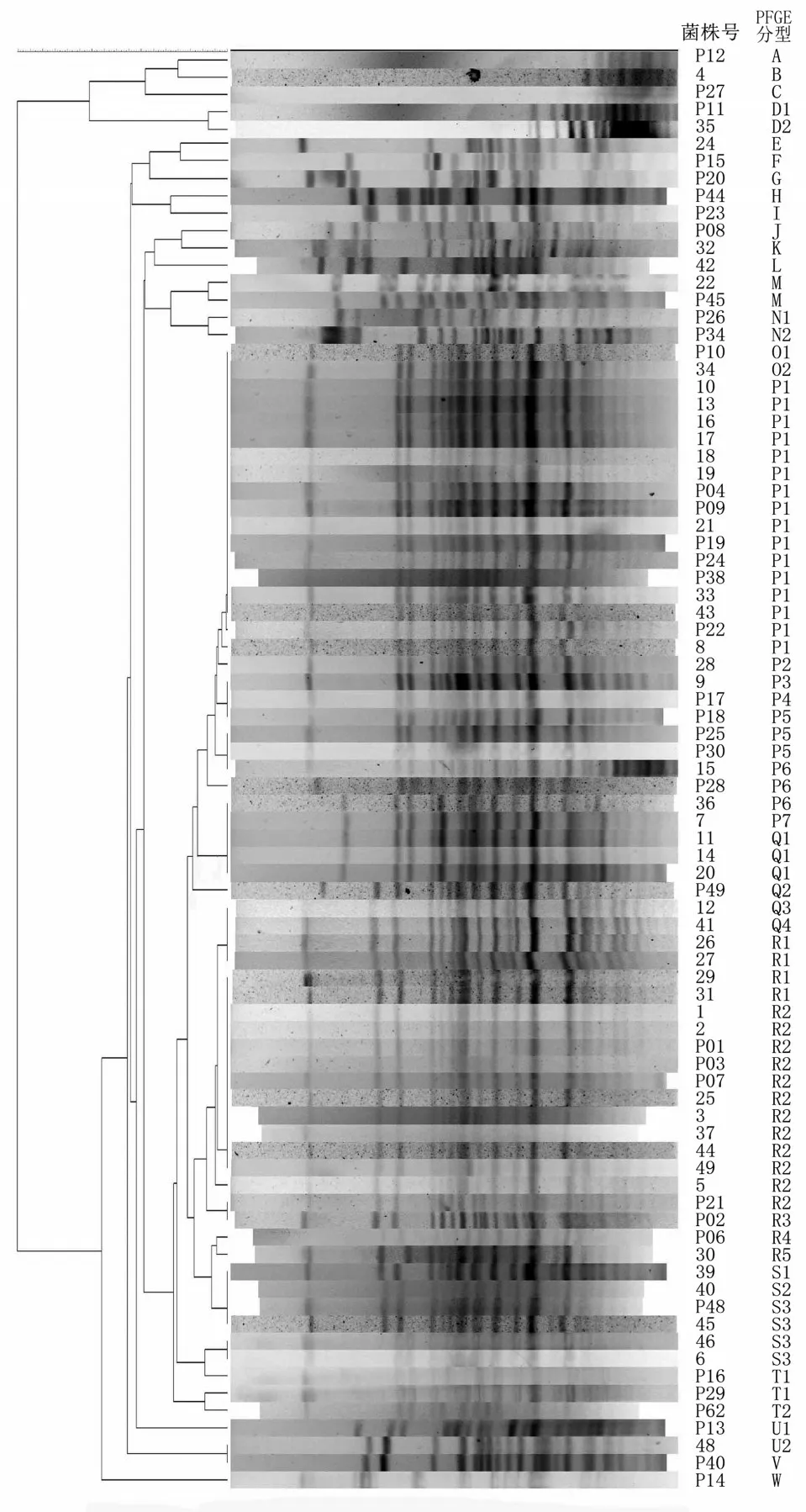
图2 脉冲场凝胶电泳聚类分析图Figure 2 Results of cluster analysis by BioNumeric(Version 6.0)of PFGE
2011至2014年间,亚胺培南耐药率呈逐年下降趋势,与医院加强抗生素的管理密切相关。本课题组前期发现,2007 至2010年间Ab 对亚胺培南的耐药率逐年上升(13.1%~59.5%)[12]。此次Ab 在2011 至2014年间却出现了逐年下降的趋势(84%~71.8%),这与周秀岚等[13]报道的2009至2013年逐年上升(25.30%~90.07%)相异。这是由于本院自2011年起,加强了细菌的耐药性监测和院感防控,及时控制住了Ab 耐药性上升的势头。
Ab一旦对亚胺培南耐药,对其他抗生素也几乎全部耐药,因此避免抗生素的滥用是关键。本研究中,1 360 株IRAB 对其他抗生素几乎全部耐药,耐药率高达94.2%~100%,与辜裕光[14]报道的IRAB 对头孢唑林、呋喃妥因、氨曲南等耐药率均在95%以上相符。可能是由于亚胺培南是高耐药潜能药物,Ab 在多种机制作用下才能对亚胺培南产生耐药作用[15],而Ab 对大多数抗生素只是通过其中一种或几种机制即可产生耐药,因此当Ab 对亚胺培南耐药时,其耐药机制也往往同时对大多数抗生素产生了作用,导致广泛耐药。
替加环素对本院IRAB 显现了良好的抗菌作用,2014年的耐药率仅为6.9%。Trebosc 等[16]认为,替加环素有拮抗细菌的外排泵和核糖体保护两种耐药机制,是新一类甘氨酰四环素类抗生素,具有超广谱的抗菌活性。Hornsey 等[17]发现,若AdeABC 外排泵蛋白过表达,则会介导替加环素耐药。本院IRAB 对替加环素敏感,可能是由于IRAB 外排泵耐药基因adeB 未检出,不存在外排泵蛋白过表达情况;同时替加环素本身对细菌外排泵也有拮抗作用,所以替加环素对本院IRAB 的抗菌效果良好。因此,防止IRAB 耐药的最有效措施是控制抗生素尤其是替加环素的滥用,避免出现更严重的超级耐药菌。
本院IRAB 的耐药机制是碳青霉烯酶类多重亚型共同作用的结果,尤以OXA-23基因介导的耐药机制为主。IRAB 的耐药机制复杂,主要有产生碳青霉烯酶、改变药物靶点、外膜孔通道蛋白缺失、主动外排泵将药物泵出体外等[15]。本院编码碳青霉烯酶的A、C、D 类基因阳性率在耐药组中显著高于敏感组。特别的是,D 类OXA-23基因在敏感组中全阴性,而在耐药组中高达95.45%,比本课题组前期研究中[12]2007 至2010年间的20.7%明显增加。提示OXA-23基因编码碳青霉烯酶,已成为2011 至2014年间本院Ab 对亚胺培南耐药的最主要机制。这可能是由于OXA-23基因主要存在于质粒上[18],在抗生素选择压力下,质粒在Ab 中水平转移[19],导致携带OXA-23的IRAB 广泛传播。而其他耐药机制如外膜孔通道蛋白和主动外排泵类的耐药基因在本研究中未检出,提示这些机制在本院IRAB 中并未发生作用或作用很小。
2011 至2014年间存在5 次IRAB 引起的院感暴发,均分布于MICU、SICU 和神经科,与Bogaty等[20]报导的院感多暴发于ICU 相符。可能与这3个科室患者自身疾病重、免疫功能低下、侵入性操作多及广谱抗菌药物大量使用有关。因此,应加强院感防控工作:对ICU 和神经科进行重点管理,对呼吸机、气管插管等定期灭菌,对病房空气等消毒处理,对医护人员卫生规范培训等,将有效地减少甚至消除IRAB 的暴发流行。
综上所述,实验室应加强IRAB 及其他细菌的耐药性监测,指导医生调整抗菌治疗方案,协助医院把握院感防控重点;临床医生应避免滥用抗生素,医护人员应及时对医院环境消毒灭菌,防止耐药菌株蔓延;院方应建立院感防控的奖惩机制。在多方合力下,将对抗生素的合理使用、降低细菌耐药性和院感暴发率产生重要意义。

