利多卡因对发育期海马神经细胞生长的抑制作用及相关机制研究
陈兰涛 孙鑫 尹辉 姚亚飞 段宝民
利多卡因是一类镇痛作用较好的酰胺类麻醉药物,临床实践发现利多卡因可导致患者出现头晕、低血压及肢体功能障碍,因而利多卡因对患者的副作用日益受到关注[1]。海马主要由神经干细胞聚集形成,参与学习、记忆及情绪等重要功能的调控。李顺洪等[2]通过动物实验研究发现利多卡因可抑制大鼠的学习及运动功能。游仁芳等[3]发现利多卡因可导致部分老年患者术后发生认知功能障碍,可能由于利多卡因对患者中枢神经系统产生毒性。目前利多卡因对神经细胞的毒理机制尚不明确,本研究探讨利多卡因对发育期海马神经细胞生长的影响及相关作用机制,为进一步改善临床麻醉用药提供实验参考。
1 材料与方法
1.1 细胞培养
大鼠发育期海马神经细胞购自上海斯信生物科技有限公司,采用含10%胎牛血清及150 U/L 青霉素的达尔伯克改良伊格尔(Dulbecco's Modified Eagle's Mediium,DMEM)培养液,通过做浓度依赖实验确定利多卡因实验浓度,依据不同浓度利多卡因分为3 组,其中对照组给予0.9%生理盐水处理,不加利多卡因,A 组加入1 μM 利多卡因,B 组10 μM 利多卡因。置于37℃,5%CO2条件培养。
1.2 主要试剂及仪器
DMEM 培养基购自上海博升生物科技有限公司;Trizol 试剂购自美国invitrogen 公司;胰酶购自德国Sigma 公司;逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒购自日本TaKaRa 公司;mTOR、CyclinD1、Cleaved caspase3、GAPDH 一抗及HRP 标记的二抗购自北京博奥森生物技术有限公司;MDF-394 超低温冰箱购自日本三洋公司;DYCP-31DN 电泳仪购自北京六一仪器厂;CyFlow Cube 流式细胞仪购自德国Partec公司;SW-CJ-1B 超净工作台购自上海苏净实业有限公司;HH-CP-01P CO2培养箱购自上海皓庄仪器有限公司;Allegra 64R 高速离心机购自美国贝克曼公司;Multiskan FC 酶标仪购自美国赛默飞世尔科技公司。
1.3 MTT 法检测海马神经细胞增殖能力
将海马神经细胞接种在96 孔板,细胞数量为1×104/孔,每组设3个复孔。对照组加入生理盐水,A组加入1 μM 利多卡因,B 组10 μM 利多卡因。置于37℃,5%CO2条件分别培养0、1、2、3、4、5 d 后弃上清液,每孔加入10 μL MTT 溶液,孵育4 h 后弃上清液,每孔加入80 μL 二甲基亚砜(dimethyl sulfoxide,DMSO),在450 nm波长采用酶标仪检测各孔OD值。
1.4 流式细胞术检测发育期海马神经细胞的细胞周期
对照组给予0.9%生理盐水处理,不加利多卡因,A 组加入1 μM 利多卡因,B 组10 μM 利多卡因。置于37℃,5% CO2条件培养24 h 后,以1 500 rpm 离心10 min 后经预冷PBS 清洗,并将细胞浓度调整为1×105/mL,取0.5 mL 细胞悬液后加入预冷的70%乙醇固定6 h,以1 500 rmp 离心后弃上清液,经预冷PBS 清洗后,加入1 mL 的PI 染色液,置于4℃条件避光孵育25 min,在488 nm 处采用流式细胞仪检测细胞周期状况。
1.5 Annexin V-FITC/PI 双染色法检测发育期海马神经细胞的凋亡率
对照组给予0.9%生理盐水处理,不加利多卡因,A 组加入1 μM 利多卡因,B 组10 μM 利多卡因。置于37℃,5% CO2条件培养24 h 后,经预冷PBS 清洗,各组细胞加入300 μL Binding Buffer 悬浮细胞,然后加入10 μL Annexin VEGFP,孵育10 min 后加入10 μL PI,混匀后避光静置10 min。采用流式细胞仪检测神经细胞凋亡情况。
1.6 RT-PCR 检测mTOR、CyclinD1 及Cleaved caspase3 基因水平
对照组给予0.9%生理盐水处理,不加利多卡因,A 组加入1 μM 利多卡因,B 组10 μM 利多卡因。置于37℃,5% CO2条件培养24 h,收集细胞后采用Trizol 法提取总RNA,经RNA 质检合格后,通过RNA 反转录反应合成cDNA。采用Prime5.0 软件设计基因引物,以GAPDH基因为内参,mTOR基 因:正 向 引 物5′- CGACTGCATGCATGCAC-3′,5′-CGACTGCATGTGCAC-3′;CyclinD1基因:正向引物5′-GCACGTGCA-GTAGCCAC-3′,5′-CGTGACTGCACTGATC-3′;Cleaved caspase3基因:正向引物5′-GTATGCAGTCACTGC-3′,5′-GCATGCAG TCGTCAGC-3′;GAPDH基因:正向引物5′-CTGACTGACGTCACGTC-3′,5′-GTACGTGCA-CT GCAGC-3′;扩增反应条件为:95℃25 s;95℃5 s,58℃30 s,72℃60 s,反应32 个循环后,通过2-△△Ct法计算目的基因相对表达水平。mTOR基因扩增产物大小为217 bp;CyclinD1基因扩增产物大小为342 bp;Cleaved caspase3基因扩增产物大小为249 bp;GAPDH基因扩增产物大小为273 bp。
1.7 Western blotting 检 测mTOR、CyclinD1 及Cleaved caspase3 蛋白水平
对照组给予0.9%生理盐水处理,不加利多卡因,A组加入1 μM利多卡因,B组10 μM利多卡因。置于37℃,5%CO2条件培养24 h,收集细胞后加入RIPA细胞裂解液,置于4℃条件20 min后,以12 000 rpm离心10 min,收集上清液并采用BCA 法检测蛋白浓度,将蛋白样本液与上样缓冲液混匀后,沸水浴5 min,待冷却后上样(每孔15 μg),采用10%的SDSPAGE 电泳,通过湿转法将分离的蛋白转至PVDF膜,然后采用含5%脱脂奶粉的封闭液孵育2 h,经TBST 清洗3次后加入mTOR、CyclinD1、Cleaved caspase3和GAPDH的一抗,置于4℃孵育过夜,经TBST液洗涤后,加入HRP 标记的二抗,置于摇床晃动2 h。采用TBST 液洗涤3 次后,加入增强型化学发光(enhanced chemiluminescence,ECL)试剂显色,曝光、拍照后采用Image Lab软件分析蛋白条带灰度值。
1.8 统计学处理
采用SPSS 21.0 分析数据,计量数据以均数±标准差表示,采用独立t检验。P<0.05 差异有统计学意义。
2 结果
2.1 利多卡因对各组发育期海马神经细胞增殖能力的影响
通过MTT 实验发现第2 d 后A 组及B 组神经细胞增殖水平显著低于对照组(P<0.05);第2 d 后B组神经细胞增殖水平显著低于A 组(P<0.05)。利多卡因可促使发育期海马神经细胞数量下降、形态异常。见表1、图1及图2。
2.2 利多卡因对各组发育期海马神经细胞的细胞周期影响
本研究发现利多卡因处理24 h 后,A 组及B 组的G0/G1 期细胞比例均显著高于对照组(P<0.05);B 组的G0/G1 期细胞比例显著高于A 组(P<0.05);A 组及B 组的S 期细胞比例显著低于对照组(P<0.05);B 组的S 期细胞比例显著低于A 组(P<0.05);A 组及B 组的G2/M 期细胞比例显著低于对照组(P<0.05);B 组的S 期细胞比例显著低于A 组(P<0.05)。见图3。

表1 利多卡因对发育期神经细胞增殖水平的影响Table 1 The effect of lidocaine on the proliferation of neurons during development
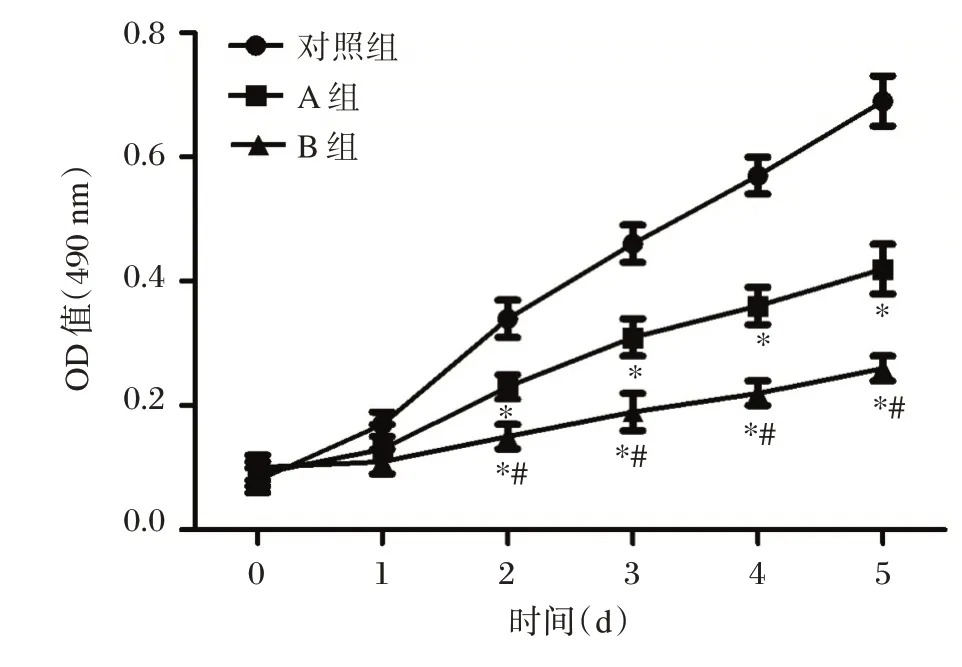
图1 利多卡因对发育期神经细胞增殖能力的影响Figure 1 Effect of lidocaine on proliferation of developing nerve cells
2.3 利多卡因对各组发育期海马神经细胞的细胞凋亡影响
本研究发现利多卡因处理24 h 后,A 组及B 组细胞凋亡率均显著高于对照组(P<0.05);B 组细胞凋亡率显著高于A 组(P<0.05)。见图4。
2.4 利多卡因对各组发育期海马神经细胞mTOR、CyclinD1 及Cleaved caspase3 基因水平的影响
利多卡因处理24 h 后,A 组及B 组的mTOR、CyclinD1基因水平均低于对照组(P<0.05);B 组的mTOR、CyclinD1基因水平低于A 组(P<0.05);A 组及B 组的Cleaved caspase3基因水平显著高于对照组(P<0.05);B 组Cleaved caspase3基因水平显著高于A 组(P<0.05)。见图5。
图2 利多卡因对发育期神经细胞生长的影响Figure 2 Effects of lidocaine on the growth of neurons during development
2.5 利多卡因对各组发育期海马神经细胞mTOR、CyclinD 1 及Cleaved caspase 3 蛋白水平的影响
利多卡因处理24 h 后,A 组及B 组的mTOR、CyclinD1 水平均低于对照组(P<0.05);B 组的mTOR、CyclinD1 低于A 组(P<0.05);A 组及B 组的Cleaved caspase 3 水平显著高于对照组(P<0.05);B 组Cleaved caspase 3 水平显著高于A 组(P<0.05)。见图6。
3 讨论
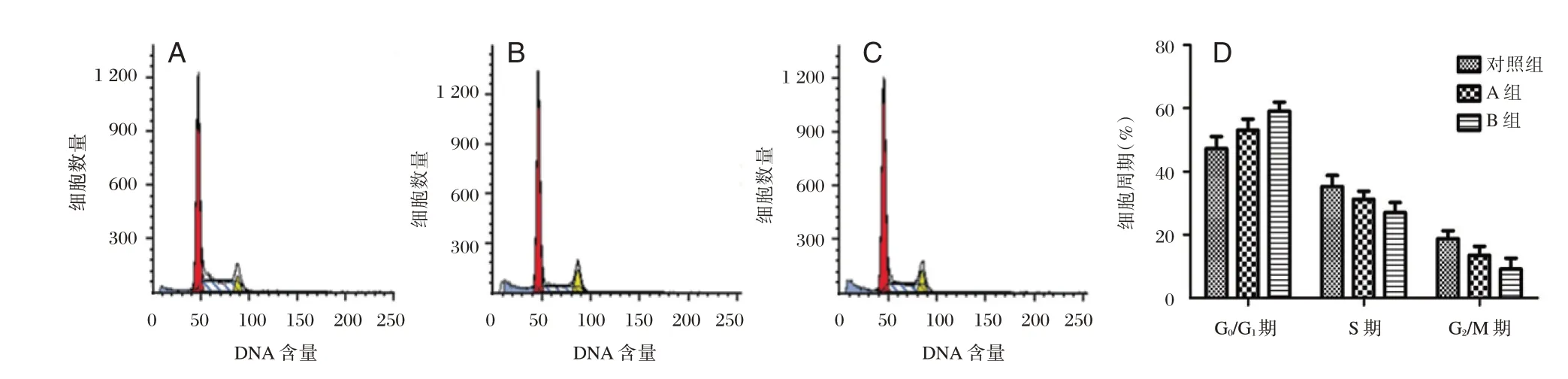
图3 利多卡因对发育期海马神经细胞的细胞周期的影响Figure 3 Effect of lidocaine on cell cycle of cultured hippocampal neurons

图4 利多卡因对发育期海马神经细胞的凋亡率影响Figure 4 Effect of lidocaine on the apoptosis rate of hippocampal neurons during development
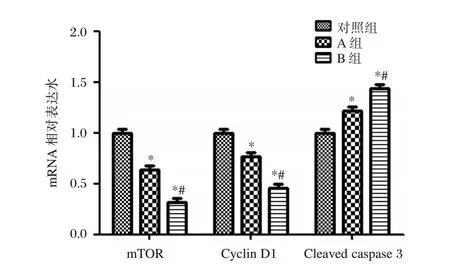
图5 利多卡因对发育期海马神经细胞相关基因水平的影响Figure 5 Effect of lidocaine on the level of related gene in hippocampus of developing hippocampal neurons
利多卡因是临床应用较为广泛的麻醉药物,具有起效快、麻醉效果好等特点,但其对神经系统的副作用日益受到关注,利多卡因可能影响神经细胞的可塑性,并导致神经细胞功能受损[4-6]。有临床研究发现大剂量使用利多卡因可能导致手术患者发生神经退行性病变,促使患者术后学习能力下降[7]。Patterson 等[8]研究发现小鼠视神经细胞经8 μM 利多卡因作用12 h 后,细胞内DNA 发生降解并出现凋亡小体,提示利多卡因可促进神经细胞发生凋亡。郭艳辉等[9]研究发现利多卡因麻醉可能导致患者发生马尾综合症,从而造成患者神经损伤。通常神经系统发育过程中衰老神经细胞将发生凋亡,有助于神经祖细胞分化、成熟,从而保持神经元维持正常的生理功能,但利卡多因的使用可能促使发育期海马神经元凋亡率异常上升,对患者的记忆力及认知功能等造成损伤。目前利多卡因在临床应用较广,为降低利多卡因对患者的神经毒性,探讨利多卡因对神经细胞损伤的毒理机制有重要临床价值。
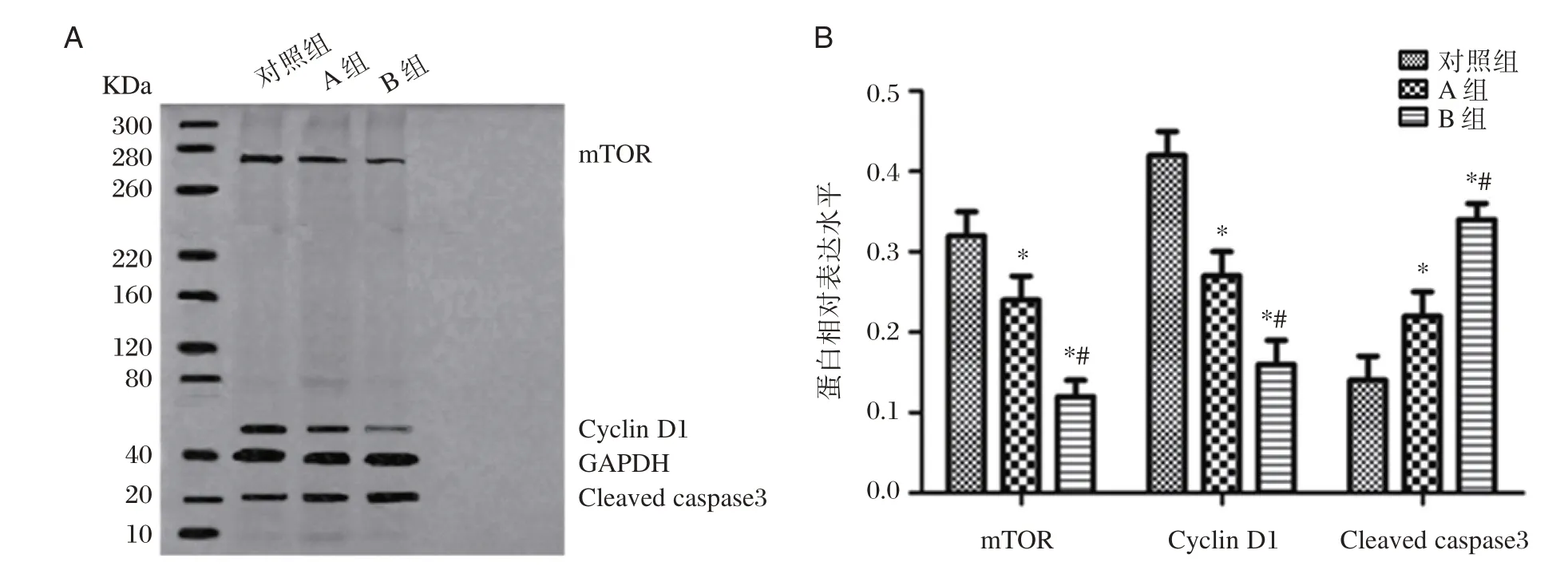
图6 利多卡因对发育期海马神经细胞相关蛋白水平的影响Figure 6 Effect of lidocaine on the level of related protein in hippocampus of developing hippocampal neurons
本研究通过MTT 实验发现利多卡因可抑制发育期海马神经细胞的增殖能力,并且高浓度的利多卡因的抑制效果更强,导致G0/G1期神经细胞比例上升,从而抑制肿瘤细胞增殖。已有研究发现丙泊酚可干扰发育期海马神经元的细胞周期,促使细胞G0/G1期进入S 期,并且导致细胞停滞于S期[10-11]。这表明利卡多因抑制细胞增殖的机制与丙泊酚存在差异,G0/G1期转入S 期的控制蛋白主要为cyclin D1、CDK4 和CDK6 等周期蛋白,利卡多因可能抑制这几类蛋白的活性,从而促使G0/G1期神经细胞比例上升。细胞由S 期转入G2/M 期主要受CDK1 激酶调控,丙泊酚对该类蛋白的活性产生干扰作用。本研究通过流式细胞术发现利多卡因可促进发育期的海马神经细胞发生凋亡,并且B组的海马神经细胞凋亡水平高于A 组。Western blotting 发现发育期海马神经细胞经利多卡因处理后cyclin D1 及mTOR 表达水平下降,提示利多卡因可能通过抑制PI3K/Akt/mTOR 信号通路干扰发育期海马神经细胞的正常生理功能。有研究发现利多卡因可抑制小鼠成纤维细胞PI3K/Akt/mTOR 信号通路的激活,促使细胞生长功能障碍,并导致细胞凋亡率上升[12]。这表明利多卡因的细胞毒性与PI3K/Akt/mTOR 信号通路密切相关,为研究如何缓解利卡多因的毒性提供了作用靶点。有研究发现利卡多因可促进肺癌细胞内p38MAPK 信号转导,调控细胞代谢相关基因的表达及翻译,导致凋亡蛋白Caspase-3、Bax 水平异常,并最终促进细胞发生凋亡[13-15]。这与本研究结果不一致,提示利多卡因的细胞毒性机理可能涉及多种信号通路,需要综合分析利多卡因对细胞的生长、凋亡作用机制。有研究发现利多卡因可抑制GAP-43 及p-GAP-43 等蛋白水平促使神经细胞内细胞骨架形成障碍,从而诱导神经突起分支数量下降,并对促使神经细胞突触功能异常[16-17]。这说明利多卡因对神经细胞的损伤机制较为复杂,不仅可干扰神经细胞的增殖、凋亡,同时可能对细胞的形态、结构产生一定的影响,为了充分阐明利卡多因对神经细胞的损伤,需进一步分析其细胞的形态、其它关键代谢基因的影响,以期寻找可能逆转神经细胞损伤的作用靶点。
综上所述,利多卡因可抑制发育期海马神经细胞生长,并诱导神经细胞发生凋亡,可能与抑制PI3K/Akt/mTOR 信号通路有关,为治疗利多卡因的神经细胞毒性提供实验依据。

