经圆窗膜鼓阶显微注射腺相关病毒转染小鼠耳蜗的研究△
陈嘉伟 王卫龙 丁雪瑞 赵倩倩 安晓刚 王人凤 卢连军
耳聋是人类最常见的感觉神经系统疾病,全世界有超过50%的先天性耳聋由遗传因素导致[1]。基因治疗长期以来被认为是治疗遗传性感音神经性耳聋的潜在方法之一,选择正确的基因载体及合适的载体导入途径是基因治疗的两个关键因素。利用病毒载体将外源基因导入哺乳动物内耳的研究已有广泛报道[2~4],腺相关病毒(adeno-associated virus,AAV)由于其免疫原性低、对人类无致病性以及稳定表达时间长等特点,已经成为研究基因治疗最常用的病毒载体。小鼠是研究遗传发育与疾病发生最常用的模型动物,多种基因修饰小鼠模型的建立为研究遗传性耳聋带来了极大便利[5];然而,由于小鼠耳蜗体积小、存在镫骨动脉等因素,给手术操作带来了一定的困难;因此,采用合适的方法将病毒载体导入内耳并表达是基因治疗遗传性耳聋的基础。本研究采用耳后入路经圆窗膜鼓阶显微注射的方法,将带有绿色荧光蛋白基因的重组腺相关病毒AAV2/9-GFP导入小鼠耳蜗鼓阶,观察其在内耳的表达,为遗传性耳聋的基因治疗提供实验基础。
1 材料与方法
1.1实验材料 携带绿色荧光蛋白(ZsGreen1)的重组腺相关病毒(AAV2/9-GFP,滴度1.6×1012vg/ml),购自上海汉恒生物科技有限公司。
1.2实验动物及分组 健康的5~6周龄野生型C57BL/6J小鼠24只,雌性,体重15~20 g(由空军军医大学动物实验中心提供)。随机分为三组:实验组12只,人工外淋巴液组6只,均以左耳为手术耳,分别注射AAV2/9-GFP和人工外淋巴液;空白对照组6只,正常饲养,不做任何处理。
1.3内耳显微注射方法 动物用4%水合氯醛10 ml/kg体重腹腔注射麻醉成功后,置于37 ℃电热板维持体温,眼部涂抹少量红霉素眼膏保持角膜湿润,左侧耳后备皮。动物取右侧卧位,术区以碘伏消毒,周围覆盖无菌纱布,在手术显微镜下,用眼科剪于耳后1~2 mm处剪开皮肤及皮下组织(图1a),暴露耳大神经及胸锁乳突肌(图1b和c),向上分离牵开胸锁乳突肌,可见位于其深面的颅外段面神经及二腹肌后腹(图1d);向后钝性分离二腹肌后腹,暴露听泡后壁(图1e),用显微镊挑除部分听泡后壁骨质,暴露圆窗龛及其下方的镫骨动脉(图1f);用拉制好的玻璃微管穿刺圆窗膜,可见外淋巴液流出(图1g),等待3~5分钟直至外淋巴液外流减缓,用微量上样针(Eppendorf Microloader)经圆窗膜向鼓阶内缓慢注射2 μl AAV2/9-GFP或人工外淋巴液(图1h);取一块筋膜组织迅速封闭圆窗龛,脂肪块封闭听泡骨壁缺损,复位耳后肌肉,用5-0可吸收缝线分层缝合切口,碘伏消毒切口皮肤。
1.4听性脑干反应(ABR)测试 三组动物术后均存活,术后第21 d进行ABR测试。测试仪器为TDT system3(Tucker-Davis Technologies,美国),小鼠麻醉后置于隔声室内,取俯卧位,记录电极置于颅顶正中,参考电极置于耳后,地线接尾部;选用短纯音(tone burst)为刺激声,上升/下降平台为10 ms,叠加1 024次,给声强度从90 dB以5 dB递减,依次测试4、8、16、32 kHz,以能重复引出可辨波Ⅰ的最小刺激强度为反应阈。
1.5耳蜗解剖及免疫荧光染色 术后21 d完成ABR测试后处死动物,迅速剪下头部,沿枕骨大孔剪开顶骨,去除脑组织,向两侧分开暴露颞骨内面,取出耳蜗置于4%多聚甲醛磷酸盐缓冲液中,在体式显微镜下摘除镫骨,开放前庭窗与蜗窗,并于蜗顶打孔,4 ℃固定过夜;10%EDTA溶液4 ℃脱钙7 d(每2~3 d换液一次);在体式显微镜下用Vannas弹簧剪将耳蜗分为底回、中回、顶回三部分,去除蜗壳、螺旋韧带及前庭膜,将耳蜗基底膜移入96孔板。
耳蜗基底膜用1%TritonX-100透化15 min,PBS漂洗3遍(每次5 min),5%驴血清封闭45 min。PBS漂洗3遍(每次5 min),加入1∶1 000稀释兔源Myosin VIIa一抗(Proteus Bioscience,美国)50 μl,4 ℃孵育48 h。PBS漂洗3遍(脱色摇床,30 min),加入1∶200稀释驴抗兔594 nm二抗(Thermo Fisher Scientific,美国)50 μl,4℃避光孵育过夜;PBS漂洗3遍(脱色摇床,30 min),加入50 μl DAPI室温30 min;PBS漂洗3遍(每次5min),80%甘油溶液封片,激光共聚焦显微镜(Nikon,日本)观察并拍照。以200 μm为计数单位对基底膜各段内毛细胞总数及GFP阳性内毛细胞个数进行计数,计算转染效率。
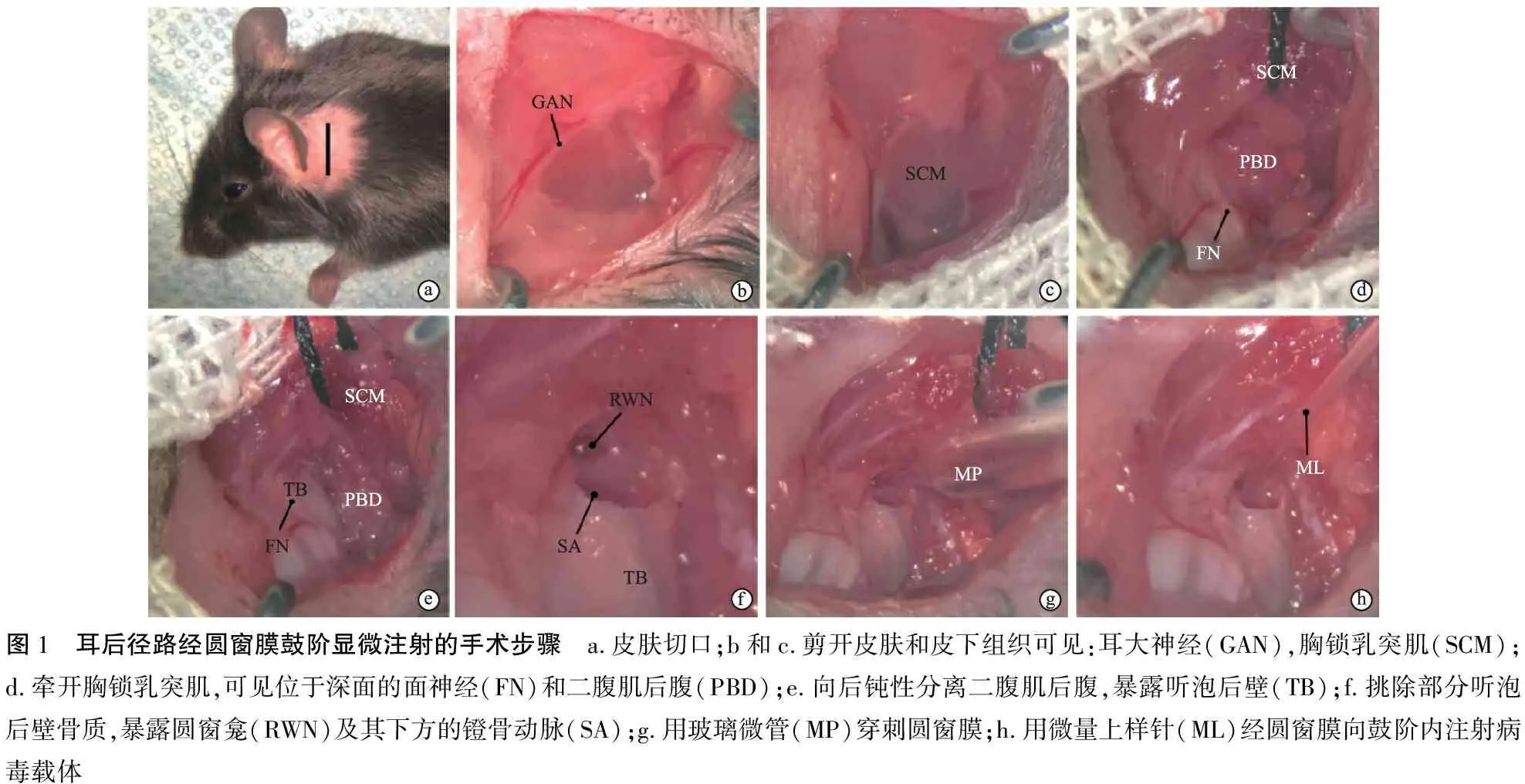
图1 耳后径路经圆窗膜鼓阶显微注射的手术步骤 a.皮肤切口;b和c.剪开皮肤和皮下组织可见:耳大神经(GAN),胸锁乳突肌(SCM);d.牵开胸锁乳突肌,可见位于深面的面神经(FN)和二腹肌后腹(PBD);e.向后钝性分离二腹肌后腹,暴露听泡后壁(TB);f.挑除部分听泡后壁骨质,暴露圆窗龛(RWN)及其下方的镫骨动脉(SA);g.用玻璃微管(MP)穿刺圆窗膜;h.用微量上样针(ML)经圆窗膜向鼓阶内注射病毒载体
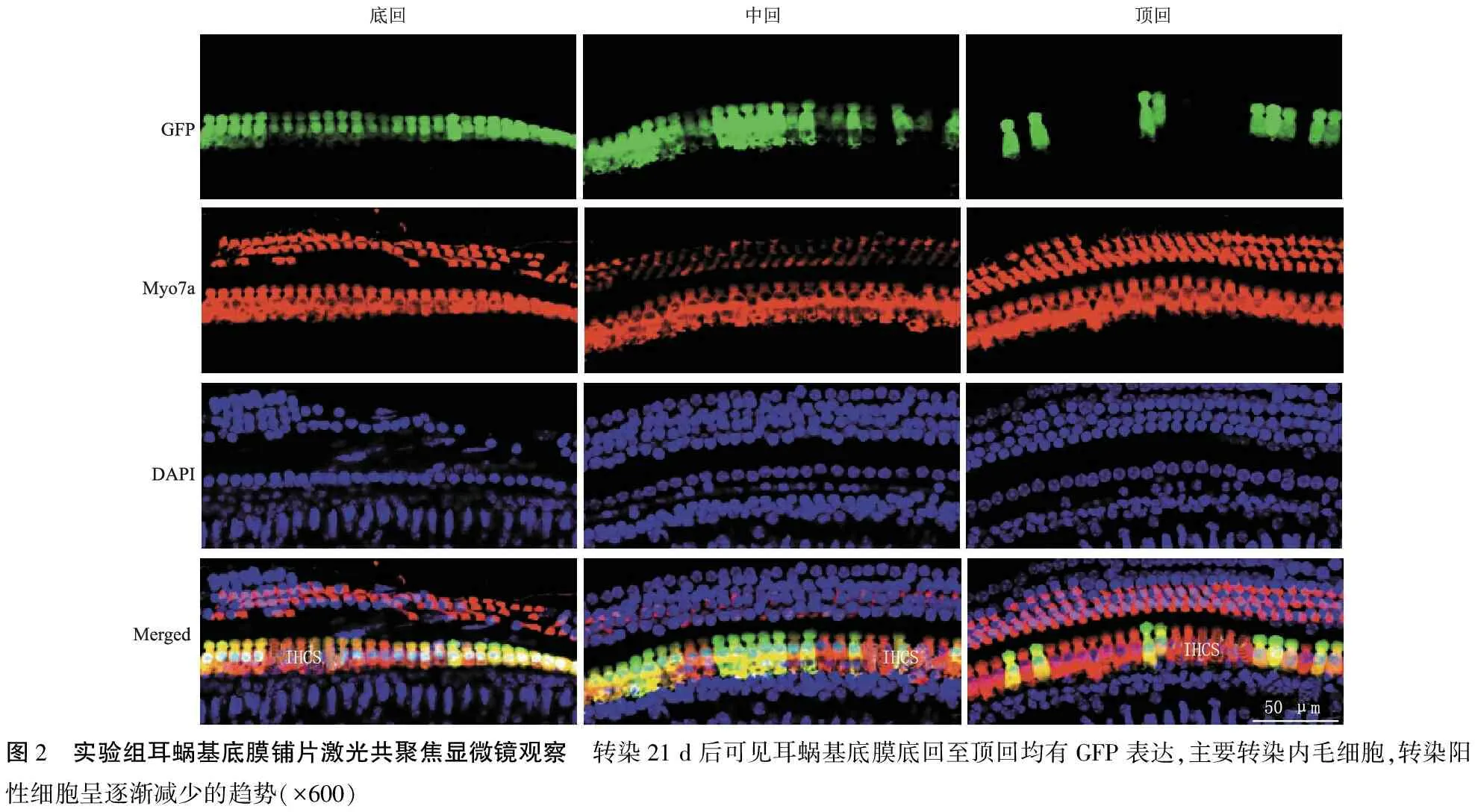
图2 实验组耳蜗基底膜铺片激光共聚焦显微镜观察 转染21 d后可见耳蜗基底膜底回至顶回均有GFP表达,主要转染内毛细胞,转染阳性细胞呈逐渐减少的趋势(×600)
1.6统计学方法 三组动物各频率ABR阈值差异比较采用SPSS23软件进行单因素方差分析(One-way ANOVA),两两比较采用LSD法,各段耳蜗基底膜内毛细胞转染效率差异比较采用3×2表χ2检验(Chi-square test),P<0.05为差异有统计学意义。
2 结果
术后动物均存活,未见步态不稳、头部倾斜等前庭功能障碍表现。
2.1各组ABR反应阈比较 实验组及人工外淋巴液组动物左耳ABR各频率阈值均不同程度升高,与空白对照组比较差异均有统计学意义(P<0.05);实验组与人工外淋巴液组动物左耳ABR各频率反应阈比较差异无统计学意义(P>0.05);各组动物右耳ABR各频率反应阈比较差异均无统计学意义(P>0.05)(表1)。
2.2耳蜗组织大体观察 各组动物取材时见中耳腔清洁、干燥,无炎症反应及脓、血性分泌物,听骨链完整。圆窗龛内填塞的筋膜已纤维化,部分动物圆窗龛内可见少许陈旧血性分泌物。

表1 各组动物术后21 d左、右耳tb-ABR各频率反应阈
2.3耳蜗基底膜激光共聚焦显微镜观察 镜下可见耳蜗基底膜上整齐排列的一排内毛细胞与三排外毛细胞。实验组动物左耳从基底膜底回至顶回均可见GFP表达,转染阳性细胞呈逐渐减少的趋势(图2);底回、中回及顶回的内毛细胞平均转染效率从高到低分别为82.7%、75.0%、44.7%,底回与顶回、中回与顶回转染效率比较差异均有统计学意义(P<0.05),底回与中回转染效率比较差异无统计学意义(P>0.05)。AAV2/9-GFP主要转染内毛细胞,转染阳性细胞形态正常,未见萎缩、脱落等细胞毒性表现;外毛细胞未见GFP表达。实验组动物对侧耳、人工外淋巴液组及空白对照组均未见GFP表达。
3 讨论
在基因治疗遗传性耳聋的研究中,腺病毒(adenovirus,Ad)和腺相关病毒(adeno-associated virus,AAV)是两种常用的病毒载体,但腺病毒转染后不整合至宿主细胞内,维持表达时间短,且腺病毒的免疫原性较高,这些都限制了其在基因治疗中的应用[6]。腺相关病毒能够有效转染内耳毛细胞、支持细胞并整合至宿主的基因组上,使外源基因在宿主细胞内长期稳定表达,改变细胞表型,纠正遗传缺陷[7,8]。腺相关病毒是复制缺陷病毒,免疫原性极低,对人类无致病性,动物实验证明其无耳毒性[3],是遗传性耳聋基因治疗的理想载体。不同血清型的腺相关病毒对动物内耳的转染能力有一定差异[9],有研究表明腺相关病毒转染内耳主要局限于内毛细胞,而外毛细胞几乎没有转染[10,11];本研究结果与之类似。Bence等[12]发现外泌体相关腺相关病毒(exosome-associated AAV)具有比传统腺相关病毒更高的转染效率,并能够转染外毛细胞,这可能成为遗传性耳聋基因治疗的一个发展方向。本研究采用AAV2/9-GFP作为载体,经圆窗膜鼓阶显微注射转染小鼠耳蜗,于术后21天观察,发现从耳蜗底回到顶回内毛细胞均可见GFP表达,且实验组与人工外淋巴液组术耳ABR反应阈无差异,说明其安全,无耳毒性。
小鼠是研究遗传性耳聋的理想模型动物,但由于其耳蜗体积小,术中观察、操作较为困难。此外,与人类不同的是,啮齿类动物的镫骨动脉在出生后不发生退化,其从颈内动脉分出后穿过二腹肌后腹进入听泡,紧邻圆窗龛的正下方走行,并穿过镫骨两弓之间,如术中不慎损伤会发生难以控制的大出血[13,14]。本研究操作过程中的体会是:在暴露听泡时,应将二腹肌后腹从听泡表面钝性向后分离,充分暴露听泡后壁,从面神经穿出听泡处(茎乳孔)的后上方挑开部分骨壁,即可直接暴露圆窗龛及其下方的镫骨动脉;穿刺圆窗膜之前,如果中耳腔有出血,应用明胶海绵拭净,防止血液沿圆窗进入内耳。穿刺圆窗膜后可见外淋巴液流出,等待数分钟至其外流停止再进行注射,可以防止外淋巴液将病毒载体冲出而导致注射失败。整个操作过程中应注意保护面神经,防止因损伤面神经造成动物术后无法闭眼、正常进食甚至死亡。
耳蜗经固定、脱钙后,基底膜脆性增加,在去除蜗壳和螺旋韧带的过程中极易发生基底膜损伤和断裂。此外,由于小鼠的蜗管围绕蜗轴盘旋2周,豚鼠蜗管盘旋可达4周[15],将整个基底膜直接铺片易发生褶皱、重叠,影响之后的染色观察。本研究采用“分段铺片”法,先将耳蜗分为底、中、顶回三部分,再沿外侧螺旋沟一并剪除螺旋韧带及蜗壳;此方法可操作性强,不易损伤基底膜,铺片时不发生折叠,并可对同一基底膜进行不同标记物的染色观察。
内耳基因导入的手术入路一般有耳后入路和腹侧入路[16]。常用的载体导入途径有经圆窗膜穿刺鼓阶导入、经耳蜗开窗鼓阶或中阶导入、完整圆窗膜渗透导入、经后半规管开窗导入等。经圆窗膜穿刺鼓阶导入途径解剖标志清晰、导入确切、可操作性强,但由于破坏了圆窗膜的完整性,术后可能遗留听力损失[17,18]。经耳蜗开窗导入途径保留了完整的圆窗膜,但在打孔时可能造成耳蜗基底回损伤,从而导致高频听力损失[19];该方法可导入鼓阶或中阶,小鼠耳蜗中阶内淋巴液体积约为0.19 μl,前庭阶和鼓阶外淋巴液体积约为0.6 μl,可根据所需病毒的体积选择导入部位[20]。完整圆窗膜渗透导入途径是将浸有病毒载体的明胶海绵填塞于圆窗龛内,病毒载体依靠渗透作用透过圆窗膜导入鼓阶外淋巴液,其转染效率较低。最近有研究发现利用胶原酶或透明质酸预先处理圆窗膜后进行完整圆窗膜渗透导入,转染效率接近经圆窗膜穿刺或经耳蜗开窗导入途径,且保留了内耳的完整性,无听力损失[21,22]。经后半规管开窗导入途径是在后半规管骨壁打孔,将病毒载体导入内耳,对前庭和耳蜗均有较高的转染效率;此方法无需打开听泡,保留了正常的中耳结构,能够更好地保存听力,缺点是无法确切辨认导入至内淋巴液或外淋巴液,且可能造成前庭功能损伤[23,24]。本研究采用经圆窗膜鼓阶显微注射导入载体,取得了良好的转染效率,但术耳的ABR反应阈较空白对照组升高。
本研究发现AAV2/9-GFP经圆窗膜鼓阶显微注射后在耳蜗底回、中回的转染效率高于顶回,可能与病毒载体的导入位点有关,经圆窗膜途径导入使靠近底回的外淋巴液中病毒滴度较高,而较难扩散至顶回。本研究中实验组和人工外淋巴液组动物术侧耳在术后均发生了听力损失,分析其可能的原因有:①液体注射过程对内耳造成的机械损伤;②圆窗封闭或圆窗发生骨化,限制了外淋巴液的波动;③听泡骨壁缺损处填塞的脂肪块影响听骨链的正常活动。因此,如何在导入外源基因的同时维持正常的中耳及内耳结构、避免发生听力损失是一个值得深入研究和探讨的问题。
本研究采用经圆窗膜鼓阶显微注射的方法将AAV2/9-GFP导入小鼠耳蜗,结果显示其能够在内耳毛细胞中表达,且转染阳性细胞形态结构正常,说明该方法可行,为研究腺相关病毒载体在遗传性耳聋基因治疗中的临床应用提供了实验基础。

