基于CRISPR/Cas9系统构建大鼠Kcnk2敲除载体的研究
艾慧婷,刘欣煜,雷维琼,陈恒玲
(1.中南民族大学 生物医学工程学院 医学信息分析及肿瘤诊疗湖北省重点实验室,湖北 武汉 430074;2.武汉市第四中学,湖北 武汉 430034)
1 引言
双孔钾离子通道(K2P)是近年来发现的一类新型的钾通道成员,共有17个成员组成。Kcnk2(potassium two pore domain channel subfamily K member 2,又称TREK1,Gene ID:170899)即编码双孔钾离子通道(K2P)中重要成员TREK1(TWIK related mechano-gated K+ channel)的基因,而TREK1是一种弱内向整流双孔钾通道(tandem-pore-domain weakly inward rectifying potassium channel,TWIK)相关的机械性门控双孔钾离子通道。
以往的研究表明,TREK1与抑郁症有着密切的关联,很可能成为抗抑郁治疗的靶点。有研究发现,SSRI类抗抑郁药物处理后的Kcnk2+/+小鼠相比于对照组Kcnk2+/+小鼠的静止时间明显缩短,而抑郁剂SSRI对Kcnk2-/-小鼠无效[1]。Kennard等[2]利用全细胞膜片钳技术发现,抗抑郁药氟西汀可以抑制TREK1电流的产生且洗脱后电流强度恢复,也进一步验证了TREK1很可能是SSRI类抗抑郁药物的作用靶点。此外,越来越多的研究表明K2P通道与伤害感受性疼痛有关。TREK1和TRPV1共定位在DRG神经元中,TREK1敲除可以抑制炎症诱导的机械痛和热痛的痛觉过敏[3]。TRESK敲除后可以增强DRG神经元的兴奋性[4]。事实上,TREK1更多的生理功能在越来越多的研究中被证实,所以对TREK1进行基因编辑,是一种重要的研究手段。
近年来,CRISPR/Cas9基因编辑技术(图1)以其低成本、易操作、打靶成功率高等优点备受研究者们的青睐[5]。本文使用的pL-CRISPR.EFS.GFP质粒(图2)是以CRISPR/Cas9系统为原理,通过对BsmBⅠ位点进行酶切,插入人工设计的gRNA序列,重组转化获得慢病毒。

图1 CRISPR/Cas9工作原理
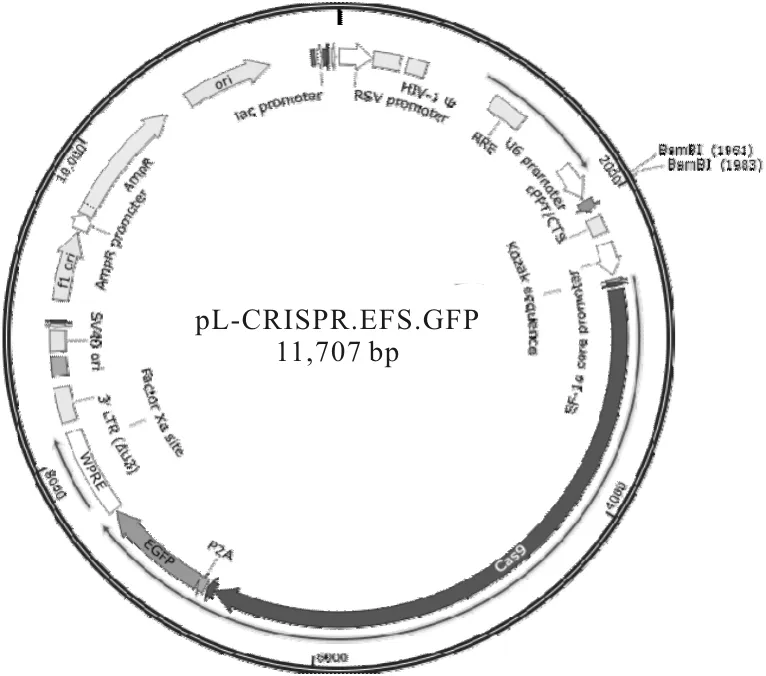
图2 pL-CRISPR.EFS.GFP质粒图谱
2 实验部分
2.1 实验材料
Kcnk2 oligo序列(武汉tsingke公司合成);质粒提取试剂盒(OMEGA D6950-01,美国);BSMBⅠ酶(Thermo,美国);Annealing buffer(淼灵,中国);T4 ligation(TAKARA,日本);DNA凝胶回收试剂盒(OMEGA D6950-01,美国);Stbl3感受态细胞(实验室制备)。
2.2 实验方法
实验通过导入编码guide RNA和Cas 9的质粒重新剪切整合,从而实现对目的基因的双链DNA的切割。通过退火来制备sgRNA双链,用BsmbⅠ酶进行质粒酶切,构建pL-CRISPR.EFS.GFP重组质粒、进行转化和菌落PCR检验并使用通用测序引物U6测序,然后抽提质粒,病毒包装获得慢病毒。
2.2.1 质粒提取
按照OMEGA质粒提取试剂盒说明书进行提取。
2.2.2 基因敲除靶点及寡核苷酸设计
使用CRISPR设计工具 (https://www.synthego.com/)得到guide RNA,由guide RNA序列设计互补的DNA oligo,本实验选取了Kcnk2互补引物序列见表1,oligo示意图及NGG位点如图3所示。

表1 Kcnk2基因互补的oligo序列

图3 oligo序列示意
2.2.3 酶切与回收
根据抽提的pL-CRISPR.EFS.GFP质粒浓度,按照表2的酶切反应体系,将所有试剂混合均匀,在37 ℃下反应2 h。将酶切完成的质粒混合产物,进行凝胶电泳,用DNA凝胶回收试剂盒进行酶切产物回收,测量浓度待用。

表2 酶切反应体系
2.2.4 退火
将公司合成好的Kcnk2引物(oligo1,oligo2),按照以下退火体系进行退火实验(表3)。将退火后产物用水以1∶200进行稀释后备用。

表3 退火反应体系
a设定温度梯度,每分钟降低2 ℃,使退火温度从95 ℃降至25 ℃
2.2.5 连接
将退火稀释后的oligo,与酶切回收后的pL-CRISPR.EFS.GFP,按照以下连接体系进行反应,4 ℃过夜连接或者16 ℃连接2 h(表4)。

表4 连接反应体系
2.2.6 Stbl3感受态细胞制备(Inoue 法)
本实验中采用Inoue法制备Stbl3感受态细胞。该方法中使用的Inoue buffer中各成分,可增加细胞膜的通透性,更容易吸收外源DNA,表5为使用的Inoue buffer配方。此外,该法采用16 ℃低温培养使得细菌转化效率大大提高。

表5 Inoue buffer缓冲溶液配方
2.2.7 转化
(1)在100 μL的Stbl3感受态细胞中加入3 μL连接好的产物,轻柔混合均匀后,于冰上静置30 min。
(2)准备42 ℃恒温水浴锅、37 ℃恒温摇床,预热37 ℃ 500 μL的LB液体培养基(不含氨苄抗生素)以及LB固体培养基。
(3)将冰上静置好的混合物放入42 ℃水浴锅内热击90 s,平稳迅速地拿出,立即放在冰上冷却3 min,然后于超净台中将预热的LB液体培养基滴加入混合液。
(4)将混合液放入37 ℃,200 r/min恒温摇床中培养60 min,此步是使细胞状态复苏,恢复抗性。
(5)将摇床复苏后的细胞混合液5000 g,离心5 min,弃去大部分上清,留下约100 μL的培养基重新悬浮细胞,然后用玻璃棒将细胞悬液均匀涂布在LB平板上,静置数分钟后,待液体完全被吸收,倒置平板,在37 ℃细菌培养箱中过夜培养。
2.2.8 重组克隆的鉴定与测序
采用Touchdown PCR方法进行菌落鉴定,挑选阳性克隆,委托武汉擎科公司进行测序。Touchdown PCR的两条引物为来自载体的引物Test primer F,该序列为5-CATTCGATTAGTGAACGGATC-3,和来自目的基因Kcnk2的oligo 2,按照表6加入各组分,并按照表7 Touchdown PCR反应条件进行PCR扩增:

表6 Touchdown PCR工作体系

表7 Touchdown PCR反应条件
b 2-4重复进行,共30个循环,每4个循环降低2 ℃,将温度从68 ℃降至52 ℃
3 结果与分析
3.1 质粒提取和质粒酶切的结果
pL-CRISPR.EFS.GFP提取浓度为320 ng/μL, A260∶A280为1.940,达到实验要求。按照表2酶切反应体系进行酶切电泳,如图4所示,回收所需片段大小为11676 bp。

图4 质粒pL-CRISPR.EFS.GFP酶切电泳结果
3.2 重组质粒的测序结果
将连接产物转化后扩增培养,进行Towndown PCR菌液鉴定,选取的阳性克隆送至公司测序,结果显示靶序列成功重组到空载体上。将测序结果导入Vector NTI进行比对图5中A图所示,方框内序列正是插入的目的序列,并分析碱基峰值图5中B图所示,峰值图无杂峰,结果显示成功将Kcnk2片段插入pL-CRISPR.EFS.GFP质粒的指定位置。

A)CRISPR-Kcnk2测序结果与酶切后pL-CRISPR.EFS.GFP质粒序列比对图;B)CRISPR-Kcnk2载体的碱基峰值图。红色方框内为所插入片段,与目的基因Kcnk2片段完全一致,CRISPR-Kcnk2敲除载体成功构建
图5CRISPR-Kcnk2敲除载体测序结果
4 结论与展望
本文应用CRISPR/Cas9基因编辑工具,成功构建Kcnk2基因敲除载体。相比于传统检测方式,采用Touchdown PCR方法进行阳性克隆筛选,将挑选的阳性克隆进行测序,缩短了检验时间,也降低了成本。Kcnk2基因编码TREK1钾通道,越来越多的研究表明TREK1与很多疾病密切相关,如抑郁症、癫痫、疼痛等神经系统疾病、心血管疾病和肺部疾病等,也一直作为各大疾病的潜在治疗靶点被科学工作者们不断深入的研究。Kcnk2基因敲除载体的成功构建,也为实验室后续探究Kcnk2在相关疾病中的作用奠定实验基础。
——一道江苏高考题的奥秘解读和拓展

