颈动脉多普勒超声指标对颈动脉内膜剥脱术和颈动脉支架置入术术后再狭窄程度的诊断价值
刘小明,包凌云,方建华,马晨霞
缺血性脑血管病变是脑卒中的常见类型,其中超过20%的患者与颈动脉系统狭窄有关。颈动脉内膜剥脱术(CEA)和颈动脉支架置入术(CAS)是常用的颈动脉狭窄治疗方式,对改善颈动脉血流动力学和预防脑卒中发生具有良好效果[1];但CEA和CAS术后远期再狭窄率较高(特别是CAS),定期复查,及时对再狭窄程度≥70%的无症状狭窄和再狭窄程度≥50%的症状性狭窄患者进行针对性治疗,能够有效降低缺血性脑卒中的发生风险,提高患者的生活质量[2]。数字减影血管造影(DSA)是诊断颈动脉狭窄程度的金标准,CT血管造影(CTA)对颈动脉狭窄的诊断效能也较好,但二者的经济性和辐射性限制了其在术后随访中的应用;颈动脉多普勒超声(CDU)具有无创、无辐射和经济性的优点,在颈动脉血管病变诊断中有广泛应用[3],然而目前尚没有用于评估CEA/CAS术后再狭窄程度较好的定量指标。为此,本研究探讨了不同CDU指标对CEA和CAS术后再狭窄程度的诊断价值。
1 资料与方法
1.1 纳入标准 (1)术前经DSA检查明确诊断为重度颈动脉狭窄并行CEA和CAS;(2)术后检查提示血管重建效果良好;(3)术后常规服用抗凝药物并定期复查。
1.2 排除标准 (1)CEA和CAS术中存在严重并发症如内膜撕裂、支架脱载和移位等;(2)术后治疗依从性差,未按时完成复查。
1.3 临床资料 选择2015年1月—2016年8月于浙江大学医学院附属杭州市第一人民医院成功完成CEA和CAS的患者,在患者术后第12个月进行复查。共纳入符合纳入标准的患者106例,手术血管共132支,其中CEA患者41例,平均年龄(67.6±5.5)岁,男28例、女13例,手术血管53支;CAS患者65例,平均年龄(70.3±5.2)岁,男38例、女27例,手术血管77支。
本文创新点与局限性:
本文创新点:(1)分析了颈动脉内膜剥脱术(CAS)和颈动脉支架置入术(CEA)患者术后1年的再狭窄情况,明确了CAS和CEA患者术后的颈动脉超声多普勒特点;(2)采用手术部位的颈动脉超声多普勒指标对再狭窄程度进行评估,可以作为原有形态学测量的重要补充。
本文局限性:本文为单中心、小样本的回顾性研究,相应最佳截点尚需大样本、多中心研究进一步明确。
1.4 检查方法
1.4.1 DSA检查 采用GE血管造影机,患者取平卧位,常规消毒、铺巾,以2%利多卡因进行局部麻醉。采用Seldinger技术进行股动脉穿刺,5 F导管鞘置入,导丝引导将造影导管置入,首先对主动脉弓进行造影,之后更换为5 F造影导管,将导管头端引导至左、右锁骨下动脉椎动脉开口部和左、右颈总动脉开口部,注入造影剂,记录双侧颈内动脉、颈总动脉及椎动脉造影图像。依照《脑血管造影术操作规范中国专家共识》[4]的相关标准计算再狭窄程度。再狭窄程度=(再狭窄远端正常直径-再狭窄处直径)/再狭窄远端正常直径×100%。
1.4.2 CDU检查 患者取仰卧位,充分暴露颈前部,颈后垫枕,头后仰,并偏向检查对侧,注意避免颈部过度伸展造成肌肉紧张而影响检查结果。仪器为Resona 7 超声诊断仪(深圳MindRay)及其配套10 MHz高频探头。(1)采用灰阶显像方式先以横切面再以纵切面,右侧自无名动脉分叉处、左侧从主动脉弓起始处开始,连续观察颈总动脉(近、中、远段)、颈内外动脉分叉处、颈内动脉(近、中、远段)、颈外动脉主干及分支处是否存在再狭窄。(2)采用多普勒超声检测手术部位的血流动力学参数,包括再狭窄段收缩期峰值流速(PSV)、舒张末期血流速度(EDV)及再狭窄段与颈总动脉的收缩期峰值流速比(PSV-ICA/CCA)[5]。
1.5 评价指标 以DSA诊断结果为金标准,分析不同再狭窄程度(<50%、50%~69%和≥70%)的CDU指标[6],并比较不同CDU指标对不同再狭窄程度的诊断效能(包括正确率、灵敏度、特异度、阳性预测值和阴性预测值)。
1.6 统计学方法 采用SPSS 22.0软件进行数据分析,计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验;计数资料以相对数表示,组间比较采用χ2检验。采用受试者工作特征曲线(ROC曲线)评价再狭窄段PSV、EDV、PSV-ICA/CCA诊断术后再狭窄程度的效能,并计算ROC曲线下面积(AUC)及其95%可信区间(95%CI)、标准误和P值,利用约登指数寻找最佳截点;AUC的比较采用Z检验。以P<0.05为差异有统计学意义。
2 结果
2.1 CAS术后再狭窄的典型CDU图像 图1为1例62岁CAS术后再狭窄患者的CDU图像,图1A为右侧颈总动脉及颈内动脉支架区域图像,可见支架回声以及颈内动脉支架术后再狭窄表现,再狭窄处存在明显的血流充盈缺损及五彩血流。图1B为右侧颈内动脉支架置入术后再狭窄处超声多普勒检测结果,可见血流流速明显增高,PSV 为266.29 cm/s,EDV为 99.86 cm/s。
2.2 不同再狭窄程度患者CDU指标 DSA共检出再狭窄程度≥50%的血管33支,其中再狭窄程度50%~69%的19支,再狭窄程度≥70%的14支。不同再狭窄程度患者PSV、EDV、PSV-ICA/CCA比较,差异有统计学意义(P<0.05);其中再狭窄程度50%~69%、再狭窄程度≥70%患者PSV、EDV、PSV-ICA/CCA高于再狭窄程度<50%患者,再狭窄程度≥70%患者PSV、EDV、PSV-ICA/CCA高于再狭窄程度50%~69%患者,差异有统计学意义(P<0.05,见表1)。
表1 不同再狭窄程度患者CDU指标比较(±s)Table 1 Comparison of CDU indices in patients with different degrees of restenosis
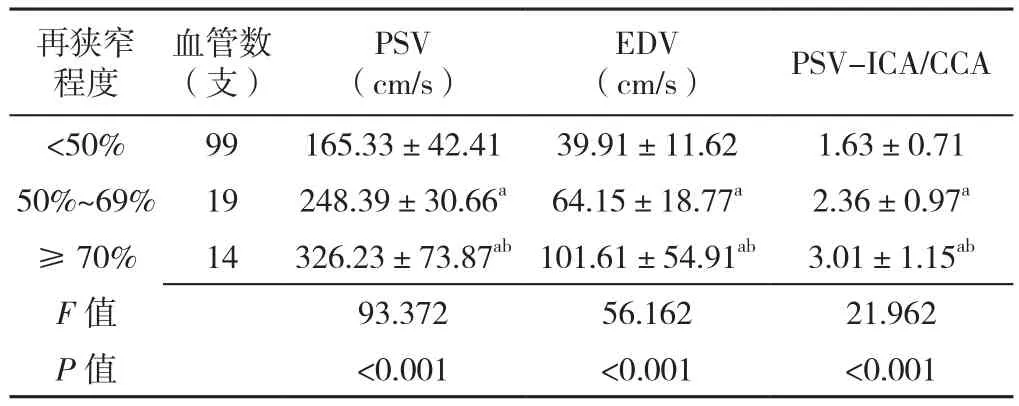
表1 不同再狭窄程度患者CDU指标比较(±s)Table 1 Comparison of CDU indices in patients with different degrees of restenosis
注:PSV=收缩期峰值流速,EDV=舒张末期血流速度,PSVICA/CCA=再狭窄段与颈总动脉的收缩期峰值流速比;与再狭窄程度<50%比较,aP<0.05;与再狭窄程度50%~69%比较,bP<0.05
再狭窄程度血管数(支)PSV(cm/s)EDV(cm/s) PSV-ICA/CCA<50% 99 165.33±42.41 39.91±11.62 1.63±0.71 50%~69% 19 248.39±30.66a 64.15±18.77a 2.36±0.97a≥ 70% 14 326.23±73.87ab101.61±54.91ab 3.01±1.15ab F值 93.372 56.162 21.962 P值 <0.001 <0.001 <0.001
2.3 CDU指标诊断CEA和CAS术后再狭窄程度≥50%的ROC曲线 PSV诊断再狭窄程度≥50%的AUC高于EDV和PSV-ICA/CCA(Z=2.088,P=0.037;Z=2.992,P=0.003),其中,PSV诊断再狭窄程度≥50%的最佳截点为209 cm/s(见图2、表2)。

表2 CDU指标诊断CEA和CAS术后再狭窄≥50%的AUCTable 2 AUC of CDU indices in the diagnosis of restenosis ≥ 50% after CEA and CAS
2.4 CDU指标诊断CEA和CAS术后再狭窄程度≥70%的ROC曲线 PSV诊断再狭窄程度≥70%的AUC高于EDV和PSV-ICA/CCA(Z=3.384,P=0.001;Z=2.166,P=0.030),其中PSV诊断再狭窄程度≥70%的最佳截点为285 cm/s(见图3、表3)。

图1 颈动脉支架置入术术后再狭窄的典型颈动脉多普勒超声图像Figure 1 A typical Doppler ultrasound image of restenosis after carotid stent stenting
2.5 CDU指标对CEA和CAS术后再狭窄程度的诊断效能应用ROC曲线所得出的最佳截点,PSV诊断再狭窄程度≥50%和≥70%时的正确率、灵敏度和阴性预测值均高于EDV和PSV-ICA/CCA,差异有统计学意义(P<0.05,见表4)。
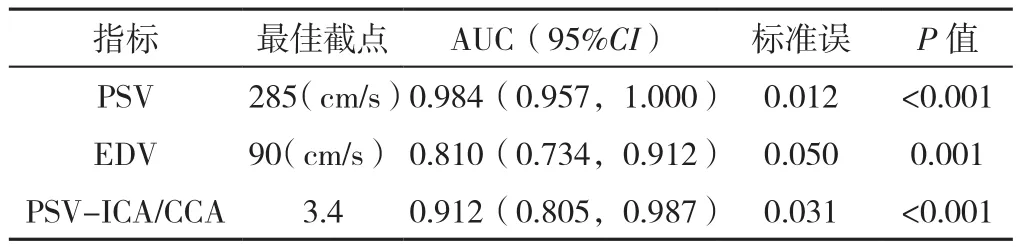
表3 CDU指标诊断CEA和CAS术后再狭窄≥70%的AUCTable 3 AUC of CDU indices in the diagnosis of restenosis ≥70% after CEA and CAS

表4 CDU指标对CEA和CAS术后再狭窄程度的诊断效能(%)Table 4 Diagnostic efficacy of CDU indices in evaluating the degree of restenosis after CEA and CAS
3 讨论
脑卒中(尤其是缺血性脑卒中)是导致我国人群(特别是老年人)因病致残和丧失基本生活能力的最重要因素,不仅具有极高的病死率、严重影响患者的生活质量,还造成沉重的家庭和社会负担[7]。颈动脉粥样硬化引起的颈动脉狭窄以及栓子脱落是引起缺血性脑卒中的重要因素,通过应用CEA或CAS等有效的脑卒中二级预防措施,颈动脉狭窄患者脑卒中发生率和再发率均得到了明显降低[8]。尽管CEA和CAS改善了患者的颈部血流动力学,但患者远期发生再狭窄的风险仍然存在,这更凸显了CEA和CAS术后复查的重要性[9]。本研究通过对CEA和CAS术后患者在术后第12个月进行复查,结果显示,CEA或CAS术后再狭窄率较高,其中再狭窄程度≥70%的发生率为25.0%(33/132),再狭窄程度≥50%的发生率为10.6%(14/132),这一结果与MAERTENS等[10]对213例患者的长期随访结论相似。
CDU被广泛用于颅外颈动脉疾病的初步评估和随访,颈动脉狭窄的严重程度主要基于颈动脉PSV、EDV和/或PSVICA/CCA的分析[11]。而由于CDU的狭窄程度分级主要基于原始(非手术)颈动脉,多项研究显示,这些狭窄评价标准并不适用于CEA和CAS术后的颈动脉再狭窄评估[12]。目前,对于CEA和CAS术后再狭窄进行干预的指标通常为再狭窄程度≥70%的无症状狭窄和再狭窄程度≥50%症状性狭窄患者[13],而本研究对经DSA诊断后的3种不同再狭窄程度患者的CDU指标进行分析,结果显示,与再狭窄程度<50%患者相比,再狭窄程度50%~69%和再狭窄程度≥70%患者的PSV、EDV和PSV-ICA/CCA均显著升高。这提示PSV、EDV和PSV-ICA/CCA能够较好地体现不同再狭窄程度患者的差异。
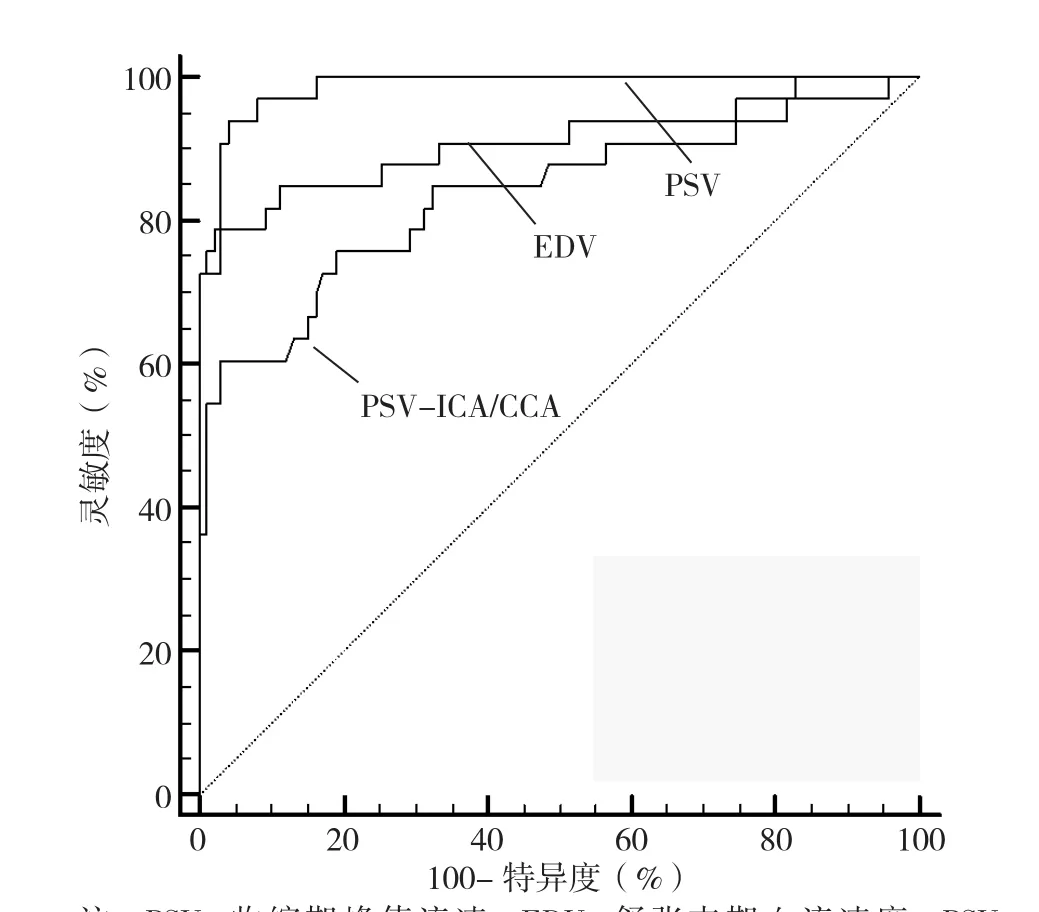
图2 CDU指标评价CEA和CAS术后再狭窄程度≥50%的ROC曲线Figure 2 ROC curve analysis of CDU indices in the diagnosis of restenosis≥50% after CEA and CAS

图3 CDU指标诊断CEA和CAS术后再狭窄程度≥70%的ROC曲线Figure 3 ROC curve analysis of CDU indices in the diagnosis of restenosis≥70% after CEA and CAS
ROC曲线分析显示,应用PSV、EDV和PSV-ICA/CCA诊断CEA和CAS术后再狭窄程度≥50%、≥70%时,PSV的AUC显著高于EDV和PSV-ICA/CCA。以DSA诊断结果为金标准,利用约登指数计算出的最佳截点(即PSV≥210 cm/s和285 cm/s)诊断CEA和CAS术后再狭窄程度≥50%和≥70%的正确率、灵敏度和阴性预测值均明显高于EDV和PSV-ICA/CCA。这与徐皙婷等[14]对中山医院53例患者的研究结果较为相似;ABURAHMA[15]对200例患者的研究显示PSV的诊断特异度和阴性预测值明显高于EDV和PSVICA/CCA;与本研究相比,该研究中PSV的阴性预测值较高,其直接原因与本研究中再狭窄程度≥70%的患者例数较少而再狭窄程度<50%的患者比例较多有关,而根本原因可能为随着CEA和CAS术后随访时间的延长患者再狭窄风险显著升高[16];分析PSV与EDV、PSV-ICA/CCA诊断再狭窄程度的特异度和阳性预测值与其他两项指标间无统计学差异的原因,可能是本研究纳入的患者例数较少所引起。
此外,有研究显示,CEA和CAS术后再狭窄的主要原因为血管内皮细胞损伤后的异常增生,手术操作、支架置入对内皮细胞的刺激以及对血小板和凝血系统的激活均在再狭窄的进程中有较大作用[17];而这一过程在术后前6个月发展较为迅速,在术后12~18个月后基本稳定[18]。因此,在CEA和CAS术后12~18个月应用CDU对患者进行再狭窄程度诊断具有较高的临床价值。
综上所述,CDU指标在诊断CEA和CAS术后再狭窄程度中具有较高价值,其中PSV≥210 cm/s和285 cm/s可作为再狭窄程度≥50%和≥70%的参考指标。

