花旗松素对H9C2细胞氧化应激保护作用机制研究
曾志辉,王晓莉,叶艳琼,王甜甜,苏其利,詹纪春,申婕,曾茂君,赵明一*
缺血性心脏病(IHD)是全球严重的健康问题之一,具有极高的发病率和致死率[1]。在心肌缺血条件下,冠状动脉供氧与心肌需氧之间的平衡被破坏,导致机体严重持续缺氧,最终血管代偿失衡并造成不可逆性心肌形态和功能的损害,其中氧化应激(OS)是主要病理改变之一[2]。OS是由于机体遭受严重刺激后使体内代谢失常而骤然产生大量活性氧(ROS)[3],其后氧化作用占据主导位置,通过中性粒细胞炎性浸润、蛋白酶分泌增加、产生大量氧化毒性中间产物[4]、活化自噬、Ca2+超载、激活内质网应激等机制[5]进一步加重心肌缺氧,从而造成恶性循环,最终导致心肌功能减退而发展为IHD。
花旗松素(Tax)是一种生物黄酮类物质,已有研究表明其因具有降血脂、降血压等效应,在心血管疾病防治中具有潜在应用价值[6]。但目前关于Tax对受到OS损伤的血管内皮细胞和心肌细胞的保护作用机制尚未明了。有研究表明,丝裂原活化蛋白激酶(MAPK)信号通路可通过调节核因子E2相关因子2(Nrf2)/血红素氧合酶1(HO-1)、B淋巴细胞瘤-2基因(Bcl-2)等分子活性发挥抗OS作用,另一方面高迁移率族蛋白1(HMGB1)也与OS、炎性反应、自噬等密切相关[7-8]。本文探讨Tax对过氧化氢(H2O2)诱导的H9C2细胞OS损伤的保护机制,为OS损伤性疾病的新药研发提供基础依据。
1 材料与方法
1.1 实验材料
1.1.1 细胞系 大鼠心肌细胞株H9C2细胞由长沙维尔生物科技有限公司提供。
1.1.2 实验仪器 蛋白质电泳仪(美国Bio-Rad公司),转膜仪(美国BD公司),高速离心机(德国艾本德股份公司),凝胶扫描成像系统(上海宝山顾村电光仪器厂),倒置显微镜、荧光倒置显微镜(日本Olympus公司),紫外分光光度计(上海江仪仪器有限公司),水平琼脂糖电泳槽(北京六一生物科技有限公司)。
1.1.3 主要实验试剂 DMEM培养基(美国Gibco公司),胎牛血清(美国ScienCell公司),Tax(上海远慕生物科技有限公司),Mito-Tracker Green(C1048,美国Molecular Probes公司),蛋白酶抑制剂(德国Merck公司),蛋白磷酸酶抑制剂(瑞士Roche公司),ROS荧光染色试剂盒(上海碧云天生物技术有限公司),RT-PCR试剂盒(北京康为世纪生物科技有限公司),RT-PCR引物(南京金斯瑞生物科技有限公司),p38抗体(14064-1-AP)、细胞外调节蛋白激酶(ERK)1/2抗体(16443-1-AP)、c-Jun氨基末端激酶(JNK)抗体(11023-1-AP)(美国proteintech公司),磷酸化p38(p-p38)抗体(9211S,美国CST公司),磷酸化ERK(p-ERK)1/2抗体、磷酸化JNK(p-JNK)抗体(SC-81502)(美国Santa Cruz公司)。
1.2 实验方法
1.2.1 研究时间 本研究时间为2017年3月—2018年3月。
1.2.2 细胞培养与分组 将H9C2细胞培养于含链霉素和氨苄西林双抗和10%胎牛血清的DMEM培养基中。当细胞培养密度达60%~80%时,在倒置显微镜下观察细胞形态并对细胞进行传代处理。将H9C2细胞随机分为对照组〔仅加入0.1%二甲基亚砜(DMSO)〕、H2O2处理组(加入200 μmol/ml H2O2处理12 h)、Tax+H2O2处理组(加入100 μmol/ml Tax预处理6 h,换液后加入200 μmol/ml H2O2处理12 h)、Tax处理组(加入100 μmol/ml Tax处理6 h)。
1.2.3 光学显微镜观察对照组、H2O2处理组、Tax+H2O2处理组细胞形态 将对照组、H2O2处理组、Tax+H2O2处理组的H9C2细胞接种于6孔板中,培养至完全贴壁状态后,分别进行药物处理,置于光学显微镜下观察细胞形态。
1.2.4 荧光倒置显微镜观察对照组、H2O2处理组、Tax+H2O2处理组ROS荧光染色情况 将待测的对照组、H2O2处理组、Tax+H2O2处理组H9C2细胞接种于6孔板中,培养至完全贴壁状态后,分别进行药物处理,加入ROS绿色荧光染色试剂Mito-Tracker Green,避光孵育15 min,荧光倒置显微镜下观察细胞染色情况并拍照。
1.2.5 RT-PCR法检测对照组、H2O2处理组、Tax+H2O2处理组诱导型一氧化氮合酶(iNOS)、骨桥蛋白(OPN)、HMGB1 mRNA表达水平 用Trizol法提取各组H9C2细胞的mRNA,按照RT-PCR试剂盒说明书操作,将其反转录成cDNA并作为模板,检测各组细胞中iNOS、OPN、HMGB1 mRNA表达水平,RT-PCR引物序列见表1。以β-actin引物序列作为内参校正样品Ct值,实验独立重复3次。
1.2.6 Western blotting法检测对照组、Tax处理组MAPK 信 号 通 路 p38、p-p38、ERK1/2、p-ERK1/2、JNK、p-JNK表达水平 按照Western blotting实验操作流程,收集对照组及Tax处理组待测细胞,加入RIPA裂解、定量后取20 μl上样进行凝胶电泳。电泳结束后转膜60~70 min,用清蛋白在室温下封闭30 min后加入一抗(p38抗体、JNK抗体、ERK1/2抗体)(1∶500稀释),4 ℃摇床孵育过夜,室温下加二抗(p-p38抗体、p-JNK抗体、p-ERK1/2抗体)(1∶2 000稀释),孵育2 h后加入ECL化学发光液,在凝胶成像系统中观察、拍照,采用Image J软件对电泳条带进行灰度分析,记录 p38、p-p38、ERK1/2、p-ERK1/2、JNK、p-JNK 表达水平。实验独立重复3次。
1.3 统计学方法 使用GraphPad Prism 5.0软件对数据进行分析。计量资料以(±s)表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 对照组、H2O2处理组、Tax+H2O2处理组细胞形态对照组细胞为正常梭形(见图1A),与对照组相比,H2O2处理组细胞出现肥大,呈圆形及不规则形状(见图1B),而Tax+H2O2处理组细胞形态接近梭形,细胞变圆及肥大程度较H2O2处理组轻,不规则形态细胞数量减少(见图1C)。
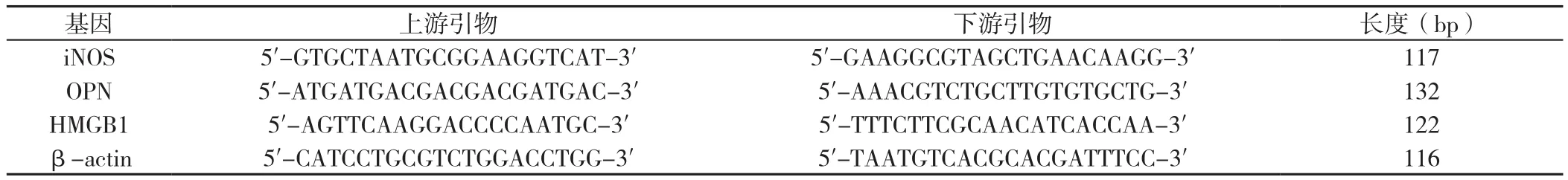
表1 RT-PCR引物序列Table 1 Primers sequences used for RT-PCR analysis

图1 对照组、H2O2处理组、Tax+H2O2处理组细胞形态(×200)Figure 1 H9C2 cell cellular morphology of the control group,H2O2 treatment group and Tax+H2O2 treatment group
2.2 对照组、H2O2处理组、Tax+H2O2处理组ROS荧光染色情况 对照组绿色荧光极少且亮度较弱(见图2A),H2O2处理组绿色荧光量较对照组明显增多且亮度增强(见图2B),而Tax+H2O2处理组较H2O2处理组绿色荧光量及亮度减弱(见图2C)。

图2 对照组、H2O2处理组、Tax+H2O2处理组ROS荧光染色情况(ROS荧光染色,×200)Figure 2 H9C2 cell ROS fluorescent staining pictures of the control group,H2O2 treatment group and Tax+H2O2 treatment group
2.3 对照组、H2O2处理组、Tax+H2O2处理组iNOS、OPN、HMGB1 mRNA表达水平比较 对照组、H2O2处理组、Tax+H2O2处理组iNOS、OPN、HMGB1 mRNA表达水平比较,差异有统计学意义(P<0.05);Tax+H2O2处理组iNOS mRNA表达水平低于H2O2处理组,差异有统计学意义(P<0.05);Tax+H2O2处理组OPN mRNA表达水平低于对照组、H2O2处理组,差异有统计学意义(P<0.05);Tax+H2O2处理组HMGB1 mRNA表达水平高于对照组、H2O2处理组,差异有统计学意义(P<0.05,见表2)。
表2 对照组、H2O2处理组、Tax+H2O2处理组iNOS、OPN、HMGB1 mRNA表达水平比较(±s,n=3)Table 2 The mRNA expression of iNOS,OPN,HMGB1 of the control group,H2O2 treatment group and Tax+H2O2 treatment group

表2 对照组、H2O2处理组、Tax+H2O2处理组iNOS、OPN、HMGB1 mRNA表达水平比较(±s,n=3)Table 2 The mRNA expression of iNOS,OPN,HMGB1 of the control group,H2O2 treatment group and Tax+H2O2 treatment group
注:H2O2=过氧化氢,Tax=花旗松素;与对照组比较,aP<0.05;与H2O2处理组比较,bP<0.05
组别 iNOS mRNA OPN mRNA HMGB1 mRNA对照组 1.182±0.694 1.054±0.398 1.028±0.287 H2O2处理组 2.098±0.281 1.439±0.198 1.259±0.219 Tax+H2O2处理组 0.690±0.038b 0.341±0.031ab 1.951±0.084ab F值 8.175 14.110 15.100 P值 0.019 0.005 0.005
2.4 对照组、Tax处理组MAPK信号通路p38、p-p38、ERK1/2、p-ERK1/2、JNK、p-JNK表 达 水 平 比 较Tax处理组MAPK信号通路p38表达水平低于对照组,p-p38、ERK1/2、p-ERK1/2、JNK、p-JNK表达水平高于对照组,差异有统计学意义(P<0.05,见图3、表3)。

图3 Western blotting法检测MAPK信号通路p38、p-p38、ERK1/2、p-ERK1/2、JNK、p-JNK表达水平的凝胶电泳图Figure 3 Gel electrophoresis picture of p38,p-p38,ERK1/2,p-ERK1/2,JNK,p-JNK of MAPK signaling pathway detected by Western blotting
表3 对照组、Tax处理组MAPK信号通路p38、p-p38、ERK1/2、p-ERK1/2、JNK、p-JNK表达水平比较(±s,n=3)Table 3 Comparison of expression of p38,p-p38,ERK1/2,p-ERK1/2,JNK,p-JNK of MAPK signaling pathway between control group and Tax treatment group
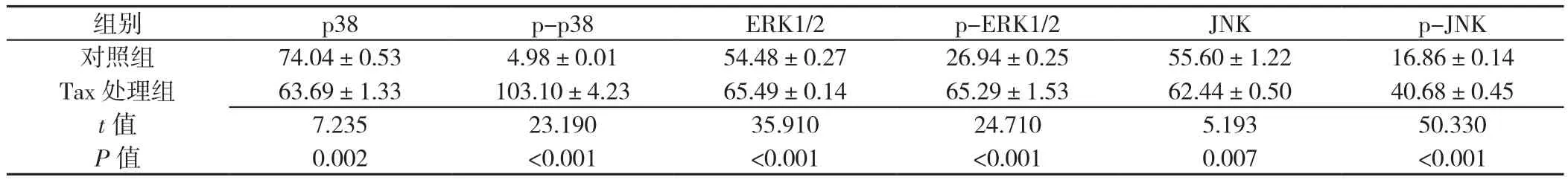
表3 对照组、Tax处理组MAPK信号通路p38、p-p38、ERK1/2、p-ERK1/2、JNK、p-JNK表达水平比较(±s,n=3)Table 3 Comparison of expression of p38,p-p38,ERK1/2,p-ERK1/2,JNK,p-JNK of MAPK signaling pathway between control group and Tax treatment group
注:p-p38=磷酸化p38,ERK=细胞外调节蛋白激酶,p-ERK=磷酸化ERK,JNK=c-Jun氨基末端激酶,p-JNK=磷酸化JNK
组别 p38 p-p38 ERK1/2 p-ERK1/2 JNK p-JNK对照组 74.04±0.53 4.98±0.01 54.48±0.27 26.94±0.25 55.60±1.22 16.86±0.14 Tax处理组 63.69±1.33 103.10±4.23 65.49±0.14 65.29±1.53 62.44±0.50 40.68±0.45 t值 7.235 23.190 35.910 24.710 5.193 50.330 P值 0.002 <0.001 <0.001 <0.001 0.007 <0.001
3 讨论
后基因组时代IHD仍然是备受全球关注的健康问题[9]。在生命氧化代谢活动过程中,机体不断产生各种氧自由基(OFR)。在生理状态下,体内抗氧化防御体系可以清除体内产生的少量OFR,而体内的OFR过度产生或清除减少,造成ROS生成与抗氧化防御之间的平衡紊乱,即OS。OS可导致脂质过氧化,损伤细胞结构,破坏细胞膜,可致核酸碱基修饰及核酸链断裂,染色体破坏,引起细胞功能障碍。心肌缺血缺氧时,线粒体单电子还原增多、中性粒细胞呼吸爆发等生理病理改变,造成OFR大量增多,ROS在心肌细胞中大量蓄积,促进OS,而OS可通过损伤细胞膜,促进细胞凋亡、Ca2+超载,产生炎性递质,损伤血管内皮细胞等机制造成心肌细胞损害,心功能受损,导致IHD的发生。Tax是一种黄酮类中草药,相关研究表明其在心肌细胞中可抑制OS所致线粒体凋亡,同时可抑制还原型辅酶Ⅱ(NADPH)氧化酶产生ROS,抗OS,发挥心肌保护作用,对H2O2诱导的细胞凋亡具有保护作用[10]。
为了探讨Tax对H2O2诱导的大鼠心肌细胞株H9C2细胞OS损伤是否具有保护作用,本实验将H9C2细胞分为对照组、H2O2处理组、Tax+H2O2处理组,通过观察各组细胞形态、ROS荧光染色情况及iNOS、OPN、HMGB1 mRNA表达水平,验证Tax对H2O2诱导的H9C2细胞OS的影响。结果显示,与对照组细胞相比,H2O2处理后细胞形态变圆,出现肥大,同时ROS染色绿色荧光较对照组明显增多且亮度增强,提示细胞内的ROS水平明显升高,表明H2O2处理H9C2细胞可以模拟OS表型;而Tax+H2O2处理组经Tax预处理后细胞形态接近梭形,细胞变圆及肥大程度较H2O2处理组轻,不规则形态细胞数量减少,细胞形态得到改善,绿色荧光量及强度介于对照组和H2O2处理组之间,提示ROS水平明显降低,Tax可以改善H2O2对细胞造成的形态学改变,并减少细胞内OS水平。Tax预处理能减轻、逆转H2O2所致的心肌细胞损伤,改善OS所导致的心肌细胞损伤。
iNOS是非钙依赖性酶,在正常状态无表达,缺血、缺氧等可激活诱导iNOS mRNA的表达,持续翻译合成iNOS,催化NO大量持续产生,iNOS催化生成的NO可发生快速氧反应生成OFR,加重心肌细胞的损伤[11]。OPN是一种主要由巨噬细胞分泌的磷酸化糖蛋白,隶属于近来被称之为“细胞蛋白”的一组秘密大分子[12]。心脏中,OPN是一种新近发现的黏蛋白,在出现炎症、损伤或应激反应时其分泌增加。OPN的异常表达参与了部分心血管疾病的病理进程,OPN表达水平升高可引起T淋巴细胞的增殖活化并介导其趋化迁移,造成严重的心肌损伤,导致心功能衰竭[13]。HMGB1是一种高度保守的蛋白质,可由坏死细胞和凋亡细胞被动释放,在细胞内外均可以发挥生物作用[14]。在细胞核内,HMGB1作为一种非组蛋白染色体结合蛋白参与包括转录、DNA修复、细胞分化和发育多种生物过程[15];在细胞质内,HMGB1能介导吞噬作用;在细胞外,HMGB1则作为损伤相关分子模式(DAMP)发挥作用,是最具特征性的DAMP分子[16],能与其他细胞因子、趋化因子及病原相关性分子模式相互作用,参与适应性免疫应答、组织重构、血管再生、促进平滑肌细胞迁移及增殖以及介导内皮细胞迁移活化[17-19]。本研究结果显示,Tax+H2O2处理组iNOS mRNA表达水平低于H2O2处理组,OPN mRNA表达水平低于对照组、H2O2处理组,HMGB1 mRNA表达水平高于对照组、H2O2处理组,表明Tax可以激活HMGB1表达,抑制OS相关基因iNOS、OPN的表达,提示Tax可通过激活HMGB1表达,抑制OS相关基因iNOS、OPN的表达,促进心肌细胞修复OS损伤。
MAPK信号通路是将信号从细胞表面传导到细胞核内的一种重要信号传导系统,包括ERK1/2、JNK/应激激活蛋白激酶(SAPK)、p38及ERK5/大丝裂原活化蛋白激酶1(BMK1)4条途径,这些途径通过不同的细胞外信号传导刺激上游激酶的磷酸化而被激活[20]。MAPK级联激活是多种信号通路的中心,在许多细胞增殖相关信号通路中具有关键作用。已有研究表明,MAPK信号通路的激活可诱导下游分子的表达,发挥抗OS、促自噬、促凋亡等作用[21]。为进一步探明Tax对抗OS的机制,本研究检测了对照组、Tax处理组MAPK信号通路相关蛋白及其磷酸化蛋白表达水平,结果显示,Tax处理组MAPK信号通路p38表达水平低于对照组,p-p38、ERK1/2、p-ERK1/2、JNK、p-JNK表达水平高于对照组,表明Tax可提高细胞内MAPK信号通路蛋白的磷酸化水平,提示Tax可能通过激活MAPK信号通路,激活HMGB1表达,抑制OS相关基因iNOS、OPN的表达,发挥抗OS作用。
综上所述,Tax可以改善H2O2对细胞造成的形态学改变并减少细胞内OS水平,其机制可能通过激活MAPK信号通路,激活HMGB1表达,抑制OS相关基因iNOS、OPN的表达来发挥抗OS作用。

