MiR-152过表达对对乙酰氨基酚诱导的急性肝损伤的保护机制
张豪洁 林琛琛
对乙酰氨基酚(APAP)诱导的肝损伤,通常是由于患者同时服用多种含APAP的药物引起,主要特征在于诱导肝衰的进程快(数小时至数天),并且存在剂量效应关系[1-2]。在动物模型中易于通过APAP诱导,因此APAP诱导的肝损已成为研究急性肝损伤和肝再生的常用模型[3]。
在APAP诱导的肝损伤的小鼠模型中,即使是亚毒性剂量的APAP也可引发肝脏miRNA和血清miRNA的显著变化,而衡量肝衰竭指标如ALT和AST保持不变[4-5]。影响细胞活性(包括增殖,分化和凋亡)的miRNA中,miR-152近年来引起了很大关注[6]。本研究观察了miR-152在急性肝损伤过程中的作用。
材料和方法
一、实验材料
8~10周龄雄性C57BL/6小鼠购于上海斯莱克动物实验中心。APAP购于美国Sigma公司;全自动生化分析仪(SIEMENSADVIA,美国);全自动脱水机(ASP300)、石蜡包埋机、脱蜡机等均为德国Leica公司产品。
二、APAP诱导肝损伤
小鼠禁食过夜,腹腔注射0.9%氯化钠溶液或APAP(300mg / kg)。 在miR-152干预实验中,将20只小鼠随机分成4组。在APAP注射前24 h,运用Entranster TM-体内转染试剂以1000 nmol/kg的剂量静脉内分别注射miR-152 激动剂、拮抗剂以及相应的阴性对照。 APAP给药后24 h处死小鼠,收集血清和肝组织,部分肝组织立即固定在4%甲醛中进行组织学分析,其余组织-80℃保存备用。
三、血清ALT和AST测量
戊巴比妥钠麻醉小鼠,眼球取血,1 500×g,4℃离心,取上清液,稀释后,应用全自动生化仪检测ALT和AST。
四、RNA分离和实时荧光定量PCR
使用TRIzol试剂(Invitrogen)从小鼠组织中提取总RNA。用TaqMan miRNA试剂盒(Life Technologies)测定miR-152的表达,以Sno202为内参。用PrimeScript RT试剂盒(Takara)合成cDNA。用SYBR Premix Ex Taq RT-PCR试剂盒(Takara)通过qPCR测定小鼠基因的表达,以GAPDH为内参。qPCR引物如下:IL-1β forward: 5′- TGTAATGAA-AGACGGCACACC;IL-1β reverse: 5′- TCTTCTTT-GGGTATTGCTTGG;TNF-α forward: 5′- TTCT-ATGGCCCAGACCCTCA;TNF-α reverse: 5′- TTT-GCTACGACGTGGGCTAC;IL-6 forward: 5′- GCT-ACCAAACTGGATATAATCAGGA;IL-6 reverse: 5′-CCAGGTAGCTATGGTACTCCAGAA;CCL2 forward:5′- GCTGCCGTCATTTTCTGC;CCL2 reverse: 5′- TCTCACTGGCCCGTCATC;GAPDH forward: 5′- CAGAACATCATCCCTGCATC;GAPDH reverse: 5′- CTGCTTCACCACCTTCTTGA。
五、统计学分析

结 果
一、APAP处理后miR-152高度诱导表达
APAP对肝实质造成了严重损害(图1)。与PBS对照组相比,APAP实验组ALT和AST明显升高,差异有统计学意义(表1)。与正常肝脏相比,APAP组肝脏miR-152水平明显升高(1.004±0.05 比 2.300±0.33,P<0.05)。与PBS对照组相比,APAP实验组血中miR-152水平升高了3倍(1.008±0.07 比 3.123±0.16,P<0.05)。
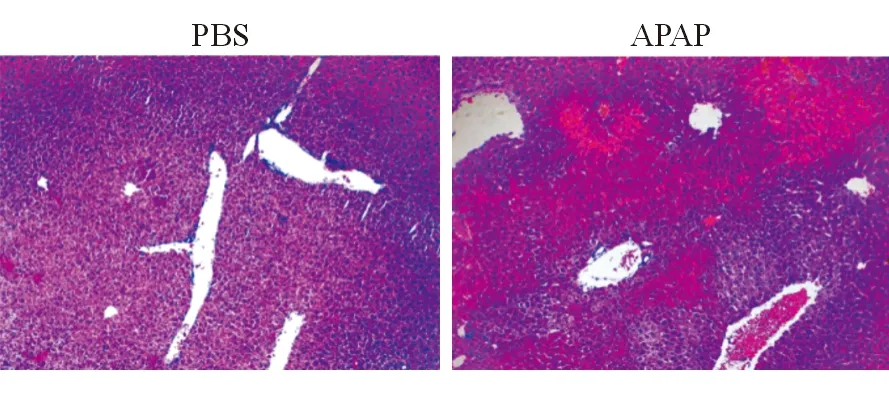
图1 APAP诱导的肝损伤后miR-152的表达水平
二、miR-152的体内过表达减轻了APAP诱导的肝损伤
通过miR-152特异性激动剂或拮抗剂控制体内miR-152的表达水平,来进一步阐明miR-152在APAP诱导的肝损伤中的作用。miR-152拮抗剂加重了APAP诱导的肝细胞坏死(图2);血清ALT和AST水平进一步证实了这个结果。而miR-152 激动剂处理后的小鼠肝细胞坏死程度减弱(图3),血清ALT和AST水平也降低。总之,以上数据证明miR-152体内过表达减轻了由APAP过量引起的急性肝损伤,而miR-152拮抗剂在损伤过程中具有不利影响。

表1 不同组别转氨酶变化
注:*P<0.05

图2 miR-152拮抗剂加重APAP诱导的肝损伤
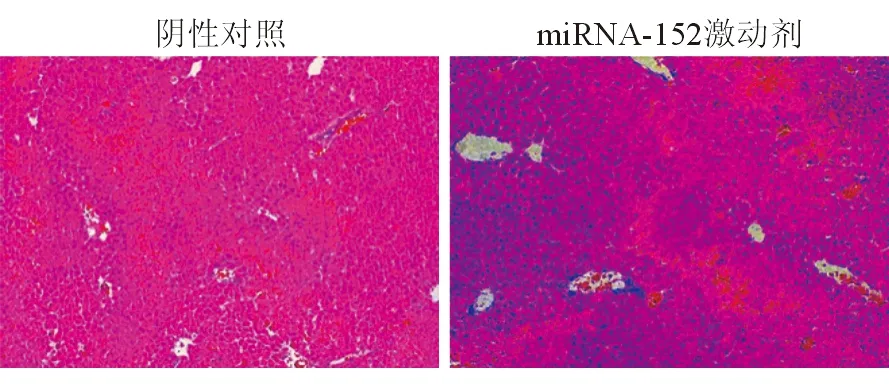
图3 miR-152 激动剂减轻APAP诱导的肝损伤
讨 论
研究表明,miRNA在肝损伤中具有双重作用。一些miRNA促进肝细胞增殖起到有益作用,但同时一些miRNA可加速肝细胞坏死[7-8]。本研究的目的是验证miR-152在APAP肝毒性中的调节作用及其潜在机制。
本研究结果显示,APAP处理后miR-152在肝脏和循环中的水平均显著升高,表明在APAP细胞毒性条件下诱导了miR-152合成。miR-152 拮抗剂加重了APAP诱导的肝细胞死亡,而miR-152激动剂可显著减轻肝损伤,通过组织学染色和血清ALT和AST水平验证了该结果。miR-152对APAP诱导的肝损伤的有益作用主要是通过抑制包括IL-1β、IL-6和TNF-α在内的关键促炎细胞因子表达。在本研究中,miR-152在APAP过量后可调控炎性细胞因子转录水平,提示miR-152在药物诱导的肝损伤后对调节病理生理过程起重要的作用。miR-152激动剂可缓解肝损伤,为临床上治疗APAP诱导的肝损伤开辟了新思路。
研究表明,特定miRNA通过调节免疫细胞和促炎细胞因子基因的转录水平来参与炎症[9]。在本研究中,使用mir-152拮抗剂沉默miR-152后上调关键的促炎细胞因子IL-1β、IL-6和TNF-α,加剧了APAP诱导的细胞毒性;此外,miR-152 激动剂过表达miR-152后通过靶向抑制这些促炎细胞因子。
血清中某些miRNA的水平通常比传统标志物如血清ALT和AST出现更早、更敏感和特异[10]。APAP治疗后检测循环miR-152升高可能提供提示肝损伤的新miRNA生物标志物。为验证miR-152对患者诊断的效用,应进一步研究APAP过量后miR-152随时间的变化关系。此外,需要进一步探索血清miR-152与当前肝损伤的标志物的相关性。
总之,miR-152在APAP过量应用中具有保护作用,为DILI发病机制的研究提供了新的见解。通过过表达miR-152调节APAP对细胞毒性作用是一种具有前景治疗策略。

