SRPX2对肝癌细胞侵袭与迁移能力的影响及作用机制
王云检 尤国华 张珉 张璐阳
肝癌术后复发转移率超过60%,成为肝癌患者死亡的主要原因[1]。侵袭与迁移是肝癌的基本特征,细胞侵袭与迁移取决于细胞黏附以及细胞外蛋白水解变性[2]。肝癌细胞可以在趋化因子刺激下发生运动,但其黏附性程度下降,容易从原发灶脱离并降解细胞外基质,形成向外转移的通道,促进肿瘤细胞的侵袭、迁移[3]。sushi重复蛋白X连锁2(sushi repeat containing protein x linked 2,SRPX2)是一种硫酸软骨素蛋白聚糖,与肿瘤的侵袭与迁移密切相关[4]。研究发现,当SRPX2的表达受到抑制,可以减缓肝癌细胞的侵袭与迁移[5]。因此,通过研究SRPX2对人肝癌细胞MHCC97H侵袭与迁移能力的影响及作用机制,为SRPX2成为肝癌治疗靶点提供一定依据。
资料和方法
一、主要试剂与仪器
人肝癌细胞MHCC97H(中国科学院典型培养物保藏中心昆明细胞库,中国)、SRPX2特异性siRNA和阴性对照(negative control,NC)(上海吉玛生物科技有限公司,中国)。DMEM 培养基、胰酶(Gibco公司,美国)、胎牛血清(武汉普诺赛生命科技有限公司,中国)。Trizol Reagent RNA提取试剂盒(Invitrogen公司,美国)、PrimeScript RT reagent Kit Perfect Real Time RNA反转录试剂盒(大连Takara公司,中国)、UltraSYBR One Step RNA PCR Kit荧光定量PCR试剂盒(宝生物工程大连有限公司,中国)。PCR引物序列(大连Takara公司,中国)为SRPX2引物序列:上游引物为5′-ACTGGATTTGCGGCATGTGA-3′,下游引物为:5′-CCATGTTGAAGTAGGAGCG-AGTGA-3′;MMP-2引物序列:上游引物为5′-AGACATACATCTTTGCTGGAGACA-3′,下游引物为:5′-CTTGAAGAAGTAGCTGTGACCG-3′;GAPDH引物序列:上游引物为5′-TCCCATCACC-ATCTTCCAG-3′,下游引物为:5′- GGTATCC-ATCGCCATGCTC -3′。细胞蛋白抽提试剂(碧云天生物技术研究所,中国)、鼠抗SRPX2、MMP-2(Santa Cruz公司,美国)、辣根过氧化物酶HRP标记亲和纯化山羊抗小鼠IgG二抗、鼠抗GADPH单克隆抗体(武汉艾美捷科技有限公司,中国)。凝胶成像仪(美国 UVP 公司)、ECL 显影液(美国 Millipore 公司) 。CO2细胞培养箱 (Thermo Revco,美国)、24孔Transwell小室(CORNING科技有限公司,美国)。NanoDrop2000c 型蛋白核酸检测仪(Thermo公司,美国)、实时荧光定量PCR仪(BIO-RAD公司,美国)、倒置显微镜(Nikon公司,日本)、基质胶、BIO-RAD 垂直电泳仪(BD公司,美国)、凝胶成像仪( UVP 公司,美国) 。
二、细胞培养及转染
用含10%胎牛血清的DMEM培养液培养人肝癌细胞MHCC97H,条件为37℃、5% CO2,隔天换液,当人肝癌细胞HepG2处于对数生长期时进行实验。实验分为空白对照组、阴性对照组和干扰SRPX2组。空白对照组在铺板后48 h收获细胞,阴性对照组和干扰SRPX2组分别用Lipofectamine法将NC和SRPX2特异性siRNA转染到人肝细胞癌MHCC97H,继续培养48 h收获细胞,进行相关检测。
三、细胞体外侵袭和迁移能力实验
按照细胞分组分别处理24 h后对细胞进行消化,用基质胶检测侵袭能力和不铺基质胶检测迁移能力。将消化获得细胞调整浓度为5×105后接种在24孔Transwell小室中,每孔200 μl,下室加入10%胎牛血清的DMEM培养液,继续培养24 h,取出小室,用无菌棉签擦拭去除上室内的细胞,用4%甲醛固定10 min,用0.1%结晶紫染液染色30 min,冲洗干净后倒置显微镜下观察细胞,拍照。计数紫色染色的穿膜细胞,即细胞侵袭和迁移能力。各剂量组设3个平行样。
四、实时荧光RT-PCR检测SRPX2和MMP-2 mRNA的表达
按照细胞分组分别处理48 h后对细胞进行消化,消化后取5 mL细胞液(细胞浓度为5×106/mL),5000 r/min、5 min离心,根据RNA提取试剂盒操作说明书进行总 RNA提取,测定mRNA浓度和纯度,将提取的总RNA根据反转录试剂盒说明合成cDNA,根据SYBR Premix Ex Taq TM Ⅱ荧光定量PCR试剂盒说明,用制备20 μl反应体系,在CFX-96 PCR扩增仪中进行扩增。反应条件为预变性95℃ 30 s、 变性 95℃ 5 s、60℃ 44 s、40个循环,61 ℃时采集荧光,用实时荧光定量 PCR仪检测对其表达量进行结果分析,以GADPH作为内参,采用 2-△△Ct法计算 SRPX2和MMP-2 mRNA 的相对表达量。各剂量组设3个平行样。
五、Western Blot法检测SRPX2和MMP-2蛋白水平
按照细胞分组分别处理48 h后对细胞进行消化,消化后加2 ml无血清培养基终止消化,5 000 r/min、5 min离心,洗涤2次,加入1 μl PMSF,根据细胞量加入胞蛋白抽提液,冰浴2 h;4℃、10 000 r/min、15 min,取上清,进行蛋白定量;调整蛋白浓度,加入1/5体积的5×缓冲液,沸水进行变性,-80℃保存备用。采用 BIO-RAD 湿转系统SDS-PAGE 胶进行电泳、切胶;孵育一抗、 4℃下孵育相应条带过夜、孵育相对于二抗,于暗室内用ECL 法发光观察蛋白表达,采集图像,用凝胶成像仪对免疫印迹条带灰度值进行分析,计算目的蛋白与内参蛋白条带的灰度值比值。各剂量组设3个平行样。
六、统计学分析

结 果
一、Transwell侵袭和迁移实验检测人肝癌细胞MHCC97H侵袭和迁移能力变化
由图1~2可见阴性对照组MHCC97H侵袭和迁移能力与空白对照组比较差异无统计学意义(P>0.05),干扰SRPX2组人肝癌细胞MHCC97H侵袭和迁移能力较阴性对照组降低,差异有统计学意义(P<0.05)。

图1 人肝癌细胞MHCC97H侵袭情况
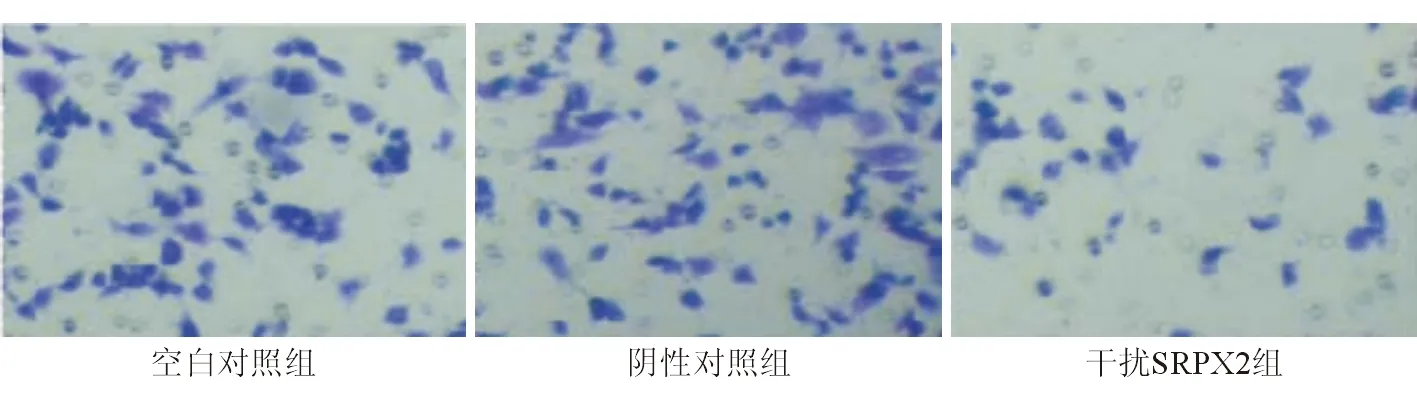
图2 人肝癌细胞MHCC97H迁移情况
二、人肝癌细胞MHCC97H内SRPX2和MMP-2 mRNA表达的影响
由表1可见阴性对照组人肝癌细胞MHCC97H SRPX2和MMP-2 mRNA相对表达量较空白对照组比较降低不显著,差异无统计学意义(P>0.05),干扰SRPX2组人肝癌细胞MHCC97H SRPX2和MMP-2 mRNA相对表达量较阴性对照组降低,差异有统计学意义(P<0.05)。

表1 人肝癌细胞MHCC97H内SRPX2和MMP-2 mRNA表达的影响(±s)
注:*表示与空白对照组相比差异有统计学意义,P<0.05;#与阴性对照组相比差异有统计学意义,P<0.05
三、人肝癌细胞MHCC97H内SRPX2和MMP-2蛋白表达的影响
由图3可见阴性对照组人肝癌细胞MHCC97H SRPX2和MMP-2蛋白表达量较空白对照组降低不显著,差异无统计学意义(P>0.05),干扰SRPX2组人肝癌细胞MHCC97H SRPX2和MMP-2 蛋白表达量较阴性对照组降低,差异有统计学意义(P<0.05)。

A:空白对照组、B:阴性对照组、C:干扰SRPX2组
讨 论
SRPX2最先在癌细胞中被发现,随着研究的深入,发现在正常组织中均有低表达[6]。在对结肠癌的研究中发现,SRPX2在癌症组织中高表达,且与患者的不良预后密切相关,提示SRPX2 蛋白在癌症组织中高表达[7]。SRPX2可以和组织蛋白酶B、半胱氨酸蛋白酶及金属蛋白酶等结合,影响细胞外基质(extracellular matrix,ECM)蛋白的水解,而 ECM 结构的改变是影响细胞侵袭迁移的重要因素之一[7]。RNA 干扰(RNAinterference,RNAi)是基因转录后沉默的重要机制之一,通过破坏靶基因的mRNA使其基因不表达,siRNA是RNAi的效应分子。本研究发现,通过将SRPX2特异性siRNA干扰片段转入人肝癌细胞MHCC97H后,SRPX2 mRNA和蛋白的表达量都降低,同时使MMP-2 mRNA和蛋白的表达量也降低。MMP2是MMP家族的重要一员,MMP家族成员几乎都能降解ECM中的各种蛋白成分,MMP-2基因5′旁侧序列促进子区域含有2个GC盒,活化的MMP-2定位于细胞穿透基质的突出部位,在酶解细胞间基质成分及基底膜的主要成分Ⅳ型胶原中有“钻头”的作用,是ECM代谢过程中最主要的蛋白水解酶类。在裸鼠肝癌模型的研究发现,MMP-2的表达量增加可以影响肝癌细胞的轻型迁移能力,增加了肝癌细胞向裸鼠肺部转移的机会;同时,门静脉受到侵犯是肝癌发生转移的重要环节,MMP-2可以破坏狄氏间隙的网状结构,为肝癌细胞的迁移创造了条件[8]。本研究发现,通过干扰SRPX2表达,进而使MMP-2的表达降低,人肝癌细胞MHCC97H侵袭和迁移能力降低。
综上所述,SRPX2与肝癌细胞的侵袭迁移密切相关,SRPX2的表达降低,MMP2的表达也随之降低,其侵袭迁移能力也明显下降,SRPX2可能通过调节MMP2而影响人肝癌细胞MHCC97H侵袭和迁移,为肝癌靶向治疗提供一定的理论依据。

