生物标志物在对乙酰氨基酚致肝损伤治疗中的应用
袁苏榆 丁洋
对乙酰氨基酚(PCM) 过量可引起急性肝功能衰竭(ALF),但大多数预后尚良好。在这些预后良好的病例中,重要的是区分哪些患者可安全出院和哪些患者需要积极治疗,以防ALF。目前尚无方法可预测PCM肝毒性的严重程度。英国最近一项PCM过量患者的大样本队列研究显示,在评估肝损伤严重程度方面,miR-122、免疫原性化合物高迁移率族蛋白1(HMGB1)或角蛋白-18(K18)异构体等生物标志物优于转氨酶水平[1]。
一、PCM过量的管理
PCM是全球治疗疼痛和发热的主要药物,常以非处方药的形式出售。英国每年约有100 000人次因PCM过量就诊。在美国和欧洲的ALF病例中,约有50%病例是由PCM过量引起。近数十年,谷胱甘肽的前体N-乙酰半胱氨酸(NAC)是PCM过量的主要治疗方法。对NAC无效者,肝移植是唯一的补救措施。当前,及时识别高危病例仍然很困难。由于肝功能的迅速恶化,相当多的PCM相关ALF患者在等待肝源时死亡,以致一些学者主张完全停止使用PCM。
PCM过量时,PCM被肝微粒体酶CYP2E1代谢,产生有毒中间体N-乙酰-对苯醌亚氨(NAPQI),谷胱甘肽与之结合,一旦NAPQI耗尽了储存的谷胱甘肽,几小时内可引起氧化应激和广泛的肝细胞坏死。因此,及早应用NAC补充谷胱甘肽储备可有效预防PCM肝毒性。Rumack-Matthews治疗流程图根据血浆PCM浓度和PCM摄入与入院间隔,决定是否开始NAC治疗。然而,该流程图并不能预测肝损伤的严重程度,也不能用于无意、分次过量用药或用药史不明确的患者以及酒精滥用者(因酒精可诱导CYP2E1活性)。目前的共识是当肝脏生化有异常时使用NAC治疗,直到转氨酶水平恢复正常。鉴于诸多不确定因素,需要更可靠的工具来识别高危病例并指导NAC治疗。
二、生物标志物和风险分层
Dear等[2]从多次、单剂量或不详的PCM过量并需要NAC治疗的患者的两组队列中收集数据进行风险分层。他们评估了PCM毒性相关的五种生物标志物指标,以预测肝损伤(ALT峰值> 100 U/L,主要终点)或凝血功能障碍(INR>1.5,次要终点)的发生。该队列主要是预后相对好的病例,因为仅在11%左右的受试者中出现主要终点且均生存而未肝移植。此外,仅2%~3%的患者出现ALT> 1 000 U/L或INR> 1.5,均未报道可能影响主要或次要终点患者的合并症或酒精摄入等用药史。
转氨酶正常的患者中,生物标志物miR-122、HMGB1、全长K18和裂解半胱天冬酶的K18都(分别)比PCM浓度更准确地预测肝损伤。在两个队列中,miR-122、全长K18或HMGB1的受试者工作特征曲线下面积(ROC-AUC)≥0.93,而血浆ALT或PCM的ROC-AUC为0.60。在预测ALT峰值> 1 000 U/L时,结果类似。联合miR122、HMGB1和两种K18异构体的模型可获得最大效益。在ALT和INR正常的患者中,这些生物标志物识别了50例进展为ALT > 100 U/L患者中的49例患者,并且识别825例未发生肝损伤患者中824例。入院时HMGB1能很好地预测凝血功能障碍的发生,其ROC-AUC为0.94,阳性和阴性预测值分别是92.0%和88.0%。在两个队列中,ALT和PCM的ROC-AUC均接近0.50,准确性较差。
如何应用这些生物标志物来改善PCM中毒患者的管理尚有争议。使用生物标志物确定患者是否需要NAC治疗可能受到检测周期和可及性的限制。这些检测的预测全为高精度,以便在可疑病例中安全使用NAC治疗。是否能够预测ALT峰值>100 U/L,可能有助于估计NAC治疗时间和住院时间。由于在队列中没有死亡或需要肝移植患者,这一进展似乎失去意义。运用生物标记物是否也能预测ALF,还有待进一步证实。ALF病例少也可能是该研究的缺陷,排除不能知情同意合作的患者可能使队列偏向于病情较轻的病例。
三、研究方向
从PCM过量到ALF的进程可分成两个阶段(见图1)。如上所述,氧化应激驱动是PCM致肝细胞毒性的最早阶段,NAC通过补充谷胱甘肽储备选择性地作用于该阶段。将PCM转化为NAPQI的酶由肝核受体控制,例如结构型雄甾烷受体(CAR)和孕烷X受体(PXR)。体外研究表明,阻断CAR/PXR活性可以使肝细胞复原,但风险是同时可阻断NAC合成谷胱甘肽。在NAC无效者中,线粒体氧化应激可导致细胞坏死。线粒体靶向抗氧化剂的应用有助于缓解肝毒性。
由于许多患者的PCM毒性出现较晚,因此针对肝细胞坏死下游的无菌免疫反应治疗方法可能更为重要。与ALT等损伤标记物不同,坏死时损伤相关分子(DAMPs)产物释放细胞外并通过激发免疫应答加重肝损伤。免疫细胞介导的肝损伤可触发DAMPs进一步释放(见图1),此时仅用NAC治疗不足以阻止肝损伤的进展,特别是在某些病例中DAMPs的释放甚至可能先于血浆转氨酶的升高,除HMGB1外,PCM过量后也会引起体内双链DNA和线粒体DNA等DAMPs浓度升高。因此,阻断白细胞DAMPs受体(如Toll样受体-9)在PCM毒性的临床前模型中显示出前景[3]。直接中和HMGB1的优点也已在动物研究中得到证实[4]。因此,除NAC外,PCM过量治疗似乎是未来研究的一个可实现的目标。
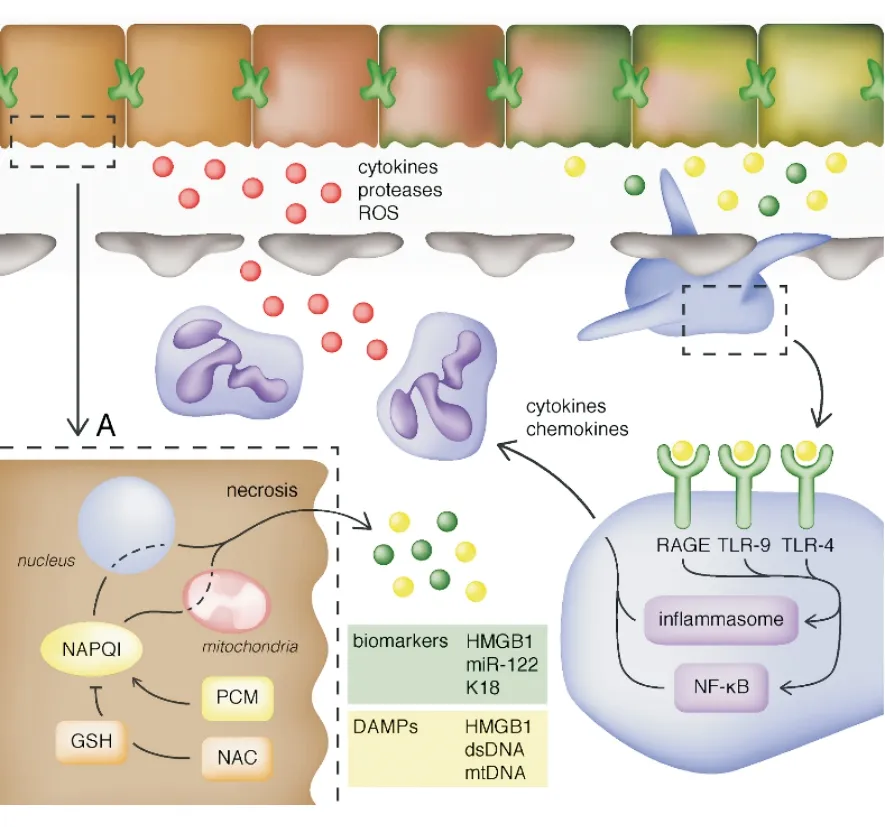
注:DAMP:损伤相关分子模式;dsDNA:双链DNA;GSH:谷胱甘肽;HMGB1:高迁移率族蛋白1;K18:角蛋白18;miR-122:微小核糖核酸 122;mtDNA:线粒体DNA;NAC :N-乙酰半胱氨酸;NF-kB:活化B细胞核因子k轻链增强子;PCM:对乙酰氨基酚(扑热息痛);RAGE:晚期糖基化终产物受体;ROS:活性氧;TLR:Toll类受体
图1 在PCM过量的早期(A),PCM被转化为有毒的自由基中间体NAPQI,耗尽储备的谷胱甘肽(GSH),导致肝细胞坏死。在第一个8 h左右,应用NAC可有效阻止肝损伤的进展。如果氧化应激持续存在,肝细胞坏死会导致细胞内化合物释放,其作为生物标志物(绿色标识)和(或)作为损伤相关的分子标志物(DAMPs,黄色标识)激活固有免疫系统。DAMPs紧接着激活白细胞(右下),通过释放细胞因子、蛋白酶和活性氧(红色标识)加重肝损伤。在PCM毒性第二阶段(>8 h),由于免疫介导,NAC治疗不足以阻止进一步的肝毒性。