双分支主动脉弓覆膜支架全弓置换治疗急性Standford A型主动脉夹层的临床疗效
俞 波,刘振华,翟蒙恩,段维勋,金振晓,任 凯,李步潆,俞世强
急性主动脉夹层(acute aortic dissection,AAD)是一种高危致死性的大血管疾病。症状出现后未接受治疗的AAD患者每小时的死亡率为1%~2%[1]。目前,尚无有效药物可以延缓或是控制AAD的发展。Standford A型AAD首选手术治疗已经成为一种共识。国际急性主动脉夹层注册研究(International Registry of Acute Aortic Dissection, IRAD)报道[2],A型AAD是临床上最常见类型,约占67%。86%A型AAD患者接受了外科手术治疗。但对于累及弓部分支血管的复杂A型AAD的手术方式的选择依然存在很大争议,临床医师也一直在努力寻求更好的手术策略。
目前临床上常用升主动脉和全弓置换及支架象鼻手术的方式治疗累及弓部分支血管的复杂A型AAD,这种手术方式可以彻底消除主动脉弓部夹层,同时使降主动脉近心端假腔闭塞或血栓化,显著减少二次手术和夹层破裂的风险。国内的“孙氏手术”(全主动脉弓替换+支架象鼻手术)术式已经成为主动脉弓部置换的经典术式,已被同行广泛接受和认同[3-5]。但手术时需要分别吻合弓部三个分支血管,尤其是在吻合左锁骨下动脉时,其位置深,显露、吻合和止血较为困难,也容易造成临近的喉返神经损伤。近年来兴起的治疗累及弓部的A型AAD的“三分支支架”联合象鼻支架技术取得了良好的临床效果[6-7],但部分患者无名动脉存在解剖异常,分支支架植入后,容易出现移位或是内漏。本科针对A型AAD主动脉弓部解剖和病变特点,采用可调型双分支覆膜支架(Xuper主动脉术中覆膜支架系统,先健公司,深圳),它由主体覆膜支架(放在降主动脉内)和双分支覆膜支架(左锁骨下动脉和左颈总动脉)组成,在手术中经升主动脉切口,采用导入的方法,将主体覆膜支架和双分支覆膜支架同时释放在降主动脉腔内和弓部所相应的分支血管腔内(左锁骨下动脉和左颈总动脉),无名动脉与近心端人工血管直接缝合,达到重建主动脉弓,消除弓部和降主动脉近端内腔破口的作用。此术式将原全弓置换和支架象鼻手术的四个血管吻合口减少成只需一个吻合口,显著缩短了手术操作时间和相应的体外循环时间,显著减少了出血量,也避免了术中喉返神经的损伤,同时避免了无名动脉异常解剖导致的分支支架移位或是内漏的发生,减少了术后并发症的发生,有利于患者术后尽快恢复。
1 资料与方法
1.1 一般资料 本研究共收集21例Standford A型AAD,其中,男性18例,女性3例,年龄28~62岁(48.6±8.5)岁。 21 例患者均有突发胸背痛的症状,其中,13例突发胸痛,6例突发背痛,2例合并胸背痛;既往高血压病史17例,2例糖尿病史,6例有心包积液,4例有中度至重度主动脉瓣反流;所有病例经 CT血管成像(CT angiography,CTA)检查确诊,且夹层均累及主动脉弓部;升主动脉直径:28~70(48.4±11.8)mm,主动脉弓部直径:26~43(32.2±4.7)mm,胸主动脉直径:29~42(35.5±3.2)mm,腹主动脉(肾动脉平面)直径:19~43(23.7±4.3)mm。
1.2 材料 本研究采用的Xuper主动脉术中覆膜支架系统由深圳先健科技有限公司设计,主要由可调式主动脉弓血管支架和可控释放的输送系统两大部分组成。血管支架由近端人工血管、镍铁合金裸支架和聚四氟乙烯(poly tetra fluoro ethylene,PTFE)覆膜组成(见图1)。近端涤纶人工血管缝合在血管支架近端,在可调式主动脉弓血管支架主体近端衔接传统涤纶人造主动脉弓血管,便于近端的手术操作。血管支架由1个主体和2个分支血管支架构成,主体支架对应人体主动脉弓部位的大动脉,分支支架分别对应主动脉弓上左颈总动脉以及左锁骨下动脉分支血管。支架结构具有良好的弯曲性和贴壁性,各个分支可自由摆动,以适应临床中主动脉弓解剖形态个体差异性的问题。同时可以保证主体大动脉和各个分支血管供血的通畅。可调式主动脉弓血管支架根据人体主动脉弓部位分支血管的直径可选用不同的规格尺寸。可调式主动脉弓血管支架上2个分支的直径、长度、间距和主动脉弓2个分支血管对应好,可保证2个分支血管供血的通畅。裸支架通过一体成型技术包被在PTFE覆膜中,即通过采用自行开发的“三明治”式覆膜技术,将金属骨架全部包覆PTFE膜中间,避免金属与血管的直接接触,可降低血栓形成风险,并促进血管内皮爬覆。支架为自膨式支架。同时,双分支主动脉弓覆膜支架主体远端采用锥度设计,以适应胸降主动脉渐细的解剖结构,减少支架主体对血管的过度扩张,避免远端再次出现夹层破口。

图1 双分支支架结构
1.3 手术方法 常规消毒铺单,所有患者均在全麻下,分别测量上下肢动脉血压,正中开胸,游离右无名动脉,全身肝素化,股动脉、腋动脉插管,切开心包,上下腔静脉插管,右上肺静脉插左心引流管,转机降温,鼻咽温28℃阻闭升主动脉,在主动脉弓病变血管近端的位置横行切开,左右冠脉开口直接灌注冷血停搏液,清除夹层血栓及内膜片,探查主动脉瓣、窦部及升主动脉(其中夹层累及右冠窦5例,近端Bentall手术13例,升主动脉置换8例)。鼻咽温降至 19.7~24.5(22.9±1.8)℃,膀胱温21.9~26.7(24.5±1.6)℃,头低位,头部置冰帽,阻闭股动脉及无名动脉近端。将无名动脉根部横行切开,用血管阻断钳将切开的无名动脉根部阻断,并将主动脉弓上的无名动脉开口位置用缝线缝合。选择经腋动脉行脑灌注,灌注流量 10 ml/(min·kg),开放升主动脉,探查主动脉弓降部及三支头臂血管(根窦部破口9例,升主动脉破口6例,同时伴有弓部内膜破口6例,夹层均累及弓降部及头臂血管,无名动脉内径增粗4例)。根据术前CTA测量及术中探查,测量主动脉弓真腔直径,选用合适的主动脉术中覆膜支架系统。将支架沿主动脉弓方向置入弓降部及降主动脉,并将分支置入对应左颈总动脉及左锁骨下动脉(见图2),支架近端与人工血管行端端吻合并固定,恢复股动脉灌注,左心排气,同时无名动脉与人工血管分支行端端吻合,心脏复跳。用自体升主动脉壁及心包包裹升主动脉人工血管并与右心房建立内引流。复温,辅助后停机,鱼精蛋白中和肝素,常规关胸,返回ICU,按心血管术后常规处理。出院时及6个月后复查CTA,观察支架有无内漏,移位,假腔闭合血栓形成情况。
2 结 果
21例Standford A型AAD患者均成功将双分支支架释放进入降主动脉腔内和主动脉弓部相应的分支血管腔内(左锁骨下动脉和左颈总动脉),支架释放及手术过程顺利。9例患者保留了主动脉根部,其中主动脉瓣修复术8例。13名患者进行了Bentall手术,其中11名患者采用了Valsalva移植手术。手术时间 271~394(335.2±45.4)min。 体外循环的时间为 160~281(210.2±32.4)min,主动脉阻断时间为 60~120(94.9±18.0)min,选择性脑灌注和深低温停循环时间为 18~46(27.0±10.4)min。 术后引流量为 130~1 045(372.6±251.0)ml。 术中输血量为460~1 280(568.2±182.3)ml。 术后机械通气支持时间为 15~28(18.3±7.3)h,重症监护室停留时间为1~5(2.2±1.2)d。 未见出血并发症,亦无患者需要二次手术止血。
术后CTA显示:21例Standford A型AAD患者行双分支支架全弓置换术后,所有双分支支架均充分打开和扩张。所有患者支架无内漏、移位及扭曲。支架腔内血流通畅,主动脉分支血管未见阻塞或狭窄。未见夹层腔扩大,主动脉直径较术前明显缩小,升主动脉直径:24~43(35.4±5.7)mm,主动脉弓部直径:26~36(29.5±4.1)mm,胸主动脉直径:29~40(34.5±3.7)mm,腹主动脉(肾动脉平面)直径:16~37(21.4±3.9)mm。 (见图 3)。
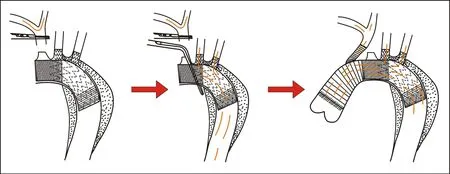
图2 双分支主动脉弓覆膜支架手术简要示意图
3 住院死亡率及随访
3.1 住院死亡率 1例患者在住院期间死亡(院内死亡率为4.8%),该患者术前被诊断为急性肾功能不全,术后出现血钾升高和严重的肾功能衰竭,透析治疗无效,死亡原因为手术后第10天出现多器官功能衰竭,呼吸心跳骤停。
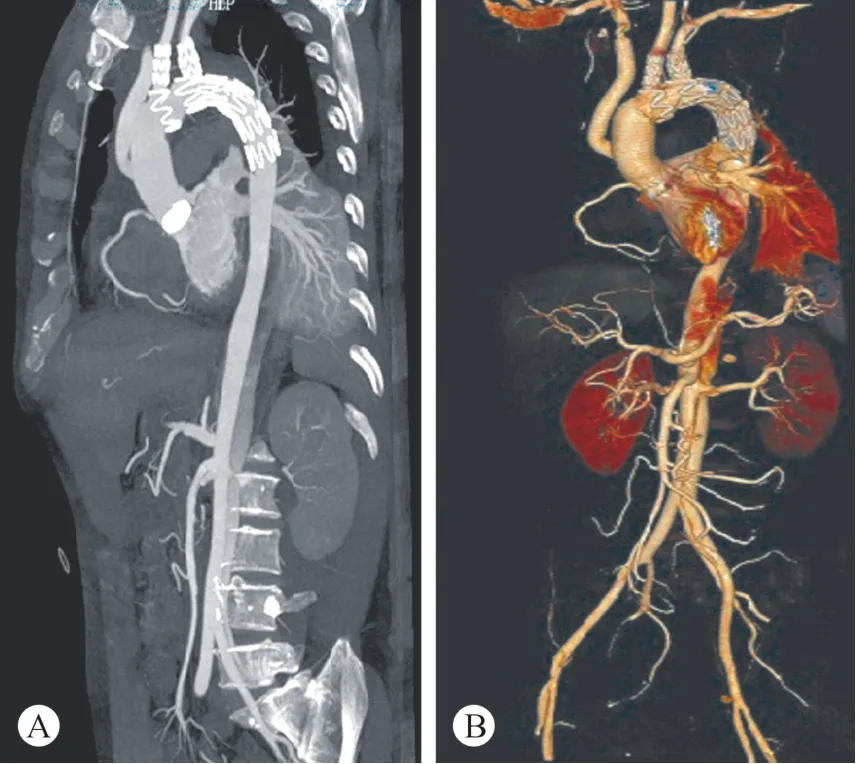
图3 术后CTA和CTA三维成像
3.2 随访 除1例患者在随访期间失访,排除术后死亡1例,其余19例患者随访至研究结束(2017年2 月)。 随访时间为 15~42(35.2 ± 2.1)个月。 所有随访患者均接受了CTA检查,随访CTA显示:19例A型AAD双分支支架全弓置换术后,所有双分支支架均充分打开和扩张。无支架移位,扭曲。支架腔内血流通畅,主动脉分支血管未见阻塞或狭窄。主动脉壁和双分支支架移植物之间未观察到内漏发生。所有主动脉弓部分支血管均观察到假腔消失和真腔恢复。分别在隆突,横膈膜和肠系膜上动脉水平等三处观察假腔血栓形成率。隆突水平:出院前有16名患者(84.2%)假腔血栓形成,随访期间有18名患者(94.7%)假腔血栓形成,与出院前该水平的血栓形成率相比显著增加;横膈膜水平,出院前有11例患者(57.9%)假腔血栓形成,随访期间有14例患者(73.6%)假腔完全血栓形成,与出院前该水平的血栓形成率相比显著增加;肠系膜上动脉水平,出院前6例(31.6%)假腔血栓形成,随访期间9例(47.4%)假腔完全血栓形成,与出院前该水平的血栓形成率相比显著增加。
随访期间,未发现支架移位、扭曲,内漏或支架诱发的内膜新破口(stent-induced new rupture,SINE)、休克、脑梗死、截瘫和逆撕形成新的夹层等严重并发症,无患者需要再次手术,无患者发生死亡,患者均恢复正常活动。
4 讨 论
近几十年来,A型AAD的外科手术治疗技术取得了飞速发展,但其外科手术死亡率仍然较高。根据国际上两个最大型的IRAD和德国急性A型主动脉夹层注册研究(German Registry for Acute Aortic Dissection Type A,GERAADA)报道称,A型AAD手术治疗的死亡率为 5%~26%[1,8-9]。 尤其是累及范围广泛的A型AAD的外科治疗是主动脉夹层手术的难点,已成为心血管外科研究领域的热点。
传统的象鼻技术是开放性全弓置换治疗A型AAD的经典术式[10]。冷冻象鼻技术在临床已经得到广泛推广和应用,并且取得了良好的临床治疗效果[11]。近年来,采用血管腔内修复联合开放式外科手术的“杂交手术”取得了良好的临床治疗效果[12]。Moulakakis等[13]回顾分析了杂交手术的安全性、有效性,并证实了杂交手术用于开放式修复A型AAD是安全有效的。最近,Chakos等[14]比较了杂交手术与传统象鼻手术修复A型AAD的效果,结果显示:与传统象鼻手术患者相比,杂交手术患者的生存率更高。但是,象鼻技术和杂交手术的术后相关并发症,如脑损伤、脊髓损伤、肾功能衰竭、心脏并发症和肺部感染的发生率依然较高。
2002年,国内孙立忠教授在象鼻技术的基础上设计了一种新型带四分支移植物,提出用这种带支架象鼻改良全弓置换技术治疗A型AAD,证实了此技术是治疗A型AAD的有效方法,并获得了良好的长期预后[3,15-16]。 目前,在中国“孙氏手术”术式已经成为治疗累及范围广泛的A型AAD的经典术式,并得到广泛的推广和应用。截至2013年底,已有8 000多例A型AAD患者接受了“孙氏手术”治疗[3]。但“孙氏手术”对术者要求较高,操作难度大,手术时间长,手术时需要分别吻合弓部三个分支血管,尤其是左锁骨下动脉位置深,显露、吻合和止血困难,也容易造成临近的喉返神经损伤。近年来,陈良万教授团队应用改良的三分支支架全弓置换技术治疗 A型 AAD,取得了令人满意的临床效果[17-19]。这种新颖的手术技术显著缩短了手术时间。然而,由于无名动脉的解剖变异,三分支支架全弓置换技术治疗A型AAD时,支架容易出现移位,且内漏的发生率相对较高。
本研究针对上述术式的缺陷及局限性,应用了双分支支架全弓置换技术治疗A型AAD。Xuper主动脉术中覆膜支架系统的输送系统是可调的,可以实现精确释放,支架移植物可以更好地粘附到主动脉弓和2个弓部分支血管,无名动脉切口的近端主动脉弓与人工血管吻合,并且支架移植物的远端部分覆盖有聚乙烯膜以防止血管受损。将支架移植物置于降主动脉,主动脉弓和2个弓部分支血管中,可以使手术时间和体外循环时间缩短,出血量减少,能避免损伤喉返神经,提高了手术的安全性和有效性。近端主动脉弓和无名动脉与人工血管吻合,以减少内漏的发生。此外,支架设计为可随着彼此靠近的分支自由摆动,以提供与2个相邻弓部分支血管之间适配距离以及原始弓部分支血管的不同直径的良好匹配。主支架移植物是锥形的,以适应胸段降主动脉的解剖结构。分支支架的远端是锥形的,以减少远离分支血管的分支的过度膨胀。锥形设计可以避免SINE的发生。双分支支架全弓置换技术用于临床A型AAD治疗的院内死亡率为4.8%,出院前未发生与双分支支架相关的并发症(如内漏、SINE、脏器灌注不良、休克、脑梗、残余夹层、截瘫等)。随访CTA显示:所有双分支支架均充分打开和扩张。无支架移位,扭曲。支架腔内血流通畅,主动脉分支血管未见阻塞或狭窄。主动脉壁和双分支支架移植物之间未观察到内漏发生。所有主动脉弓部分支血管均观察到假腔消失和真腔恢复。在隆突或气管分叉,膈肌和肠系膜上动脉水平的假腔血栓形成率高于出院前。
本研究的初步结果表明:双分支支架全弓置换技术治疗A型AAD是安全有效的。但本研究存在很大的局限性。一是在单个中心进行,样本量偏小,不具有代表性,真正的临床效果仍需要大样本量的支持。 二是随访平均时间仅为(38.2±12.5)个月,需要进一步的长期随访来证实该技术的临床效果。

