羊急性心梗模型人工泵肺救治疗效评价
刘 洋,程 亮,杨 剑,陈 涛,董小超,魏旭峰,俞世强,金振晓
急性心肌梗死中心源性休克的发生率在5%~8%,临床救治成功率低、死亡率高,且预后较差,远期易发生心功能衰竭[1]。尽管近年来急性心肌梗死的诊治手段已取得明显进步,其近期预后有了明显改善,但心源性休克仍是急性心肌梗死患者院内死亡的主要原因。因此,研究急性心梗后心源性休克的救治新措施极为重要。
由于急性心梗后发生心源性休克时,再血管化后血管活性药物的应用效果并不令人满意,近年来,主动脉内球囊反搏、体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)、TandemHeart及 Impella等多种循环辅助装置被应用于急性心梗心源性休克的早期救治[2-3]。其中ECMO被越来越多的应用于危重患者的早期救治,由于其独有的兼具循环和呼吸支持功能,在心源性休克早期救治中,能够明显改善远端组织灌注,提高救治成功率并改善预后。其可能机制是机械辅助减低了心脏负荷及心肌耗氧量,缩短了顿抑心肌的恢复时间,保证了充足的氧供以维持组织灌注。因此,对急性心梗患者尽早应用心肺辅助有望改善预后。本研究拟应用课题组自主研发的便携式人工泵肺辅助装置,治疗羊急性心梗模型,模拟现场早期心肺辅助救治方式,评价人工泵肺救治急性心肌梗死后心源性休克的救治效果。
1 材料和方法
1.1 材料、试剂和仪器 便携式人工泵肺辅助装置。 实验用健康羊10 只,平均(65±5.7)kg;氧气、氮气、二氧化碳(第四军医大学试剂中心);脑钠肽前体(NT-proBNP)检测试剂盒(Sigma公司,St Louis,MO);肌酸激酶同工酶(creatine kinase isoenzyme,CKMB)、心肌肌钙蛋白 I(cardiac troponin,cTnI)血检测试剂盒(Sigma 公司,St Louis,MO);变温器、流量监控器、滚压泵(Sarns 8000型);血气分析仪(Abbott i-STAT 300);离心机(湘仪 L535R);紫外分光光度计(DG5031型,华东电子集团医疗装备有限责任公司)。压力传感器、测压套件、多通道监护仪;麻醉机(Druga100 US);超声心动图机(Philip IE33)。
1.2 装置设计 本研究设计的便携式肝素涂层泵肺辅助装置是以自制便携式中空纤维氧合器与滚压泵(Sarns 8000型,美国)为基础的整合动力氧合装置。该装置通过将高氧合效率的中空纤维氧合器与小型血泵装置整合,以期实现在较小的体积和血液接触面积的基础上,通过单一装置实现氧合和泵血的双重功能,以实现适应复杂环境应用的便携性能。其中血泵采用一体化泵头装置,泵头设计按照医用血液接触要求置于装置的底部,装置开启后通过泵室内转子的旋转实现连续单向泵血功能。氧合装置采用中空纤维氧合集束设计,装置开启后通过血泵装置将非氧合血驱动,单向流过单个中空纤维管外侧,与管腔中的氧气进行气体交换,实现氧合。
1.3 动物模型建立 实验用羊术前24 h禁食,12 h禁水。20~30 mg/kg氯胺酮诱导后气管插管,右侧卧位,左侧颈静脉中心静脉置管,左侧股动脉动脉置管。消毒铺单后,取左侧第五肋间进胸,肺动脉至心尖部纵行切开心包,悬吊心包。前降支近段5-0 Proline线结扎,观察血流动力学变化。实验组(MIVA,n=5)即刻分别于降主动脉和右心耳4-0 Proline线双荷包缝合,并分别于荷包中心置入21 Fr动脉插管、28 Fr静脉插管。便携式人工泵肺辅助装置以0.9%氯化钠盐水预充排气,管钳远端夹闭备用。再次排气后,将降主动脉插管与装置流出道连接,右心房静脉插管与装置流入道连接,血流量4.0 L/min运转12 h,12 h后处死实验动物。对照组(MI,n=5)仅行前降支近段结扎。
1.4 血流动力学监测及超声监测 术中持续监测血流动力学指标,包括血压、心率、静脉压、肺动脉压、肺毛细血管楔压。于术前及心梗后、转流中行经心表超声监测左室射血分数(left ventricular ejection fraction,LVEF)值。
1.5 CKMB及cTnI检测 于转流前和转流后每2 h采静脉血2 ml,4℃,15 000 g离心10 min,分离血清再次4℃,15 000 g离心10 min,备用。CKMB及cT-nI检测:按试剂盒说明进行检测。
1.6 气体交换效率试验 动物模型建立后,4.0 L/min运转,95%氧气4.0 L/min。于转流前和转流后每2 h分别于装置流入道和流出道采血1 ml,进行血气分析,记录各采样点流入道/流出道血红蛋白(hemoglobin,Hgb)、氧分压(PO2)、二氧化碳分压(PCO2)、氧饱和度(SO2)等。 根据以下气体交换指数计算公式,计算气体交换指数,并进行统计分析。

(注:TO2,气体交换指数;Hgb,血红蛋白量;SoO2, 流出道氧饱和度;SiO2,流入道氧饱和度;PoO2,流出道氧分压;PiO2,流入道氧分压。)
2 结 果
2.1 手术及围术期情况 两组动物模型建立成功率100%,前降支近段结扎后,心电图均有明显变化,结扎后给予静脉泵入盐酸肾上腺素0.03 μg/(kg·min)。实验组均在10 min内建立体外循环连接并开始转流(图 1),初始流量(4.1±0.6)L/min,转流12 h中无室性心律失常事件。对照组实验过程中,5只动物均出现低血压及室性心律失常等表现,增加盐酸肾上腺素用量至 0.08 ~ 0.2 μg/(kg·min),间断给予盐酸利多卡因75 mg静脉注射,维持血压心律;其中2只动物发生不可逆性室颤,经50 J心表面除颤、心脏按摩、反复0.1 mg盐酸肾上腺素静脉注射,心律未恢复,分别于术后1 h,2 h抢救无效死亡。
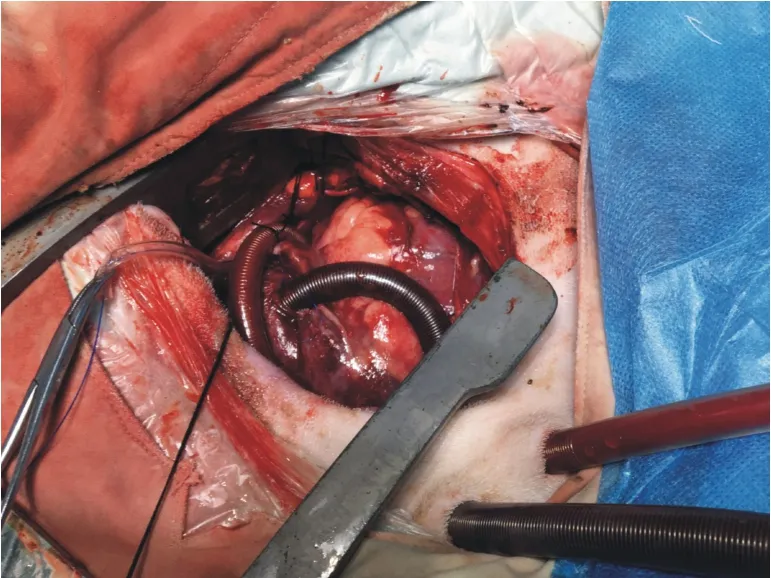
图1 急性心梗动物模型建立及人工泵肺辅助
2.2 CKMB及cTnI检测结果 两组动物CKMB及cTnI术后4 h均明显升高,后两组均持续升高,但MI-VA 组复灌 12 h CKMB(35.24±8.61)μg/L vs.(92.56 ±13.5)μg/L(P= 0.007);cTnI(4.53±1.28)μg/L vs.(17.34 ±4.39)μg/L(P= 0.003);均明显低于MI组。见图2和图3。

图2 两组动物术中CKMB监测

图3 两组动物术中cTnI监测
2.3 超声心动图监测 术中经心表超声监测,两组LVEF在结扎后均有明显下降,后MI-VA组逐渐回升稳定,MI未见明显回升(图4)。

图4 两组动物术中LVEF动态监测
2.4 装置氧合性能 MI-VA人工泵肺辅助装置12 h转流中,装置流出道氧饱和度均保持98%以上,氧合效率稳定,且游离血红蛋白稳定在较低水平(图5,图 6)。
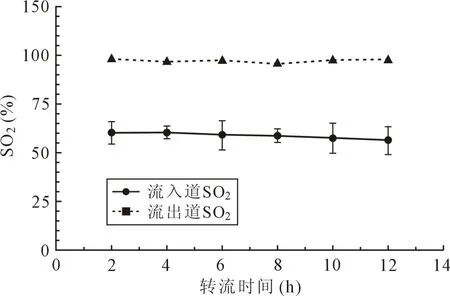
图5 MI-VA组氧合性能
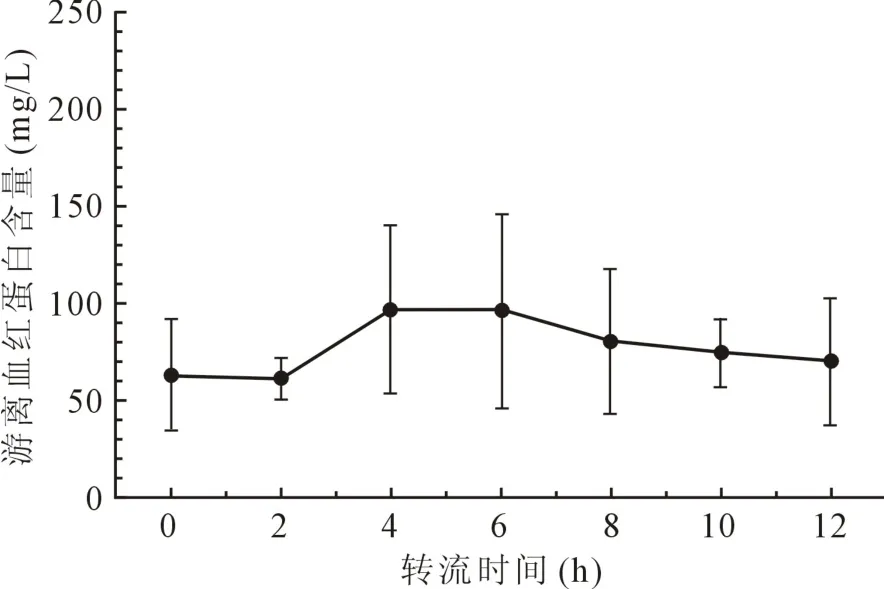
图6 MI-VA组游离血红蛋白检测
3 讨 论
急性心肌梗死导致的心源性休克临床救治成功率低、死亡率高、且预后较差,远期易发生心功能衰竭。且心肌细胞缺乏再生能力,心梗导致的心肌细胞缺血缺氧性损伤和心肌纤维化将改变心室结构并进一步影响心脏功能,影响远期预后[1]。尽管近年来急性心肌梗死的诊治手段已取得明显进步,其近期预后有了明显改善,但心源性休克仍是急性心肌梗死患者院内死亡的主要原因。心室辅助是临床治疗心力衰竭的重要手段和方法。左心室循环辅助装置可以通过减少心梗后心肌耗氧量,对缺血心肌负荷卸载,从而减少梗死面积。有研究表明,对急性心梗后衰竭的左心室进行机械辅助循环支持、负荷卸载可有效减少心梗后心肌细胞凋亡、炎症反应和心肌梗死周围缺血区的胶原化面积,从而减轻心梗后心室重构[4-7]。但其减少心肌细胞凋亡和减轻心室重构的分子机制尚无研究报道。
在心源性休克早期,循环辅助装置一方面可以挽救患者生命,维持生命体征平稳,另一方面可以有效减轻心脏负荷,让受损心肌充分休息,降低心肌耗氧,缩短心肌顿抑时间,减轻心肌损害。本研究中,两组动物CKMB及cTnI在缺血术后均明显升高,但MI-VA组各时间点CKMB及cTnI均明显低于MI组,也说明了负荷卸载作用可能减轻心肌损害。同时,急性心梗后发生慢性心力衰竭的主要病理基础是心室重构。心室重构发生包括心肌梗死部位坏死心肌膨出和非心肌梗死部位心肌肥大,间质纤维化,心室壁增厚、扩张、变形,收缩和舒张功能减退,导致心力衰竭。本研究术中持续监测血流动力学指标,MI-VA组转流12 h中无室性心律失常事件,血压维持稳定。且超声监测提示,MI-VA组LVEF在负荷卸载后逐渐回升稳定,相比MI组有明显差异,均提示负荷卸载作用可能减轻心梗后的心脏功能损害。
在急性心梗时心梗周边区域心肌细胞凋亡及心肌细胞外基质(extracellular matrix,ECM)异常增多和过度沉积导致的心肌肥厚及心肌纤维化在心室重构的发生发展过程中起着非常重要的作用[8-9]。基质金属蛋白酶(matrix metalloproteinase,MMP)主要作用是参与ECM的代谢。MMP活性的调节失控,可导致心肌纤维化、心室重构、心衰等发生[10-11]。而循环辅助装置救治模式提高急性心梗心源性休克救治成功率,改善预后,很可能是通过减少心梗周边区域心肌细胞凋亡及纤维化,在一定程度上抑制心梗后心室重构实现的。近年来,多种循环辅助装置逐渐被应用于急性心梗心源性休克的早期救治。特别是,心肺辅助装置救治心脏骤停等严重的急性心源性休克在临床上已有应用,主要是以ECMO技术为基础的心肺复苏(ECMO cardio-pulmonary resuscitation,ECPR)技术,在急性心源性休克患者的急救过程中发挥了巨大作用,为原发病救治争取了时间。由于目前仅在少数医疗机构配置了ECMO装备,但有限的临床研究表明,ECPR技术的应用能够明显提高急性心梗后心源性休克导致的心跳骤停患者的救治成功率[12-13]。
ECMO与体外循环原理类似,可在有效保障循环辅助的同时,提供呼吸支持,是有效的呼吸兼具循环辅助方式。在心源性休克早期救治中,能够明显改善远端组织灌注、提高救治成功率并改善预后。且安装方式采用外周血管插管方式,安装方便,可在较短时间完成安装开始辅助。但目前国内临床应用的ECMO装置设备较大、管路繁多,均为床边应用模式,操作相对复杂。本课题组研发的便携式泵肺辅助装置,设备精炼、预充量小、安装简化,并便于随患者转运。可将泵肺辅助救治过程提前至救治现场,提高对急性心肺功能不全患者救治的时效性[14-15]。作为新型便携式小型化泵肺辅助装置,本研究实验过程中装置运行平稳,流出道SO2在各时间点均保持98%以上,氧合指数均在100 ml/min以上,提示该装置氧合性能良好,符合临床应用需要。但此自制装置仍需大规模临床研究试验其安全性及有效性。
综上所述,人工泵肺装置早期应用于羊急性心梗模型的救治,能够维持较稳定的血流动力学、减轻心肌损害、改善心室功能。因此,在急性心梗心源性休克的治疗中,早期应用心肺辅助装置,可能会减轻心梗后的心室重构。

