小檗碱靶向结合VEGFR2抑制血管生成作用的研究
李 力,武明飞,余宏铸
恶性肿瘤是严重影响人体健康和威胁人类生命的重要疾病之一,已成为人类死亡的第二个原因,也是最难治疗的疾病之一。血管生成是肿瘤生长和转移的关键过程。没有血管生成,最大的肿瘤只能长到1~2 mm,很容易使用传统的化疗药物治疗[1-2]。因此,通过阻断肿瘤血管生成,已成为抑制肿瘤生长的肿瘤治疗新策略[3]。
小檗碱又称黄连素,占黄连总生物碱的40%左右,属于季铵型异喹啉类生物碱,是中药黄连的主要生物碱,其含量高达5%~8%,不仅含量最高,且是其主要有效成分[4]。现代药理学证明小檗碱具有广泛的药理学作用,其中小檗碱作为抗肿瘤药物的文献已经具有很多生药学和临床学的证据。研究[5]表明小檗碱能够通过诱导肿瘤细胞程序性死亡、抑制遗传信息合成、阻滞细胞周期等机制抑制肿瘤细胞增殖,其在肿瘤防治方面具有潜在的应用前景。课题组采用计算机反向虚拟筛选发现,小檗碱与肿瘤血管生成密切相关的血管内皮细胞生长因子受体2 (vascular endothelial growth factor receptor 2, VEGFR2)有良好的结合作用,因此推断该小分子具有抗肿瘤血管生成的潜能。该研究为了验证这一推论,采用了EA.hy926细胞(人脐静脉内皮细胞HUVEC与肝癌细胞A549融合株)为模型,进行了一系列体内外实验,评价小檗碱的抗血管生成作用,并初步探讨其作用机制。
1 材料与方法
1.1 实验材料
1.1.1试剂及来源 小檗碱、3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2H-四唑鎓溴化物(MTT)购自美国Sigma公司;兔抗人抗体(PI3K、Akt、mTOR和P70S6K)购自武汉伊莱瑞特生物科技股份有限公司;抗β-肌动蛋白,磷酸特异性抗体[抗Akt(Ser 473)、抗mTOR(Ser2448)和抗-P70S6K(Thr 389)]、VEGFR2蛋白、VEGFR2酶ELISA试剂盒购自美国Cell Signaling Technology公司;TRIzol试剂、蛋白酶抑制剂混合物购自上海碧云天生物技术有限公司;PBS缓冲液、培养基(DMEM)和胎牛血清购自美国Thermo Fisher Scientific公司。
1.1.2实验细胞 人脐静脉内皮细胞与肺癌细胞A549融合株EA.hy926细胞株购自中科院上海细胞库。
1.2 实验方法
1.2.1反向找靶及分子对接 采用Discovery Studio 2017R2进行反向找靶。配体首先使用DS 2017 R2进行结构优化,随后对蛋白和配体进行加氢和电荷,最后采用Discovery Studio 2017R2对接程序进行分子对接及分析结果。根据反向对接结果,选择VEGFR2(PDB号:3vid)为潜在靶点,使用Libdock程序进行再次对接,并分析配体与蛋白之间的作用模式。所有蛋白质晶体结构来源于Protein Data Bank数据库。
1.2.2表面等离子体共振实验(surface plasmon resonance,SPR)实验 采用GE Biacore T200生物大分子相互作用分析仪进行操作。首先将生物素(100 nmol/L)标记的VEGFR2固定在带有链亲和素标记的芯片上。其次将6种不同浓度的小檗碱溶液以20 μl/min 的速度流过芯片,整个过程持续5 min;化合物和蛋白结合后,再用缓冲液冲洗10 min,最后用Biacore T200分析软件2.1分析结果。
1.2.3酶活性测试实验 按照VEGFR2 ELISA试剂盒的说明书操作。
1.2.4细胞培养 在补充有10%胎牛血清和链霉素/青霉素(100 U/ml)的DMEM培养基中培养EA.hy926细胞。
1.2.5MTT实验 将细胞铺在96孔板中,培养24 h后,与各种浓度的小檗碱(0、5、10、20、40、80 μmol/L)在37 ℃共孵育48 h。弃去培养基,每孔加入20 μl的MTT溶液(5 mg/ml)继续孵育4 h,然后将DMSO(100 μl/孔)加入到每孔中,震荡,在492 nm波长处测定吸光度。所有的测量结果一式三份。
1.2.6划痕实验 EA.hy926在6孔板中长满单层后,用移液枪枪头在细胞底层划一条直线,弃去培养基,用100×放大倍数的显微镜拍照记录,然后加入含有不同浓度小檗碱的培养基继续培养24 h,弃去培养基,再次拍照记录,计算迁移率。所有实验操作3次。
1.2.7鸡胚绒毛尿囊膜 (chick embryo chorioallantoic membrane, CAM)膜实验 取孵育8 d的鸡胚,在气室端开一个1 cm×1 cm的小孔,将配制好的含有不同浓度的小檗碱的小纸片(半径2.5 mm)贴在血管较少部位,封闭,37 ℃温箱中无菌培养3 d后将鸡胚转移到4 ℃冰箱中冻存,24 h后剥离CAM,平铺,拍照,记录结果。
1.2.8Western blot实验 不同浓度的小檗碱与EA.hy926细胞共孵育48 h后,收集细胞,提取总蛋白,BAC法测定蛋白浓度。SDS-PAGE电泳分离蛋白,然后将将漂洗后的凝胶转移到PVDF膜上。随后将膜在室温下用5%脱水脱脂牛奶封闭膜2 h。之后TBST缓冲液洗涤3次,每次15 min。然后将转好的PVDF膜与一抗在4 ℃中温育过夜。随后在室温下加入与辣根过氧化物酶(HRP)缀合的二抗(山羊抗兔IgG-HRP抗体)1 h。未结合抗体用TBST洗涤3次,每次15 min。最后使用增强的化学发光试剂将印迹中的特定蛋白质可视化,最后用凝胶成像系统分析结果。
2 结果
2.1 反向找靶针对Discovery studio 2017R2自带的药物靶点晶体结构数据库反向虚拟筛选,结果显示小檗碱能够结合多种靶点(图1),其结合能力用契合值表示,契合值越大,结合能力越强。取打分前十的结果分析(表1),结果显示小檗碱能够与VEGFR2的产生良好的结合作用,提示VEGFR2可能是小檗碱的重要靶点之一。
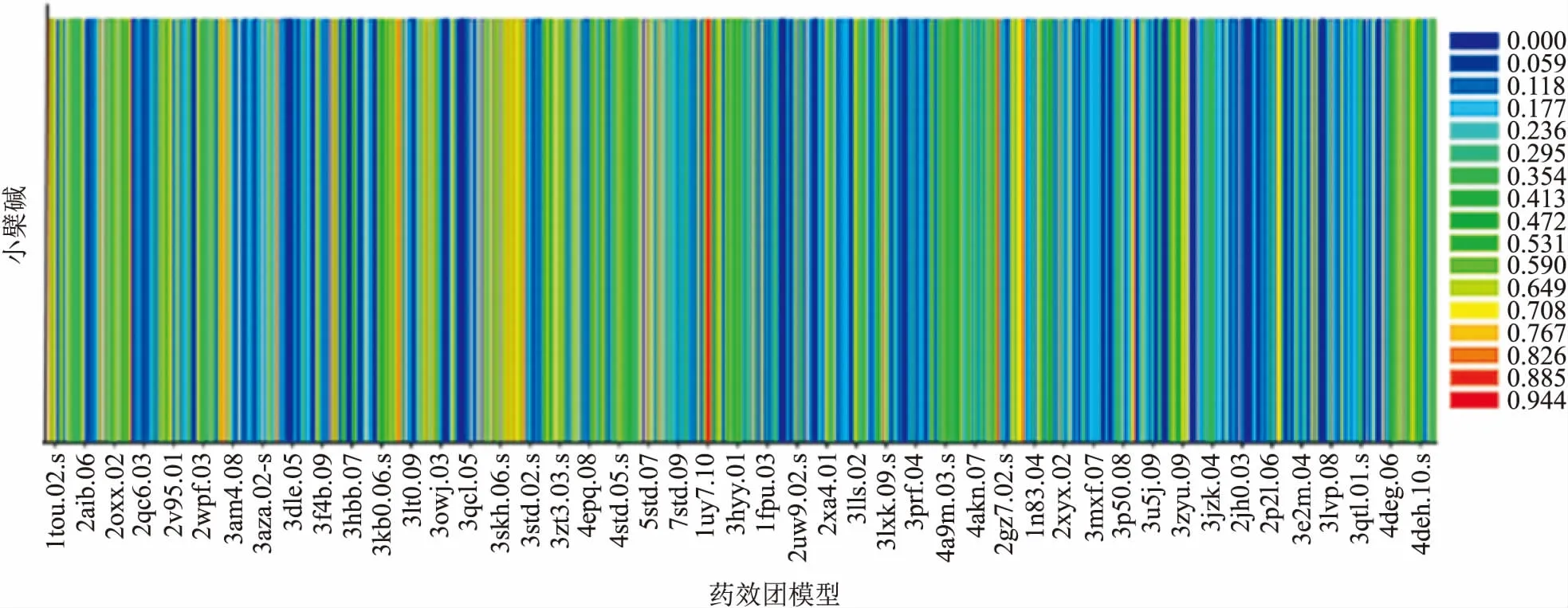
图1 Discovery Studio 2017R2分析预测小檗碱的蛋白质靶标
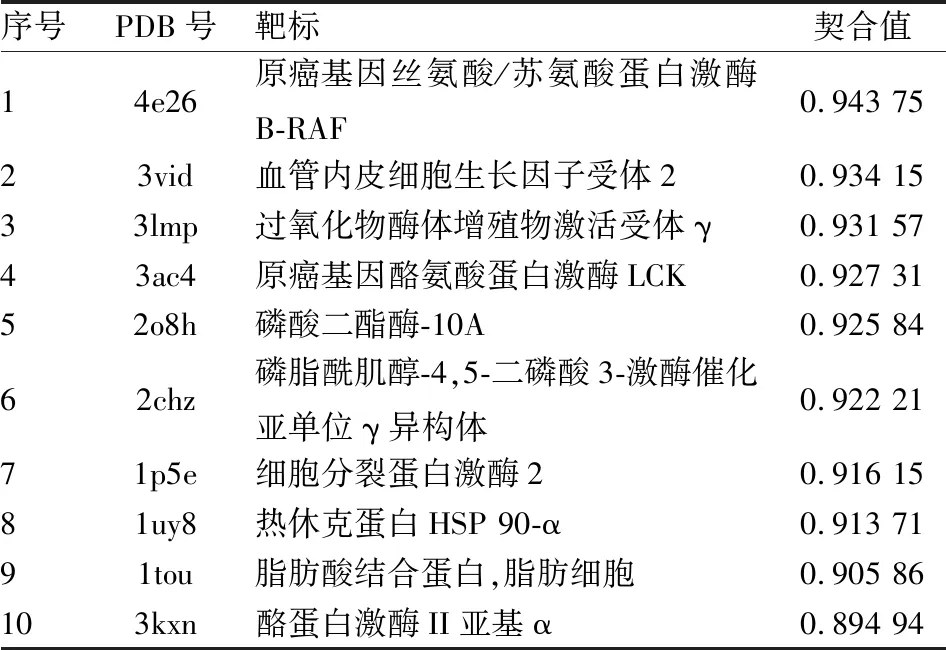
表1 Discovery Studio 2017R2预测的排名前十位的蛋白质靶标
分子对接分析了小檗碱与VEGFR2的结合模式。如图2所示,小檗碱能够通过多重作用结合到VEGFR2的活性位点,结合方式包括分之间氢键、与芳香氨基酸残基之间的Π-Π堆积作用、p-Π堆积作用等。这一结果提示了小檗碱与VEGFR2结合契合值高的原因。
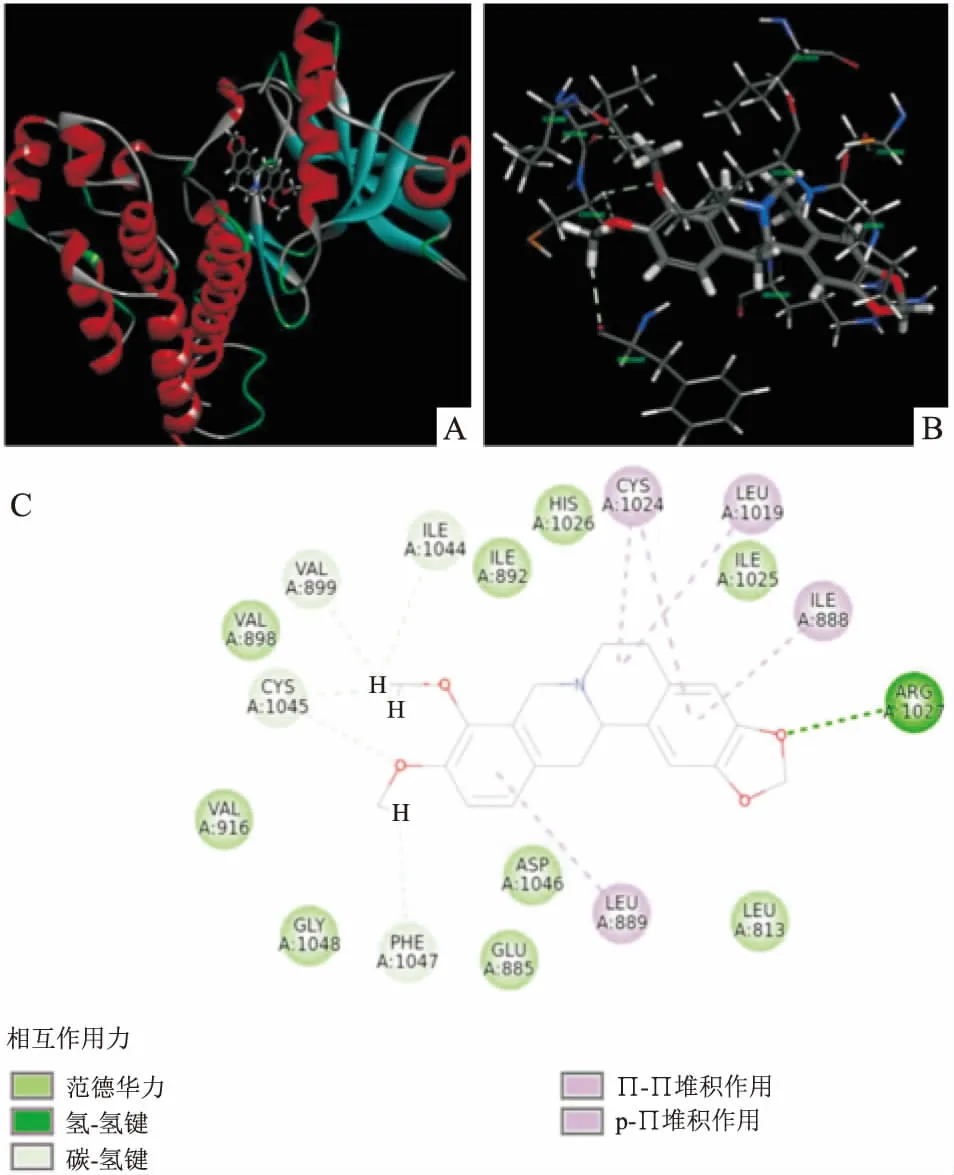
图2 小檗碱与VEGFR2(PDB号:3vid)的结合模式图
A:小檗碱插入VEGFR2活性位点的三维图;B:VEGFR2活性位点与小檗碱相互作用的氨基酸残基;C:VEGFR2活性位点的氨基酸残基与小檗碱相互作用的二维模式图
2.2 小檗碱与VEGFR2良好的结合作用并显著抑制VEGFR2激酶的活性为进一步证实小檗碱与VEGFR2的结合作用,本研究开展SPR实验。过程如图3所示,图中的6条线代表不同浓度的小檗碱与VEGFR2的结合情况。分析结果显示,小檗碱对VEGFR2的结合常数KD值达到0.652 64 μmol/L,说明小檗碱在体外与VEGFR2有良好的结合作用。
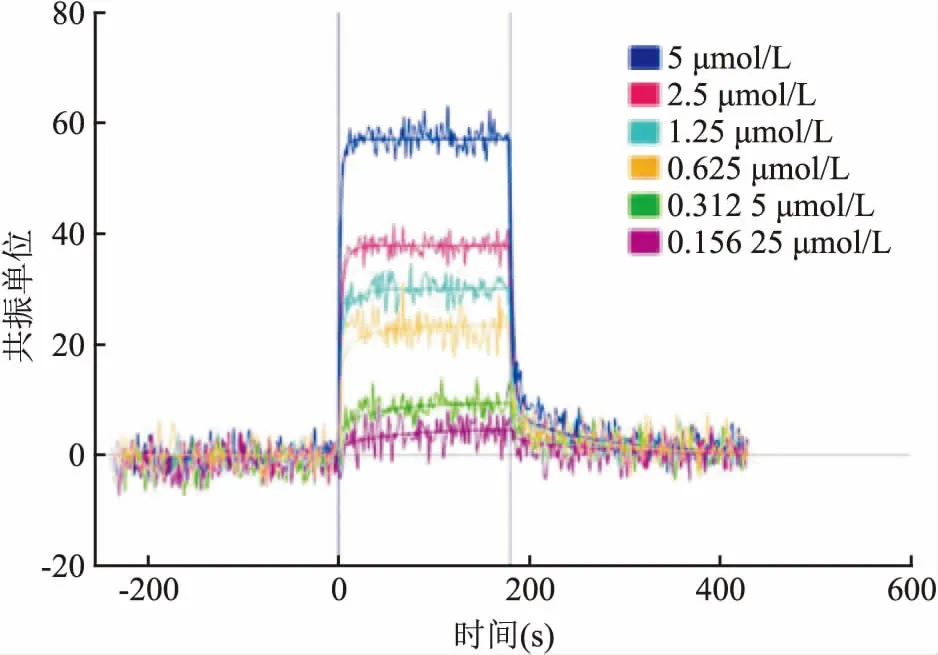
图3 SPR 法测定小檗碱与VEGFR2蛋白的结合作用
酶抑制实验评价了小檗碱对VEGFR2激酶活性的抑制作用。结果如图4所示,小檗碱对VEGFR2激酶活性的抑制作用呈剂量依赖性。相对于空白对照组,在8 μmol/L浓度时酶活性抑制率即达到50 %以下,且差异具有统计学意义(t=23.63,P=0.001 7)。经拟合得到酶抑制活性半数抑制浓度(IC50)值为(5.48±0.37)μmol/L,其数量级与阳性对照药物Semaxanib(IC50)=(1.67±0.16) μmol/L相当。
2.3 小檗碱抑制EA.hy926的增殖与迁移MTT实验结果显示,小檗碱对EA.hy926有中等强度的细胞毒性,IC50值为(15.18±1.04) μmol/L。基于这一实验结果,在非毒性浓度条件下,评价了小檗碱抑制EA.hy926的迁移作用。迁移实验结果如图5所示,相对于空白对照组,5 μmol/L浓度的小檗碱干预24 h后,EA.hy926细胞的迁移能力明显受到抑制,相对迁移率下降到(62.13±2.34)%,差异有统计学意义(t=5.988,P=0.039),且这种抑制作用随小檗碱浓度的增加而增强,在10 μmol/L浓度时,相对迁移率下降到(41.64±3.71)%,差异有统计学意义(t=15.38,P=0.016)。
2.4 小檗碱对CAM血管生成的抑制作用与空白对照组(使用0.9% NaCl溶液作为空白对照)比较,小檗碱可显著抑制新血管增殖,显示出明显的抗血管生成活性。如图6所示,小檗碱10 μmol/L浓度组在载样滤纸片周围表现出血管网分布稀少、分叉程度低的结果,而阴性对照组的血管网表现出血管分布均匀、粗大、形成多级分叉的现象;20 μmol/L浓度组则显示出更为显著的抗血管生成活性。除此之外,测试物滤纸片周围血管颜色鲜红,说明测试物没有影响原有血管的活性。由此可见,小檗碱在一定浓度范围内,随着浓度越大,小檗碱的抗血管生成活性越明显。
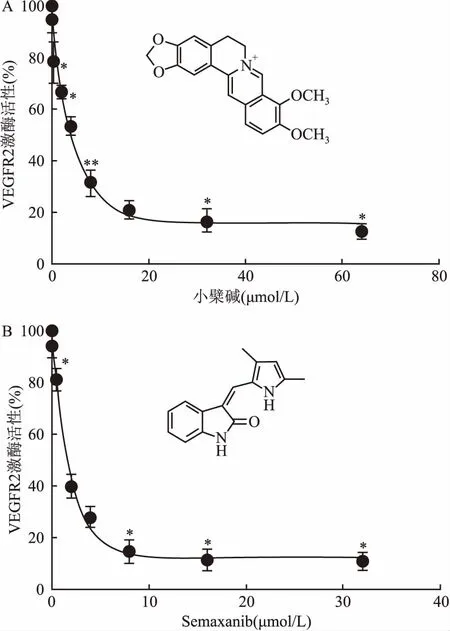
图4 小檗碱和Semaxanib对VEGFR2激酶的抑制作用
A:小檗碱对VEGFR2激酶酶活抑制曲线;B:Semaxanib对VEGFR2激酶酶活抑制曲线;与空白对照组比较:*P<0.05,**P<0.01
2.5 小檗碱抑制EA.hy926中VEGFR2介导的Akt/mTOR/P70S6K信号传导的活化小檗碱与EA.hy926作用24 h后能够显著抑制VEGFR2下游信号分子如Akt、mTOR和P70S6K的激活(图7),这表明小檗碱通过结合制EA.hy926细胞表面的VEGFR2从而阻断其介导的Akt/mTOR/P70S6K信号传导途径来抑制血管生成。
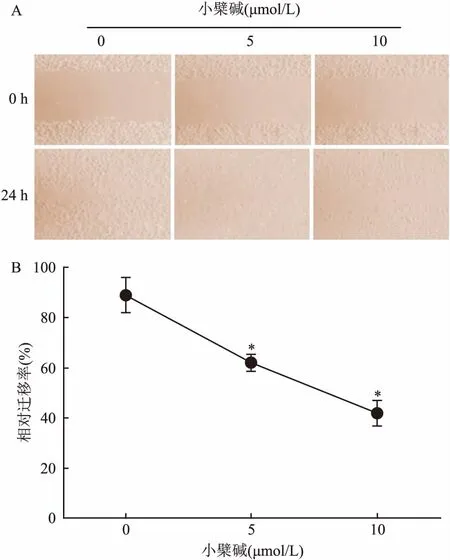
图5 小檗碱对EA.hy926细胞迁移能力的影响
A: 0、5、10 μmol/L浓度条件下细胞迁移结果;B:相对迁移率;与0 μmol/L小檗碱组比较:*P<0.05
3 讨论
小檗碱作为黄连主要活性成分被证明是其清热燥湿,泻火解毒等功效的主要成分;现代药理学研究证实,小檗碱不仅在抗菌消炎、抗肠道细菌感染等传统药效方面发挥作用,而且在心血管系统疾病治疗、高脂血症及癌症等方面的治疗也表现出较好的生物活性,具有潜在的广泛应用价值[4-6]。国内外许多学者对小檗碱进行了大量、深入的研究,不仅实现工业化的生物合成,而且通过对该类化合物的结构改造和修饰合成了一系列衍生物,并进行了相关的药理活性测试,证实小檗碱能够诱导多种肿瘤细胞的凋亡和抑制其细胞增殖,其中包括乳腺癌、肺癌、结肠癌、肝癌等[4-5]。关于小檗碱抗肿瘤细胞的机制研究报道虽多,但是深入研究的并不多。对传统药物靶点筛选的方式通常是盲目,这种方法耗时耗力,急需引入一种快捷的寻靶方式。反向虚拟筛选是一种对给定药物或活性小分子通过计算方法找到其潜在药物靶标的技术。可以用于化合物靶标确证、药物新作用研究、药物毒副作用研究。本研究采用反向虚拟筛选技术观察了小檗碱对Discovery Studio 2017自带的药效团模型数据库的结合作用。结果显示,在海量的靶点中,小檗碱与VEGFR2有良好的结合作用,其结合模式通过分子对接实验进行了解析,结果显示小檗碱能够多重作用结合到VEGFR2的活性位点。SPR实验验证和酶抑制实验进一步证实了小檗碱与VEGFR2有良好的结合及酶活抑制作用。
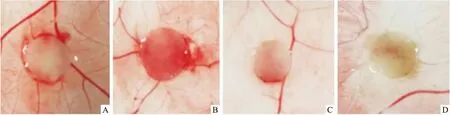
图6 CAM实验测定的结果A~D:0、5、10、20 μmol/L小檗碱
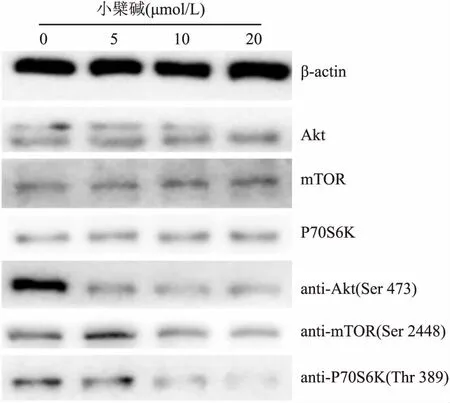
图7 小檗碱抑制EA.hy926细胞中Akt/mTOR/P70S6K信号通路的激活
在肿瘤血管新生过程中,许多信号通路起到重要作用,VEGF信号通路尤为重要。VEGFR2作为VEGF信号通路中的关键因子,已成为许多抗肿瘤血管生成药物开发的重要靶点[7]。鉴于小檗碱与VEGFR2的良好结合作用,推断小檗碱具备抗肿瘤血管生成的能力。为了验证这一推论,在体内外评价了小檗碱抑制血管生成的作用。研究结果显示,小檗碱对人脐静脉内皮细胞与肺癌细胞A549融合细胞株EA.hy926的增殖有明显的抑制作用,IC50值为(15.18±1.04) μmol/L,其作用机制可能是细胞毒性作用,或是影响细胞周期从而影响细胞增殖,但具体的作用环节仍不清楚,有待进一步的研究。内皮细胞的迁移是血管新生的重要环节[8],在本研究中采用划痕实验评价了药物干预下EA.hy926细胞的迁移能力。结果显示,小檗碱能够显著抑制EA.hy926 细胞的迁移,且呈剂量依赖性,表明小檗碱对EA.hy926细胞的运动有明显的抑制作用。CAM法是筛选血管新生抑制剂的一种简便、快捷的方法,CAM的血管生成早期,机体免疫系统尚未完全建立,因此CAM对各种异物几乎不发生排斥反应,便于将含有药物的载体置于其表面,观察药物对血管生成的影响[9-10]。为进一步验证小檗碱的体内抗血管生成能力,使用不同剂量的药物干预了CAM上小血管的生成。结果显示与空白对照比较,给药组的CAM表面血管的生成明显受到抑制,且药物浓度越高抑制作用越明显,且测试物滤纸片周围血管颜色鲜红,含血液,说明小檗碱没有毒死原有的血管,而是抑制了血管的新生。此外,VEGFR2所介导的Akt/mTOR/P70S6K信号传导最近被确定为新的血管生成功能介质[11-12],该信号通路的活化是导致肿瘤血管新生的重要机制[13]。用小檗碱干预EA.hy926细胞后,mTOR和P70S6K及其上游激酶Akt的磷酸化急剧下降,表明小檗碱可通过结合VGEFR2阻断其多个下游信号传导成分来抑制肿瘤血管生成。
综上所述,小檗碱能够结合VEGFR2,抑制VEGFR2的活性,阻断VEGFR2介导的Akt/mTOR/P70S6K信号通路,抑制EA.hy926细胞的增殖与迁移,抑制CAM表面血管的生成,具有显著的抗血管生成的活性作用。这些结果提供了对小檗碱的抗血管生成作用涉及的机制的理解,并突出其抗癌潜力,为以后抗癌机制和抗癌药物的发展和研制提供了一个全新思路。

