缺血预处理诱导的血清外泌体对大鼠心肌缺血再灌注损伤的影响
产进中,刘 中,黄 俊,张 丽,张 野,何淑芳
缺血性心脏病是目前全球致死率最高的心血管疾病[1-2]。其中心肌缺血再灌注(ischemia reperfusion,I/R)损伤是导致患者死亡的主要原因之一[3]。外泌体(exosome,Exo)是细胞主动向胞外分泌的一种囊泡样小体,直径约为30~100 nm,其可通过运输蛋白质、RNA或微小RNA (microRNA,miRNA)等物质,靶向作用于细胞,是细胞间信号通讯的重要方式之一[4]。研究[5]表明Exo在心血管疾病中可以发挥重要的心肌保护效应。然而,关于Exo是否参与缺血预处理(ischemic preconditioning, IPC)[6]介导的心肌保护效应,目前尚未报道。因此,该研究拟通过探讨IPC处理后从血清提取的Exo对心肌I/R损伤的影响,以研究IPC发挥心肌保护作用的新机制和靶点。
1 材料与方法
1.1 实验材料ExoQuickTM外泌体提取试剂盒购自美国SBI公司;2,2-联喹啉-4,4-二甲酸二钠(BCA)蛋白定量试剂盒购自上海碧云天科技研究所;抗白细胞分化抗原(cluster of differentiation,CD 63)、抗热休克蛋白(heat shock protein,HSP60)抗体均购自美国Santa Cruz公司;ECL发光试剂盒购自美国Pierce公司;氯化三苯基四氮唑(TTC,129K1867V)购自美国Sigma公司;肌钙蛋白I(cardiac troponin I,cTnI)测定试剂盒(化学发光法)购自美国Beckman Coulter公司;HX-300S型动物呼吸机购自成都泰盟科技有限公司;PowerLab系统购自澳大利亚AD公司;冷冻透射电镜购自中国科技大学生命科学院;Tanon全自动凝胶成像系统购自上海天能科技有公司。
1.2 I/R模型建立清洁级健康雄性SD大鼠38只,体质量250~300 g,由安徽医科大学动物实验中心提供。大鼠经腹腔注射5%戊巴比妥50 mg/kg麻醉下,行气管切开插管,连接动物呼吸机,以室内空气通气,潮气量为20~30 ml/kg,呼吸频率为70~80次/min。行左颈动脉切开置管,通过压力换能器,连接PowerLab系统,记录心电图、平均动脉血压(mean artery pressure,MAP)、心率(heart rate,HR)。行右颈内静脉切开置管用于输液和给药。沿左锁骨中线切开皮肤2 cm,在第4、5肋间打开胸腔,剪开心包,轻压右侧胸廓,挤出心脏。在肺动脉圆锥与左心耳之间冠状动脉处用6-0 Prolene线作一线结,把心脏放回胸腔,稳定15 min后开始缺血再灌注损伤实验,即收紧线结即完成左冠状动脉闭塞致心肌缺血,表现为其支配的局部心肌发绀、血压下降、ST段抬高或降低;松开线结即行再灌注处理。
1.3 Exo的分离提取取8只大鼠随机分为2组(n=4):IPC组,先进行IPC,即对心肌行缺血5 min,再灌注5 min,重复3次。处理结束即刻经颈动脉快速取血置于含促凝剂的采血试管内,获取血清,利用ExoQuickTM试剂盒提取Exo,加入100 μl PBS重悬,经0.22 μm的无菌滤膜除菌,于-80 ℃保存,标记为缺血预处理外泌体(Exo-IPC)。对照组(CON),仅穿线不进行任何处理,30 min后获取血清,然后以相同方法提取外泌体,标记为对照外泌体(Exo-CON)。
1.4 Exo鉴定分析将10 μl混悬均匀的Exo溶液滴在载样铜网上,室温静置1 min后,液体用滤纸从铜网边缘吸去。用10 g/L磷钨酸(pH 6.8)滴于铜网上,室温负染5 min,滤纸从铜网边缘吸去多余液体,待常温下干燥后,80~120 kv上机成像。用冷冻透射电镜观察外泌体的形态,并随机选取视野,拍摄照片,用标尺计算直径。冰上解冻外泌体,加入5×上样缓冲液,95 ℃加热5 min使蛋白变性,常规制胶、上样,蛋白电泳,然后转膜、封闭,分别加入5% BSA稀释的一抗HSP60(1 ∶500)或CD63(1 ∶500),4 ℃孵育过夜,次日TBST 洗涤3次,每次10 min,在山羊抗鼠IgG(1 ∶10 000)或山羊抗兔IgG(1 ∶20 000)中室温孵育1 h,TBST液漂洗3次,每次5 min,采用ECL发光试剂盒,在Tanon全自动凝胶成像系统中自动曝光采集图像。
1.5 Exo浓度测定参照文献[7]方法,将提取的Exo样品利用2,2-联喹啉-4,4-二甲酸二钠(BCA)蛋白定量法测定提取Exo浓度。分别取待测Exo-IPC、Exo-CON样品各5 μl稀释10倍后,严格按照BCA试剂盒的说明书测量各样品的浓度,每个样品设3个复孔。
1.6 实验动物分组及给药方法大鼠采用随机数字表法分为5组(n=6):假手术组(Sham组)、缺血再灌注组(I/R组)、I/R+Exo-IPC组、I/R+Exo-CON组、溶剂对照组(I/R+PBS组)。I/R+Exo-IPC组、I/R+Exo-CON组、I/R+PBS组分别于缺血前15 min经颈静脉一次性给予Exo-IPC(0.4 μg/μl)、Exo-CON(0.4 μg/μl)以及PBS各100 μl。除Sham组外,其余各组均给予缺血30 min,再灌注120 min处理。
1.7 血清肌钙蛋白I(cardiac troponin I,cTnI)测定于再灌注120 min结束后,经颈动脉取血,离心分离血清,放入-80 ℃保存。严格按照cTnI测定试剂盒(化学发光法)要求测定各组血清cTnI水平。
1.8 心肌梗死体积测定实验结束后取出心脏,去除非心脏组织,生理盐水灌注,冲洗出血液,结扎左冠状动脉,从主动脉注入0.25% Evan蓝溶液。置于-80 ℃冰箱中,待充分冷冻后,行冰冻切片,沿心脏纵轴线切5~6片,每片厚约2 mm。切片放于1%氯化三苯基四氮唑溶液中,37 ℃水浴锅中孵育15 min;随后用10%中性福尔马林固定过夜,缺血危险区中呈白色为梗死区,呈红色为非梗死区。采用Imaging J 1.38e图像分析软件分析左心室(left ventricular area,LV)、右心室(right ventricular area,RV)、缺血危险区(area at risk,AAR)和梗死区(infarct size,IS)的面积,乘以0.2 cm即为各区的体积,并计算LV体积与RV体积之和(LV+RV)、IS体积与AAR体积以及IS/ARR比值。
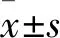
2 结果
2.1 Exo的鉴定分析通过透射电镜观察纳米级别的Exo形态,可见大小均一的微型囊体结构,直径约30~100 nm左右,形态为圆形或椭圆形,在边缘可观察到类似细胞膜的双层膜结构,见图1。Western blot 结果显示:Exo-IPC的Exo特异性蛋白标志物HSP60(t=4.009,P<0.05)和CD63(t=3.905,P<0.05)的相对表达量增高,差异有统计学意义,见图2A、2B 。BCA法测定血清Exo浓度,结果显示:Exo-IPC中Exo浓度显著增多,差异有统计学意义(t=3.066,P<0.05),见图2C。
2.2 心肌梗死体积各组LV+RV体积及AAR体积差异均无统计学意义(P>0.05);与Sham组比较,其余各组的IS体积和IS/AAR比值均升高,差异有统计学意义(F=53.28,P<0.01);与I/R组比较,I/R+Exo-IPC组的IS体积和IS/AAR比值显著降低,差异有统计学意义(t=3.209,P<0.05);与I/R组比较,I/R+Exo-CON组、I/R+PBS组的IS体积和IS/AAR比值差异均无统计学意义(P>0.05),见图3。
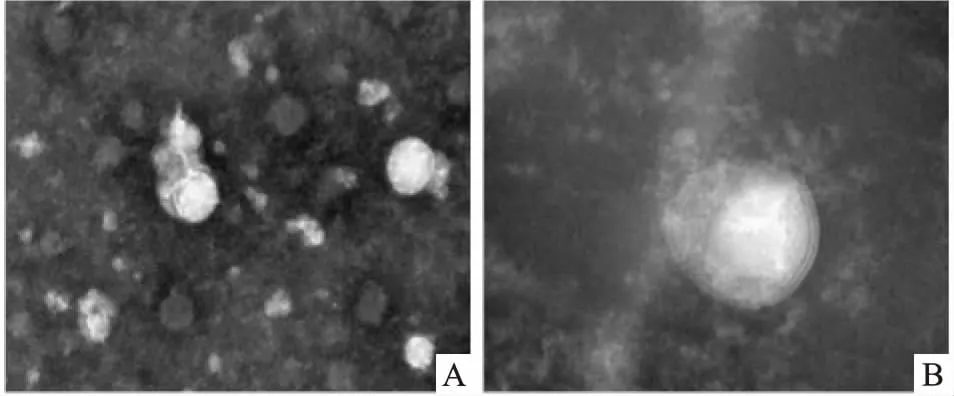
图1 外泌体透射电镜观察形态学结果A:bar=200 nm;B:bar=100 nm
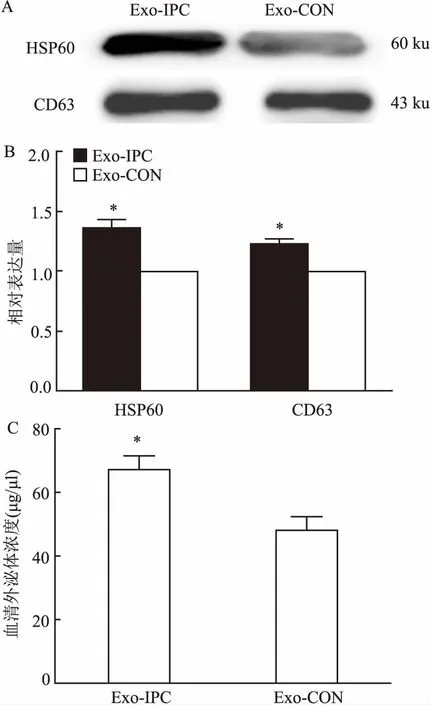
图2 Western blot 检测外泌体表面蛋白标志物以及BCA法测定外泌体浓度
A、B:HSP60、CD63表达;C:外泌体浓度;与Exo-CON比较:*P<0.05
2.3 cTnI水平与Sham组比较,其余各组再灌注120 min时血清cTnI浓度均升高,差异有统计学意义(F=27.14,P<0.01);与I/R组比较,I/R+Exo-IPC组血清cTnI浓度降低,差异有统计学意义(t=7.013,P<0.05);与I/R组比较,I/R+Exo-CON组、I/R+PBS组血清cTnI浓度差异均无统计学意义(P>0.05),见表1。
表1 各组大鼠血清cTnI水平的比较
与Sham组比较:*P<0.01;与IR组比较:#P<0.05
3 讨论
临床上心肌梗死溶栓、冠脉搭桥术和心脏瓣膜置换术等治疗方法都会涉及心肌I/R损伤这一重要的病理生理过程,预防和减轻心肌I/R损伤是目前临床上急需解决的问题。Exo作为细胞主动向胞外释放的具有一定生物活性功能的小囊泡,在心肌缺血后信号转导和组织修复过程中可能发挥着重要作用[8]。本研究通过提取IPC处理后大鼠血清中的Exo,将其注入受体大鼠体内,证明这些Exo可减轻受体大鼠心肌I/R损伤,降低心肌梗死面积和cTnI水平,提示预处理诱导释放的内源性Exo可能成为促进心肌缺血后组织损伤修复的潜在治疗措施。
本研究参照文献[9]利用ExoQuickTM试剂盒提取大鼠血清中的Exo。根据文献[10]报道,电镜下Exo为直径介于30~100 nm之间的类似椭圆形结构的纳米级双层膜囊泡,本研究在透射电镜下观察到的结果与其相符合。CD63、HSP60是目前鉴定Exo主要的表面标志性蛋白[11-12],本研究采用Western blot检测显示提取的外泌体CD63、HSP60均为阳性表达,且Exo-IPC中外泌体特异性的蛋白标志物相对表达量增高。同时,本研究还显示经过IPC后,大鼠血清Exo的浓度明显增加,表明IPC可刺激机体大量释放内源性Exo,从而增加其在血清内的含量。有报道[13]显示,当机体处于应激状态下时,细胞会迅速增加Exo的分泌量并改变其内容物的成分,并对机体产生不同程度的影响。Vicencio et al[11]研究显示,对自愿者和大鼠分别进行远端缺血预处理同样显著地增加了两者血浆中Exo的水平。
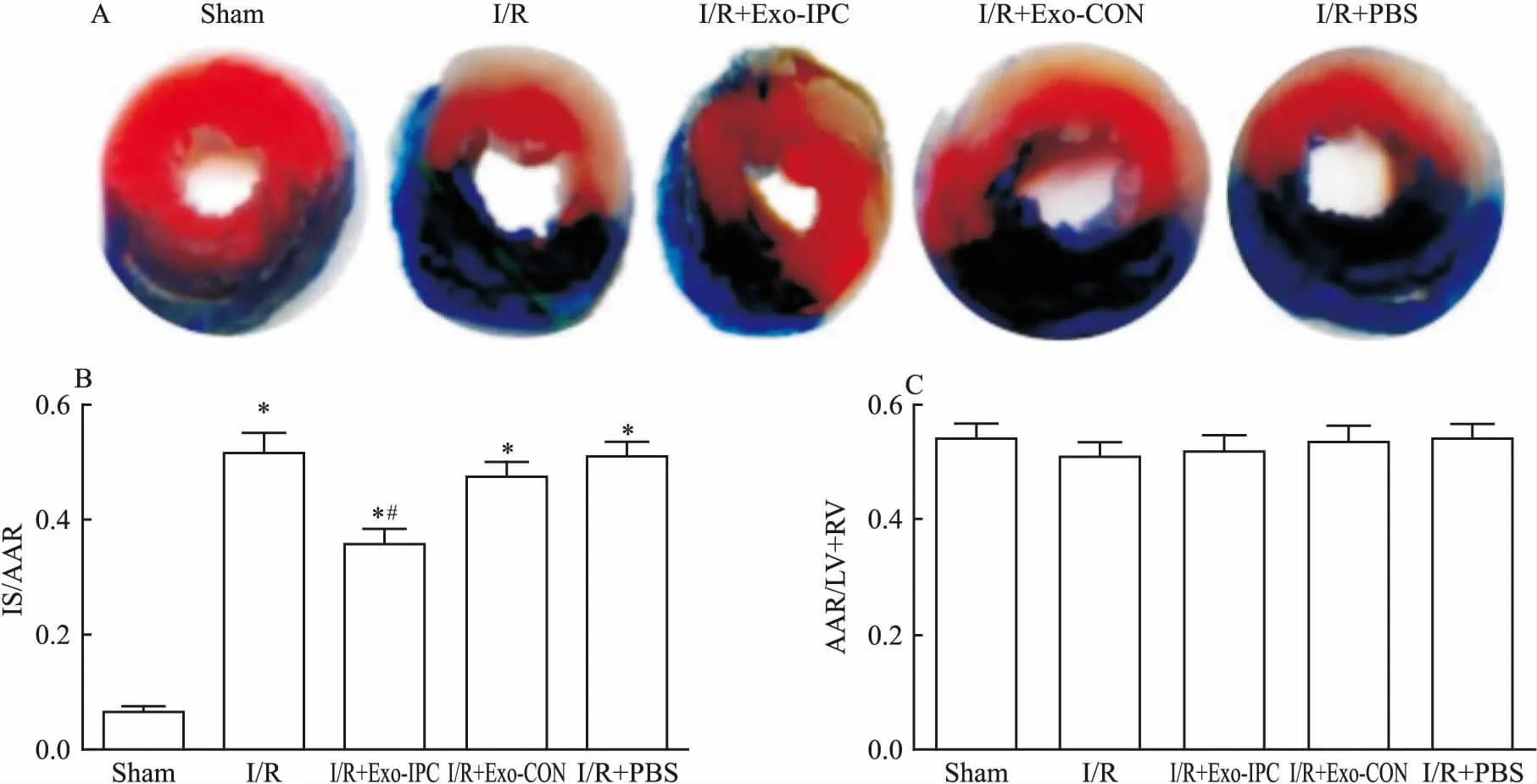
图3 TTC染色法检测各组大鼠心肌梗死
在心肌I/R损伤前,本研究将IPC诱导释放的血清Exo注入大鼠静脉内,可明显减小心肌梗死面积,同时血清cTnI水平也相应地降低,然而对照组Exo对I/R损伤不产生保护效应,这一结果提示IPC可通过刺激机体释放具有保护性作用的内源性Exo途径,来减轻缺血和再灌注引起的心肌损伤。Exo在预处理介导的心肌保护效应中发挥何种作用及其相关机制,目前国内外研究还很少。Giricz et al[12]报道,离体灌流的供体心脏经过3次(每次5 min)的IPC处理后,其冠脉流出液中的细胞外囊泡(其中包含有Exo),有助于减轻受体心脏的I/R损伤。远端缺血预处理诱导的内源性外泌体可能通过转运HSP70蛋白,激活心肌细胞内细胞外调节蛋白激酶和p38通路发挥心肌保护作用[11]。最新研究[14-15]还证实,经过缺氧预处理的间充质干细胞所分泌的Exo中含有大量的miRNA-22和miRNA-221,可通过作用于心肌细胞凋亡调控因子而发挥抗细胞凋亡作用。本研究通过IPC诱导机体释放Exo,研究内源性Exo心肌保护中的作用,但其具体作用机制尚需进一步研究。
综上所述,IPC可诱导大鼠血清Exo释放增加,这种内源性的Exo可减轻受体大鼠心肌I/R损伤,为研究IPC的心肌保护机制提供了新的方向以及的理论依据。

