重组人免疫球蛋白D-Fc片段蛋白的构建
张 静,陈文生,胡晓曦,黄 琼,吴育晶,魏 伟
免疫球蛋白D(immunoglobulin D, IgD)作为一类免疫球蛋白,主要以膜结合形式作为B细胞受体发挥作用,也可少量以分泌形式作为抗体发挥作用[1]。病理状态下IgD与T细胞上IgD受体(IgDR)的过度结合,可能导致自身抗体生成增多,自身免疫反应增强,从而介导自身免疫性疾病的发生[2]。IgD在一些类风湿关节炎(rheumatoid arthritis, RA)、系统性红斑狼疮(systemic lupus erythematosus, SLE)患者中高水平表达[3]。因此,以IgD-IgDR为治疗靶点研发针对治疗高水平IgD的自身免疫性疾病的新型生物制剂具有较好的临床前景。该实验首次制备出重组人IgD-Fc片段蛋白,并检测重组人IgD-Fc片段蛋白在健康人CD4+T细胞上与IgDR结合的亲和力大小,起到与IgD竞争IgDR的作用,为进一步研发针对高水平IgD自身免疫性疾病的新型生物制剂奠定实验基础。
1 材料与方法
1.1 样本收集安徽医科大学健康志愿者外周血标本共20例,经安徽医科大学伦理委员会批准,受试者知情同意并签署知情同意书。
1.2 主要试剂及仪器人IgD蛋白(美国Abcam公司);Jurkat、MOLT-4细胞株(中国科学院上海细胞库);胎牛血清(美国Gibco公司);红细胞裂解液(美国BD公司);TRIzol 试剂(美国Invitrogen公司);人淋巴细胞分离液(天津灏洋生物制品有限公司);CD4+T细胞免疫分选磁珠(德国美天妮试剂公司);His-Tag亲和层析柱(美国GE公司);10 ku蛋白超滤管(美国Millipore公司);琼脂糖胶回收试剂盒、质粒提取试剂盒(美国OMEGA公司);IPTG(美国Sigma公司);超声细胞破碎仪(南京赛飞生物科技有限公司);恒温摇菌箱(美国Thermo公司);蛋白纯化仪(美国GE公司);FC500流式细胞仪(美国Beckman Coulter 公司)。
1.3 方法
1.3.1pET28a(+)/IgD-Fc表达载体的构建
1.3.1.1健康人外周血cDNA获取 向1 ml血液中加入3 ml红细胞裂解液,室温放置10 min后10 000 r/min离心1 min;弃上清液,加入1 ml TRIzol试剂混匀,室温放置5 min后4 ℃、12 000 r/min离心10 min;取上清液,加入0.2 ml氯仿,振荡15 s后冰上放置3 min;4 ℃、12 000 r/min离心15 min,吸取水相,加入等体积冰冷异丙醇,冰上放置20 min后4 ℃、12 000 r/min离心10 min;弃上清液,加入1 ml 75%乙醇,4 ℃、10 000 r/min离心2 min,弃上清液;室温干燥10 min,加入20 μl DEPC水,溶解RNA;将RNA 反转录得到的cDNA 保存在-20 ℃待用。
1.3.1.2IgD-Fc基因片段的扩增及重组表达载体的构建 设计上游引物:5′-GCTAGCATGTGTCCGAGCC-3′,下游引物:5′-TCTGAGCTAGTTGAGCAGAGTCCG-3′,以上步cDNA为模板,扩增条件为94 ℃变性5 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,共35个循环,72 ℃延伸10 min。PCR产物进行电泳检测并回收纯化目的片段。将IgD-Fc PCR产物与pGMT-easy克隆载体连接,转化至大肠杆菌DH5α感受态细胞后均匀涂布于含氨苄霉素的培养板,挑取单克隆菌落,37 ℃摇菌培养12 h后碱裂解法抽提质粒。IgD-Fc pGMT- easy克隆载体双酶切,pET28a(+)表达载体双酶切,凝胶电泳分离并回收酶切产物,将双酶切后的目的片段连接于pET28a(+)表达载体,转化至DH5a,提取质粒,进行IgD-Fc表达载体酶切初步验证和测序鉴定。
1.3.2重组人IgD-Fc片段蛋白的诱导表达 将pET28a(+)/IgD-Fc原核表达载体转化至BL21(DE3)感受态细胞中,挑取单菌落于含卡那霉素的LB培基中,150 r/min扩大培养至OD600 nm值为0.6时加入终浓度为0.4 mmol/L的IPTG,20 ℃诱导表达6 h。
1.3.3重组人IgD-Fc片段蛋白的亲和层析、分子筛纯化及产物测定 向离心后的菌液沉淀中加入适量裂菌液(NaH2PO4·2H2O 20 mmol/L,NaCl 500 mmol/L,甘油10%,Triton X-100 1%,PMSF 1 mmol/L,溶菌酶1 mg/ml)并重悬,冰上裂解30 min后冰浴超声破碎15 min,4 ℃、12 000 r/min离心15 min,上清液留存,SDS-PAGE分析IgD-Fc重组蛋白表达形式。采用His-Tag预装柱纯化IgD-Fc重组蛋白,收集洗脱产物后采用10 ku蛋白超滤管进行二次纯化。将蛋白产物经SDS-PAGE,考马斯亮蓝染色,通过扫描灰度值分析IgD-Fc重组蛋白纯度。
1.3.4CD4+T细胞的分离、T淋巴瘤细胞株的培养 密度梯度离心法分离血液中单个核细胞,每107细胞加50 μl CD4+磁珠,混合均匀,30 ℃孵育30 min;加入1 ml BD清洗Buffer混匀后放至磁力架上孵育10 min;吸弃流式管内上清液,加入1 ml BD清洗Buffer,孵育5 min,并重复操作;重悬阳性成分,转入含5%胎牛血清的RPMI-1640培养液中用于实验。T淋巴瘤细胞株采用含10%胎牛血清的RPMI-1640、37 ℃、5% CO2进行培养,取对数生长期细胞用于实验。
1.3.5外周血CD4+T细胞和T淋巴瘤细胞株表面IgDR的表达 利用FITC荧光标记试剂盒标记人IgD蛋白(FITC-IgD),具体操作参见说明书,向CD4+T细胞及Jurkat、MOLT-4细胞株中加入不同浓度的FITC-IgD,共同37 ℃孵育1 h,并设置空白对照组,PBS洗涤后适量重悬细胞,流式细胞仪检测荧光强度。
1.3.6IgD与CD4+T细胞和T淋巴瘤细胞株表面IgDR的亲和力实验 将CD4+T细胞和Jurkat、MOLT-4细胞以2×106/孔的密度接种至6孔板,加入不同浓度FITC-IgD,37 ℃孵育2 h。PBS洗涤后适量重悬细胞,上机检测荧光强度。各浓度组的荧光强度减去空白对照组荧光强度,得到各浓度组IgD的特异性结合量,分别以不同浓度FITC-IgD为X轴,特异性结合量为Y轴,绘制饱和曲线,计算最大结合量(Bmax)和解离常数(KD)[4]。
1.3.7CD4+T细胞的IgDR竞争结合实验 CD4+T细胞以2×106/孔的细胞密度铺6孔板,分别加入FITC-IgD(10 μg/ml)和不同浓度的重组人IgD-Fc片段蛋白(0.03、0.1、0.3、1、3、10、30 μg/ml),37 ℃孵育2 h。PBS洗涤后适量重悬细胞,上机检测荧光强度。
2 结果
2.1 重组人IgD-Fc片段蛋白的表达、纯化
2.1.1pET28a(+)/IgD-Fc原核表达载体构建 通过PCR法扩增目的基因,连接克隆载体,双酶切,连接表达载体。经凝胶电泳检测(图1)、测序鉴定(图2),序列正确,成功构建原核表达载体pET28a(+)/IgD-Fc。
2.1.2重组人IgD-Fc片段蛋白的表达 诱导后的上清在34 ku附近有一条明显的条带(图3),与理论值相符。而未转化重组质粒的BL21(DE3)野生菌株在34 ku附近无明显条带。表明重组质粒在BL21(DE3)中诱导表达成功,且以可溶性蛋白形式存在。
2.1.3重组人IgD-Fc片段蛋白的纯化 通过His-Tag亲和层析和分子筛层析两步纯化,得到纯度95%以上的重组人IgD-Fc片段蛋白(图4、5)。
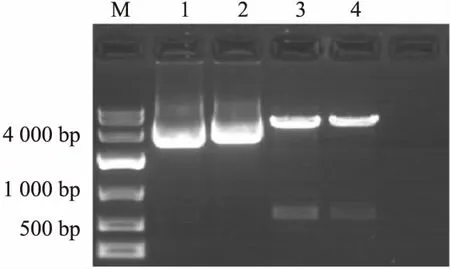
图1 重组质粒pET28a(+)/IgD-Fc双酶切鉴定
M:DNA Marker;1:空载体pET-28a(+);2:重组质粒pET28a(+)/IgD-Fc;3、4:经双酶切处理后的重组质粒pET28a(+)/IgD-Fc
2.2 CD4+T细胞和T淋巴瘤细胞株表面IgDR的表达FITC-IgD与IgDR结合后,流式细胞仪检测细胞表面FITC荧光强度。结果显示:随FITC-IgD浓度增高,流式峰图显著右移,证明CD4+T细胞(图6)、Jurkat和MOLT-4细胞(图7、8)上均有IgDR表达。
2.3 IgD与CD4+T细胞及T淋巴瘤细胞株表面IgDR的亲和力不同浓度FITC-IgD与细胞共同孵育后流式细胞仪检测FITC荧光强度,结果显示随FITC-IgD浓度增加,结合到IgDR上的配体逐渐增多,结合到IgDR的IgD可通过流式细胞仪检测其FITC平均荧光强度(MFI)并绘制饱和曲线(图9),分别计算IgD与CD4+T细胞及T淋巴瘤细胞株表面IgDR结合的Bmax和KD。结果显示, CD4+T细胞(Bmax=4 502±144.6,KD=7.254±0.956 7,R2=0.975 1)、Jurkat(Bmax=2 722±112.7, KD=9.876±1.589,R2=0.963 2)、MOLT-4细胞(Bmax=2 751±100.2, KD=7.88±1.161,R2=0.968 9)表面IgDR与IgD亲和力相近。
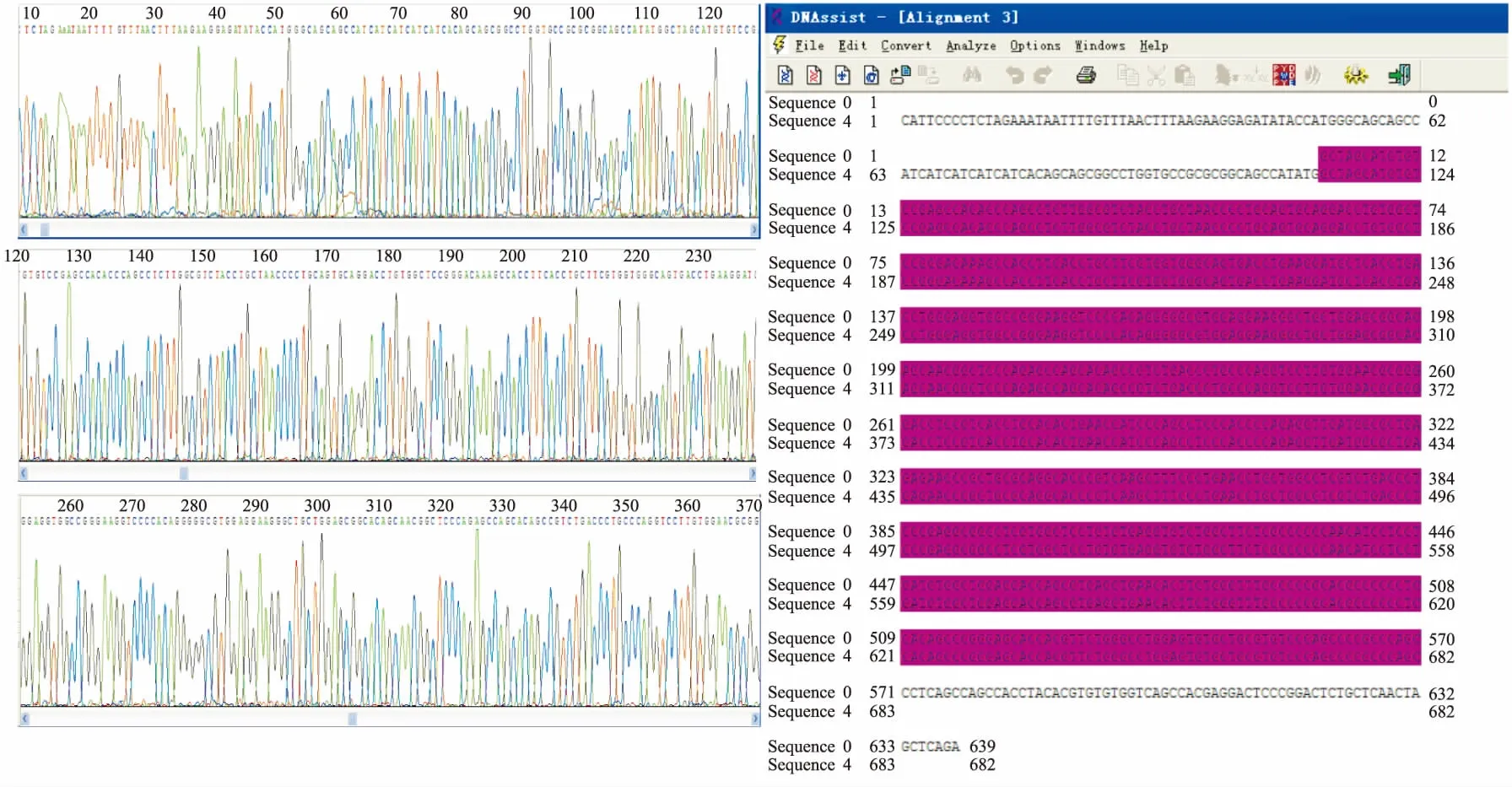
图2 原核表达载体pET28a(+)/IgD-Fc测序图
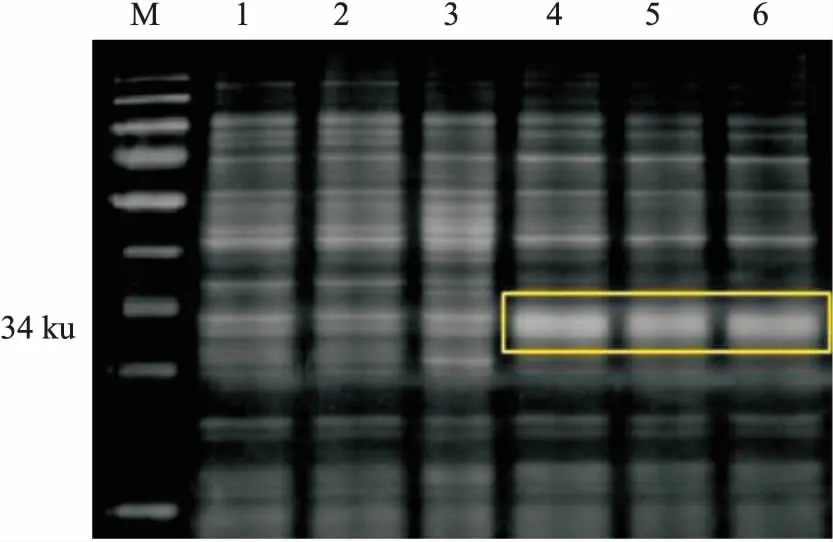
图3 IgD-Fc重组蛋白表达产物的SDS-PAGE电泳检测
M:蛋白Marker;1、2、3:大肠杆菌BL21(DE3)总蛋白;4、5、6:转化pET28a(+)/IgD-Fc的BL21(DE3)总蛋白
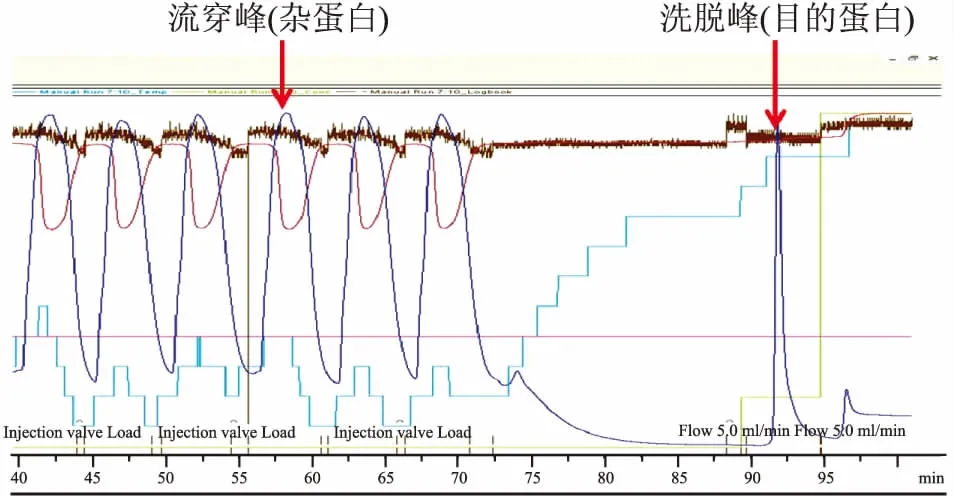
图4 重组人IgD-Fc片段蛋白His-Tag亲和层析纯化峰图
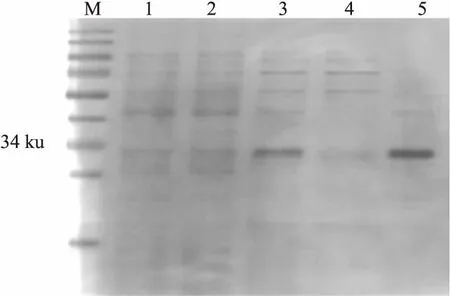
图5 重组人IgD-Fc片段蛋白的纯化
M:蛋白Marker;1、2:大肠杆菌BL21(DE3)总蛋白;3:亲和层析纯化产物;4:第二步纯化流穿产物;5:分子筛层析产物
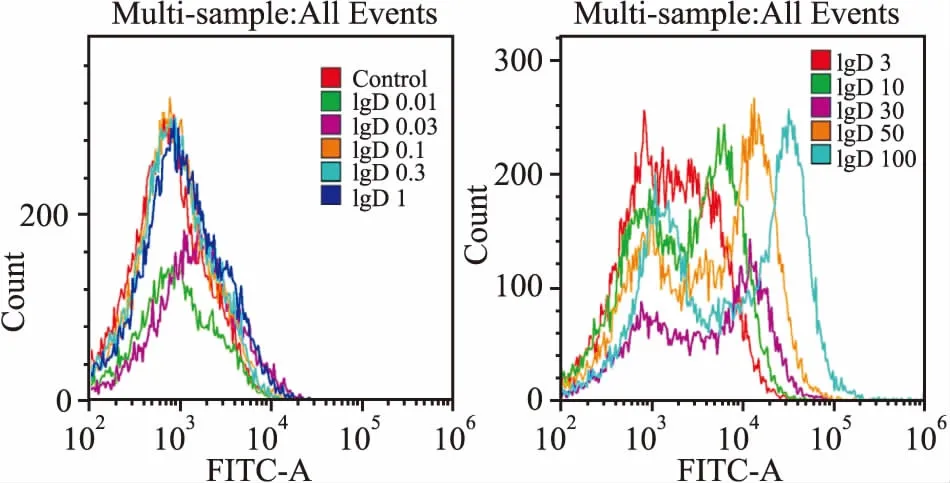
图6 CD4+T细胞表面IgDR表达
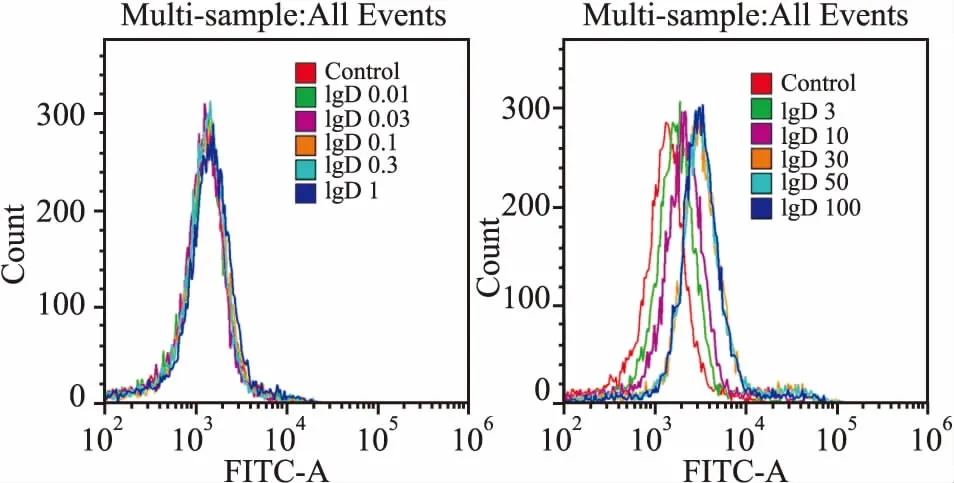
图7 Jurkat细胞表面IgDR表达
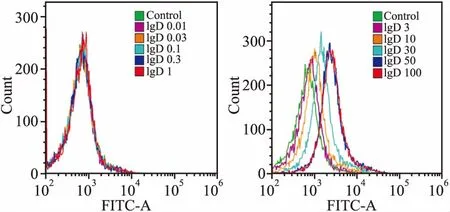
图8 MOLT-4细胞表面IgDR表达
2.4 重组人IgD-Fc片段蛋白、IgD与CD4+T细胞表面IgDR的竞争结合实验不同浓度重组人IgD-Fc片段蛋白与10 μg/ml FITC-IgD共同孵育CD4+T细胞,流式细胞仪检测FITC荧光强度。结果显示随蛋白浓度增加,细胞表面FITC强度逐渐减弱,提示重组人IgD-Fc片段蛋白浓度依赖性地降低了IgD与IgDR的结合。根据FITC荧光强度的变化绘制重组人IgD-Fc片段蛋白针对IgD/IgDR结合的抑制曲线(图10),分别计算IC50值,结果显示,重组人IgD-Fc片段蛋白(IC50=6.927, Log IC50=0.840 5±0.077 89,R2=0.893 4)可竞争性结合IgDR。
3 讨论
人IgD是由两条相同的轻链和重链组成具有Ig超家族特征的可变区(V)和恒定区(C)[5],其Cδ3段由于部分脯氨酸残基缺失以及N端两个糖基化位点而区别于其他Ig,正是这种结构导致IgD的特殊生物学特性[6]。IgD的两个Fab片段主要位于Fc片段两侧,由于半延伸铰链的灵活性,Fab可以围绕Fc片段自由旋转,因此能在较低浓度下促进抗原结合[7]。
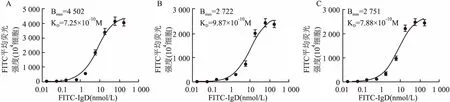
图9 IgD与CD4+ T细胞、Jurkat 细胞、MOLT-4细胞上IgDR结合的饱和曲线
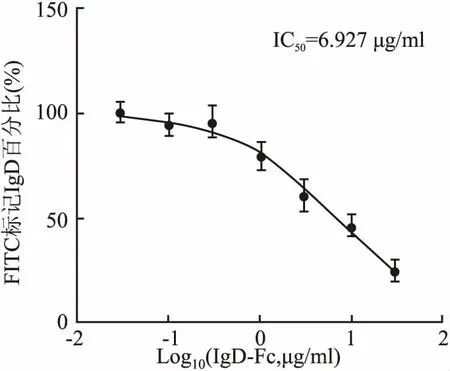
图10 CD4+T细胞上IgDR的竞争结合实验
自身免疫性疾病是由于对自身抗原失去免疫耐受而引发的一种慢性疾病,表现为一种可能涉及宿主体内多个器官的异质性疾病群[8]。遗传易感性和环境诱因使T细胞逃避中枢和外周耐受性,对自身抗原产生自激反应,抵抗自身抗原的T细胞过度增殖而导致器官损伤[9]。临床显示,自身免疫性疾病患者血液中分泌型IgD(sIgD)水平较高,如:RA、SLE等[3]。Nguyen et al[10]研究认为,抗IgD抗体可以调节人固有和适应性细胞因子反应,以抗IgD为靶点可能在自身免疫性疾病治疗中有一定的应用价值。T细胞上IgDR交联可以抑制T细胞凋亡,且IgDR能够促进同源T细胞和初始B细胞间免疫突触的形成,增加抗原呈递和抗体产生。RA是一种炎症自身免疫性疾病,抑制T细胞过度活化被认为是RA的潜在临床治疗方法[11]。研究[3,12]显示,相比健康对照者,IgD水平及IgDR的表达在RA患者中更高,且IgD可诱导RA患者T细胞异常活化。IgD也可促进健康人CD4+T细胞增殖与活化[13]和T淋巴瘤细胞株Jurkat、MOLT-4的异常增殖。以上结果提示在自身免疫性疾病中T细胞处于过度活化状态,异常升高的IgD和IgDR水平可能在T细胞异常增殖与活化过程中扮演重要角色,而IgD-IgDR可能成为IgD水平升高的自身免疫性疾病治疗的新靶点。
课题组在蛋白构建过程中,尝试了三种IgD片段的重组:① 全长IgD,由于全长IgD包含了IgD的功能域与结合域,故表现出与IgD相近的功能,未能起到阻断IgD的促增殖作用;② IgD-Fc片段,去除了IgD的Fab段,仍未起到阻断IgD功能的作用,提示IgD-Fc中包含了IgD的功能域及结合域;③ IgD重链CH2-CH3结构域,成功阻断了IgD的促增殖作用。综上,经蛋白活性筛选,确定了IgD-CH2-CH3重链结构域才是有药理活性的理想IgD片段。本实验以IgD-IgDR为靶点,成功扩增出含人IgD重链CH2-CH3段结构域的基因片段,构建了含有该段基因的克隆及原核表达载体,并进行原核蛋白表达和层析纯化,制备出重组人IgD-Fc片段蛋白。与分离天然来源和化学合成相比,在大肠杆菌中重组表达是一种更经济有效的大规模生产重组蛋白的方法[14]。本实验采用低诱导温度(20 ℃)和低IPTG浓度(0.4 mmol/L),通过减慢蛋白合成速率,增加蛋白正确折叠,为重组蛋白的正确表达提供了更有利的条件。pET 载体系统是一种能高效表达重组蛋白的载体蛋白,具有高度特异性和稳定性,在外源基因的原核表达中具有广泛的应用价值。
本实验检测了CD4+T细胞及T淋巴瘤细胞株Jurkat和MOLT-4表面IgDR的表达情况,进行IgD与CD4+T细胞及T淋巴瘤细胞株Jurkat和MOLT-4表面IgDR的亲和力比较,以及重组人IgD-Fc片段蛋白与CD4+T细胞表面IgDR的竞争结合比较。结果表明,CD4+T细胞及T淋巴瘤细胞株表面均有IgDR表达,CD4+T细胞及T淋巴瘤细胞株表面IgDR与IgD亲和力相近,重组人IgD-Fc片段蛋白可以竞争性结合IgDR,浓度依赖性地降低IgD与IgDR的结合,阻断IgD-IgDR通路,抑制IgD诱导的T细胞过度活化,为进一步研发针对高水平IgD的自身免疫性疾病的新型生物制剂奠定了实验基础。

