SAHA联合厄洛替尼对H1975肺癌裸鼠移植瘤生长的影响及作用机制的研究
袁 卉,郝吉庆
肺癌是最常见的恶性肿瘤之一,其中非小细胞肺癌(non-small cell lung cancer, NSCLC)约占所有肺癌的85%,而大部分肺癌确诊时已属于中晚期,其5年生存率约为18%[1]。而针对驱动基因的个体化分子靶向治疗已成为晚期NSCLC的标准治疗,特别是表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI) 已在临床上被证实具有显著的疗效和良好的安全性。然而因不可避免地会出现耐药[2-3],克服耐药是亟需解决的难题。组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACI)是靶向表观遗传的一类新型抑制剂,可通过阻滞细胞周期、诱导细胞分化和凋亡、抑制肿瘤血管生成和肿瘤侵袭转移等抑制肿瘤生长[4-5]。目前HDACI已在多种恶性肿瘤中应用[6-8]。伏立诺他(suberoylanilide hydroxamic acid, SAHA)已被美国FDA批准用于治疗皮肤T细胞淋巴瘤等肿瘤,厄洛替尼是第一代治疗NSCLC的EGFR-TKI,SAHA与厄洛替尼联合应用在NSCLC中的疗效鲜有报道。H1975细胞含有T790M突变,对厄洛替尼耐药,为寻求逆转耐药的新途径,课题组开展此实验,前期的体外细胞实验[9]表明SAHA与厄洛替尼联用具有协同作用,该实验主要研究SAHA与厄洛替尼联用在动物体内是否具有协同作用并探讨可能的作用机制。
1 材料与方法
1.1 实验动物和细胞株50只雌性Balb/c裸鼠,购自江苏维通利华实验动物有限公司。合格证编号:NO201717625,许可证号:SCXK(苏)2016-0003,6~8周龄,体质量(20±2)g,于中国科学技术大学实验动物中心SPF级环境中饲养。人肺腺癌H1975细胞株购自上海中科院细胞库。所有动物实验符合动物伦理委员会标准。
1.2 实验药品和试剂SAHA购自美国Target Molecule公司,按说明书配制成5 mg/ml的储备液;厄洛替尼购自美国Target Molecule公司,按说明书配制成3 mg/ml的储备液;RPIM 1640培养基、胎牛血清(fetal bovine serum,FBS)购自美国HyClone公司;BCA蛋白定量试剂盒、SDS-PAGE凝胶配制试剂盒购自上海碧云天生物技术有限公司;ECL发光试剂盒购自美国Thermo Scientific公司;TUNEL试剂盒(POD法)购自美国Roche公司;GAPDH、Ki-67、AKT、p-AKT(Ser473)、ERK、p-ERK(Thr202/Tyr204)、mTOR、p-mTOR(Ser2448)均购自美国CST公司;PV-6000通用型试剂盒、山羊抗小鼠IgG二抗、山羊抗兔IgG二抗均购自北京中杉金桥公司。
1.3 实验方法
1.3.1细胞培养 H1975细胞培养于含10% FBS、1%青链霉素的RPIM 1640培养液中,置于37 ℃、5% CO2、饱和湿度培养箱中培养。每1~2 d传代1次,当细胞达到所需数量时,取对数生长期的细胞,用0.25%的胰酶消化后,制成单细胞悬液。用台盼蓝染色法测定细胞活力,调整细胞数至5×107个/ml,待用。
1.3.2动物建模及分组给药 Balb/c裸鼠适应性饲养3 d,自由饮水,常规饮食。每只裸鼠右腋下注射H1975细胞0.1 ml,即5×106个细胞。每周测量肿瘤大小、体质量2~3次,肿瘤体积计算公式:TV=1/2ab2,其中a为长径,b为短径。根据测量的结果计算相对肿瘤体积(relative tumor volume,RTV),RTV=Vt/V0,其中V0为分组给药前(即d0)的肿瘤体积,Vt为每次测量时的肿瘤体积。抗肿瘤活性的评价指标为相对肿瘤增殖率(T/C),即治疗组RTV与对照组RTV比值的百分比(T/C=TRTV/CRTV×100%),T/C>60%为无效,≤60%并经统计学处理P<0.05为有效。待肿瘤体积达到100~300 mm3时,选取肿瘤大小均一性较好的荷瘤裸鼠,采用随机分组法分为4组,每组8只:对照组(PBS)、SAHA组(SAHA 50 mg/kg)、厄洛替尼组(erlotinib 30 mg/kg)、联合组(SAHA 50 mg/kg+erlotinib 30 mg/kg),连续灌胃给药21 d。实验结束后,CO2窒息法处死裸鼠,剥离肿瘤组织并称重,计算抑瘤率(TGI)(%)=(对照组平均瘤重-给药组平均瘤重)/对照组平均瘤重×100%,TGI<40%为无效,≥40%并经统计学处理P<0.05为有效。应用金氏公式计算Q值评估两药联用的效果,Q=1-EA+B/(EA+EB),EA+B表示两药联用时的抑瘤率,EA和EB表示单药时的抑瘤率。Q<0.85表示两药有拮抗作用,0.85≤Q≤1.15表示两药有相加作用,Q>1.15表示两药有协同作用。剥离的肿瘤组织部分固定于10%的中性福尔马林中,部分冻存于液氮中,待做后续检测。
1.3.3Western blot 取冻存于液氮中的肿瘤组织,预冷PBS洗2次,液氮中充分研磨后加入含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液(RIPA ∶蛋白酶抑制剂:磷酸酶抑制剂=100 ∶1 ∶1),冰上裂解30 min后于4 ℃、12 000 r/min离心15 min,取上清液,用BCA法测定蛋白浓度,调整蛋白样品浓度,将蛋白样品置于沸水浴中加热15 min。每孔加30 μg蛋白进行SDS-PAGE电泳,湿转法转移至PVDF膜上,用5%的脱脂牛奶或5% BSA室温封闭2 h,一抗4 ℃孵育过夜,二抗室温孵育2 h,TBST洗膜后用ECL化学发光试剂盒显影。以GAPDH蛋白为内参照,应用Image J软件分析目标条带灰度值。
1.3.4HE染色 取经福尔马林固定的肿瘤组织,经脱水、包埋、切片,60 ℃温箱烤片2 h,经脱蜡水化处理后,苏木精染色8 min,再冲洗、分化、返蓝,伊红染色数秒后,梯度酒精脱水,二甲苯透明,中性树胶封片,显微镜下观察肿瘤组织大体形态结构改变。
1.3.5免疫组织化学(immunohistochemistry, IHC)染色 取经福尔马林固定的肿瘤组织,脱水、常规石蜡包埋、连续切片、烤片,之后脱蜡、水化,微波抗原修复,3%的H2O2消除内源性过氧化物酶活性,一抗4 ℃孵育过夜,用已知阳性切片作阳性对照,PBS代替一抗作阴性对照,二抗37 ℃孵育30 min后DAB染色、苏木精复染,冲洗、分化、返蓝,梯度酒精脱水、透明、封片,显微镜下观察结果。以细胞质染成棕黄色或棕褐色为阳性反应,每张片子选取5个随机视野(×20),用Image J软件分析阳性细胞率。
1.3.6IHC和TUNEL法检测肿瘤细胞增殖率及凋亡率 用免疫组化法检测Ki-67的表达情况;TUNEL的检测按照试剂盒说明书具体操作步骤进行。以细胞核染成棕黄色或棕褐色为阳性反应,每张片子选取5个随机视野(×20),用Image J软件分析增殖率/凋亡率。
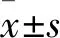
2 结果
2.1 SAHA联合厄洛替尼对H1975裸鼠移植瘤大小、瘤重及体质量的影响联合组与对照组、SAHA组及厄洛替尼组比较,肿瘤大小及瘤重差异有统计学意义(F=7.58、8.59,P<0.05),而SAHA组、厄洛替尼组与对照组比较,差异无统计学意义(P>0.05)。T/C≤60%且TGI≥40%(P<0.05),提示SAHA和厄洛替尼联用对H1975肺癌移植瘤有抑制作用。两药联用Q值为1.86,提示SAHA和厄洛替尼联用有协同作用。见图1、表1。

图1 各组裸鼠第21天肿瘤大小
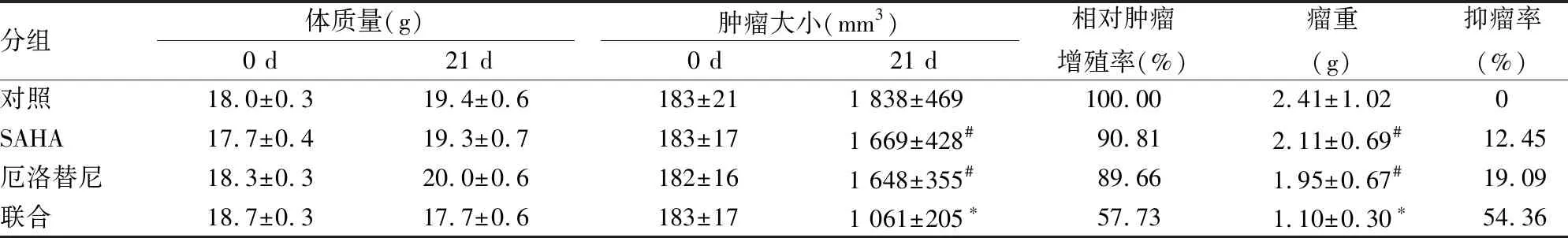
分组体质量(g)0 d21 d肿瘤大小(mm3)0 d21 d相对肿瘤增殖率(%)瘤重(g)抑瘤率(%)对照18.0±0.319.4±0.6183±21 1 838±469100.00 2.41±1.020SAHA17.7±0.419.3±0.7183±17 1 669±428#90.81 2.11±0.69#12.45厄洛替尼18.3±0.320.0±0.6182±16 1 648±355#89.66 1.95±0.67#19.09联合18.7±0.317.7±0.6183±17 1 061±205∗57.73 1.10±0.30∗54.36
与对照组比较:*P<0.05;与联合组比较:#P<0.05
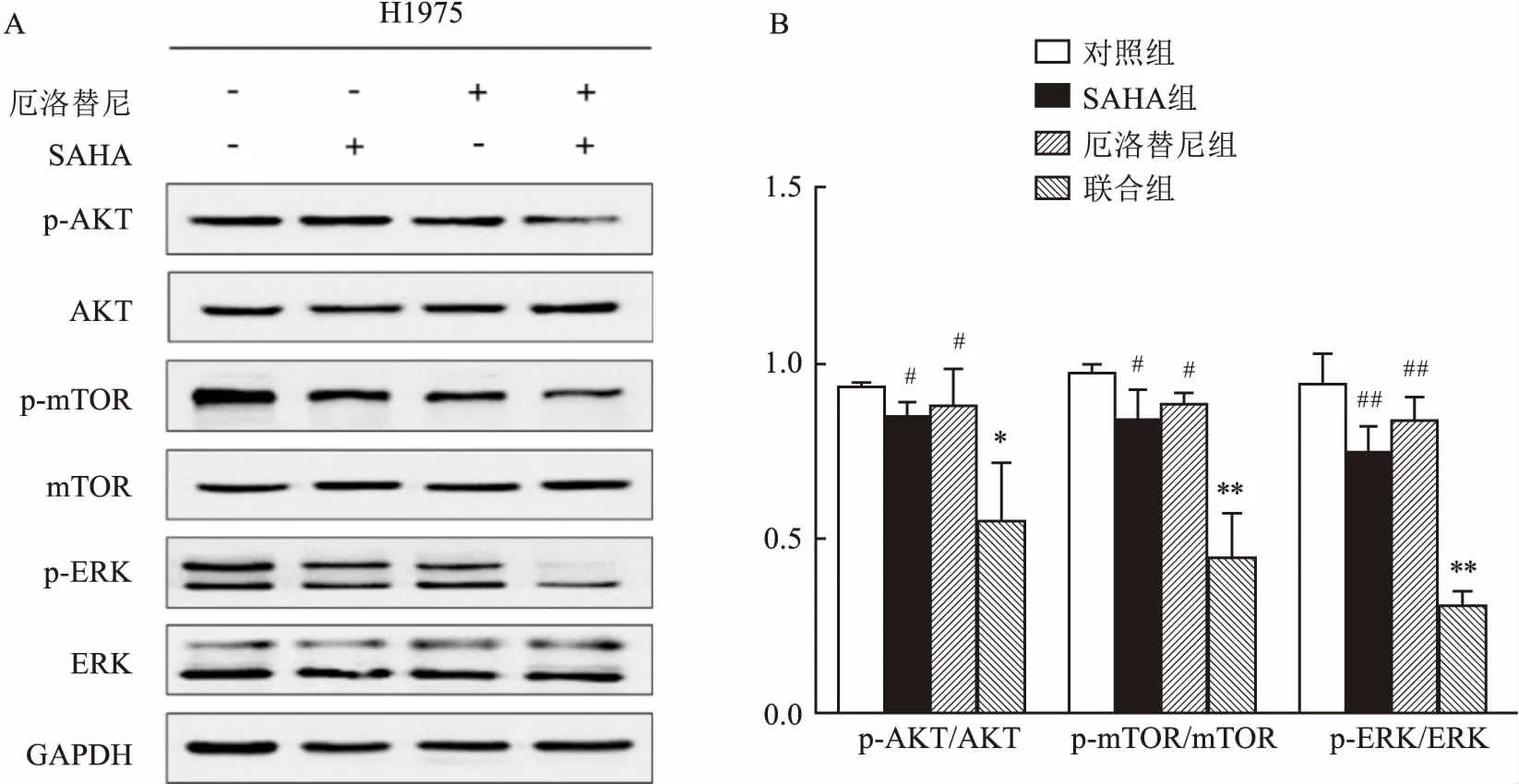
图2 Western blot检测各组肿瘤组织中PI3K/AKT/mTOR、MAPK/ERK信号通路相关蛋白的表达及相对表达量分析
A:Western blot检测各组肿瘤组织中PI3K/AKT/mTOR、MAPK/ERK信号通路相关蛋白的表达;B:Western blot检测各组肿瘤组织中p-AKT/AKT、p-mTOR/mTOR、p-ERK/ERK的相对表达量;与对照组比较:*P<0.05,**P<0.001;与联合组比较:#P<0.05,##P<0.001
2.2 Western blot检测各组移植瘤肿瘤组织中PI3K/AKT/mTOR和MAPK/ERK信号通路相关蛋白的表达Western blot结果表明,SAHA联合厄洛替尼在不影响AKT、mTOR、ERK总蛋白表达的情况下,可显著下调p-AKT、p-mTOR、p-ERK的表达,与单药组及对照组比较差异有统计学意义(F=8.64、25.19、46.12,P<0.05),提示SAHA联合厄洛替尼可抑制PI3K/AKT/mTOR和MAPK/ERK两条信号通路中相关蛋白的活化。见图2。
2.3 IHC检测各组移植瘤肿瘤组织中p-AKT、p-mTOR和p-ERK的表达免疫组化结果表明,与对照组比较,单用SAHA或厄洛替尼对H1975肿瘤组织中p-AKT、p-mTOR、p-ERK的表达无明显影响(P>0.05),而SAHA联合厄洛替尼却能显著抑制肿瘤组织中p-AKT、p-mTOR、p-ERK的表达(F=5.28、9.67、10.44,P<0.05),且联合组的抑制作用明显优于单药组。见图3。
2.4 SAHA联合厄洛替尼对H1975裸鼠移植瘤肿瘤细胞增殖及凋亡的影响HE染色结果显示,对照组肿瘤组织以轻中度坏死为主,SAHA组和厄洛替尼组以中重度坏死为主,而联合组以重度坏死为主,可见细胞呈不同程度皱缩、胞质致密、核染色质边集,细胞核固缩、变性及裂解。各组移植瘤肿瘤细胞增殖率分别为:对照组(29.12±7.24)%,SAHA组(26.36±7.27)%,厄洛替尼组(27.15±3.40)%,联合组(17.98±5.03)%;各组移植瘤肿瘤细胞凋亡率分别为:对照组(2.35±1.25)%,SAHA组(6.39±1.79)%,厄洛替尼组(6.44±5.07)% ,联合组(12.15±5.43)%。联合组与对照组、SAHA组及厄洛替尼组相比,增殖率及凋亡率的差异有统计学意义(F=5.44、8.67,P<0.05)。见图4。
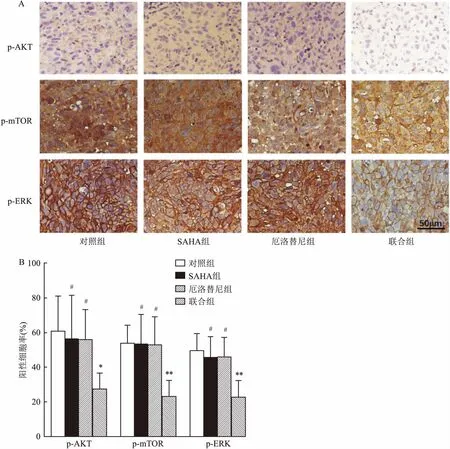
图3 IHC检测各组肿瘤组织中p-AKT、p-mTOR和p-ERK的表达及半定量分析×20
A:IHC检测各组肿瘤组织中p-AKT、p-mTOR和p-ERK的表达; B:各组裸鼠肿瘤组织中p-AKT、p-mTOR、p-ERK阳性表达率;与对照组比较:*P<0.05,**P<0.001;与联合组比较:#P<0.05
3 讨论
近年来肺癌的发生率和死亡率呈持续上升的趋势,已跃居恶性肿瘤之首。肿瘤治疗的三大传统手段(手术、化疗、放疗)对于晚期肺癌疗效甚微,分子靶向药物EGFR-TKI的出现对NSCLC的治疗具有里程碑的意义,然而无论近期疗效如何,经TKI治疗后的肺癌患者最终都会不可避免地出现耐药而导致治疗失败或疾病进展。研究[10]表明获得性耐药中EGFR-T790M二次突变约占50%,c-Met基因扩增约占15%~20%,其他不明原因约占30%。H1975细胞株的EGFR含有L858R和T790M双突变,L858R是EGFR第21号外显子发生了点突变,使858位密码子的亮氨酸置换为精氨酸,是TKI治疗的敏感突变;T790M是EGFR第20号外显子发生了错义突变,使790位密码子的苏氨酸置换为甲硫氨酸,其中T790M突变是国际公认的一代EGFR-TKI获得性耐药机制。T790M突变导致侧链空间结构增大,出现位阻效应,这种位阻效应阻碍了EGFR-TKI与EGFR的结合,同时导致EGFR与ATP亲和力增加,引起下游信号通路的持续活化,从而导致耐药的产生[11]。
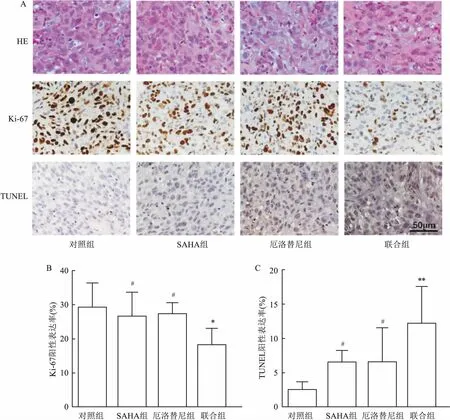
图4 各组裸鼠肿瘤组织大体形态结构变化及对增殖率和凋亡率的影响 ×20
A:各组裸鼠肿瘤组织大体形态结构变化及增殖和凋亡情况; B:各组裸鼠肿瘤组织Ki-67阳性表达率;C:各组裸鼠肿瘤组织TUNEL阳性表达率;与对照组比较:*P<0.05,**P<0.001;与联合组比较:#P<0.05
厄洛替尼通过竞争性地结合胞内EGFR-TK催化区域的Mg-ATP结合位点,抑制激酶的自身磷酸化,阻断EGFR下游信号通路转导,促进肿瘤细胞凋亡,抑制肿瘤细胞增殖,从而发挥抗肿瘤作用; HDACI是一类新型的抗肿瘤药物,具有高效低毒的特点,其中SAHA是最具代表性的HDACI之一,体内外实验[12]表明SAHA对EGFR突变的NSCLC细胞有抑制作用。本实验建立了H1975肺癌裸鼠移植瘤模型,根据临床前抗肿瘤药效方法评价SAHA与厄洛替尼联用的抗肿瘤药效活性,结果表明SAHA联合厄洛替尼可协同抑制H1975肺癌裸鼠移植瘤的生长,降低肿瘤大小和瘤重。免疫组化和TUNEL结果表明SAHA联合厄洛替尼可协同抑制肿瘤细胞增殖,促进肿瘤细胞凋亡。Western blot和免疫组化结果表明SAHA联合厄洛替尼可显著下调p-AKT、p-mTOR、p-ERK的表达,提示两药联用能同时抑制PI3K/AKT/mTOR、MAPK/ERK两条信号通路中相关磷酸化蛋白的表达。
临床上患者对EGFR-TKI耐药的主要原因是EFRG下游信号通路磷酸化蛋白的持续活化[13]。EGFR的下游信号通路主要有两条:PI3K/AKT/mTOR和MAPK/ERK,这两条信号通路也是目前研究最为深入的。PI3K/AKT/mTOR、MAPK/ERK两条信号通路能调节细胞的增殖、凋亡、分化、新陈代谢等过程,是细胞的关键生存信号通路, 与肿瘤的发生发展及化疗耐药性等相关。研究[14]表明,这两条信号通路是相互作用的,抑制这两条信号通路中的一条会导致另一条信号通路的级联激活,而同时抑制两条信号通路却能更有效地起到抗肿瘤作用。本实验结果同样也证实了这一点,SAHA联合厄洛替尼能同时抑制这两条信号通路中相关蛋白的活化,抑制下游信号通路的转导而逆转EGFR-TKI耐药。
综上所述,SAHA联合厄洛替尼可显著抑制H1975肺癌裸鼠移植瘤的生长,作用机制可能与同时抑制PI3K/AKT/mTOR、MAPK/ERK两条信号通路中相关蛋白的活化有关。SAHA联合厄洛替尼能部分逆转EGFR-TKI耐药,显著增强在H1975裸鼠移植瘤中的疗效,可能作为靶向增敏剂。本实验在体外细胞实验的基础上,在动物体内研究了SAHA联合厄洛替尼的协同抑瘤作用及可能的作用机制,为临床应用提供了一定的理论依据。

