全反式维甲酸对角膜上皮损伤修复过程中细胞凋亡的影响
王多梅,宋 梦,汪 枫,2,周 青,汪 渊
角膜是眼球最外层的纤维膜,同时也是重要的屈光间质。其中角膜上皮是抵御病原微生物侵袭角膜的第一道屏障,角膜最外层的上皮细胞间形成的高密度紧密连接构成了屏障,将外界与眼内隔离,抵御外界致病因子的侵袭[1]。上皮遭受损伤后,极易发生感染性炎症。
全反式维甲酸(all-transretinoic acid,ATRA)是天然维生素A的代谢产物。研究[2]表明,ATRA可改善血管内皮依耐性舒张功能。维甲酸类化合物对多种细胞癌变和肿瘤的生长均有抑制作用,同时可以增强上皮细胞的生长和分化[3],并且近几年已被用于眼科相关疾病[4-5]。该研究通过ATRA处理损伤后大鼠角膜上皮,旨在探讨ATRA对角膜上皮损伤修复过程中角膜上皮修复速度的影响及该过程中丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)信号通路相关分子的变化及凋亡相关蛋白表达的变化,初步探讨其发生的可能机制,为进一步研究打下良好的基础。
1 材料与方法
1.1 实验动物普通雄性清洁级SD大鼠20只,体质量250~300 g,购自安徽医科大学实验动物中心。实验动物均给予12 h光照、12 h黑暗条件,环境通风,饮水自由。
1.2 主要试剂二甲基亚砜(DMSO)购自美国 Sigma公司;TUNEL(C1090)细胞凋亡试剂盒购自上海碧云天生物技术公司;一抗β肌动蛋白(β-actin)、半胱天冬氨酸蛋白酶-9(cysteine aspartic acid specific protease-9,Caspases-9)、磷酸化p38蛋白(p-p38)、p38购自美国Santa Cruz公司 ;B细胞淋巴瘤/白血病-2相关X蛋白(B cell lymphoma/lewkmia-2 assaciated X protein,Bax)、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)、辣根过氧化物酶标记羊抗鼠、羊抗兔、兔抗羊IgG购自美国Millipore 公司;Caspases-3购自美国Abcam 公司; ECL显色试剂盒购自杭州弗德生物科技有限公司;羧甲基纤维素钠(sodium carmellose ,SC)购自美国 Sigma公司;ATRA购自上海东苍生物科技有限公司(≥98% 302-79-4)。
1.3 仪器冰冻切片机、正置显微镜、解剖显微镜购自德国 Leica公司;电泳仪购自美国Pca 300公司;全自动数码凝胶化学发生仪购自上海欧翔科学仪器有限公司;裂隙灯显微镜(YZ5T)购自苏州六六视觉科技股份有限公司;脱色摇床(TS-1)购自海门其林贝尔仪器制造有限公司;往复式脱色摇床(ZD-9550)购自太仓华利达实验设备有限公司;高速冷冻离心机购自美国Thermo fisher公司。
1.4 大鼠角膜损伤修复模型的建立及角膜组织收取所有大鼠称重后10%水合氯醛(0.3 ml/100 g)麻醉, 角膜环锯器在大鼠角膜上皮做直径4 mm环形标记,解剖显微镜下用无菌的手术刀片刮除并收集环形标记内角膜上皮。术后损伤眼均涂抹红霉素眼膏以防感染。损伤修复期间每只老鼠一只眼滴加0.5 mmol/L ATRA滴眼液(溶于2% SC),另一只眼滴加对照溶液(2% SC),每天4次,每次每只眼10 μl。角膜损伤0、12、24、36 h分别滴加荧光染液并拍照记录两只眼角膜损伤修复情况。待最后一次拍照结束后,处死动物。收取一部分大鼠两只眼角膜最佳切削温度化合物(optimal cutting temperature compound,OCT)包埋剂包埋,冻存于-80 ℃用于切片原位末端凋亡法(TdT-mediated dUTP nick-end labeling,TUNEL)实验分析,一部分大鼠角膜上皮刮取之后直接-80 ℃冻存用于Western blot实验。
1.5 大鼠角膜上皮TUNEL细胞凋亡分析-80 ℃保存的大鼠OCT角膜标本于冰冻切片机切出厚度5 μm组织切片。室温干燥后用预冷的冰丙酮固定10~20 min; PBS洗涤2次,每次5 min,加入含0.1% TRIton X-100的PBS,冰浴孵育2 min;PBS洗涤3次,每次5 min;在样品上加45 μl TUNEL检测液,37 ℃避光孵育60 min;PBS洗涤3次,每次5 min;用抗荧光淬灭封片液封片后荧光显微镜下观察并采集图片。
1.6 大鼠角膜组织蛋白印记实验分析凋亡蛋白表达-80 ℃保存的大鼠角膜上皮组织4 ℃、14 000 r/min离心15 min;加入蛋白裂解液冰上裂解30 min;4 ℃、14 000 r/min离心15 min取上清液,加入一定比例蛋白上样缓冲液,沸水煮10 min。配制十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶,蛋白样本于凝胶中运动,根据分子量大小不同,不同分子量蛋白跑至不同位置;后转移至聚偏二氟乙烯膜(PVDF膜)上;5%脱脂奶粉室温封闭2 h;含0.05%吐温20的三乙醇胺缓冲盐水溶液(tris buffered saline+0.05% Tween20,TBST)洗涤1次,三乙醇胺缓冲盐水溶液(tris buffered saline ,TBS)洗1次,每次10 min;4 ℃一抗过夜;TBST洗涤3次,每次10 min;室温孵育对应HRP标记二抗2 h,TBST洗涤3次,TBS洗1次;避光加发光剂后曝光并采集图片。
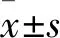
2 结果
2.1 ATRA促进大鼠角膜上皮损伤修复损伤后0、12、24、36 h分别拍照记录大鼠角膜损伤修复情况。 通过大鼠角膜上皮损伤修复体内实验模型,滴加含0.5 mmol/L ATRA滴眼液眼角膜损伤修复恢复率12、24、36 h分别为17.85%、53.25%、77.80%,对照(control,CT)组12、24、36 h恢复率分别为15.47%、45.59%、65.07%。见图1。初步说明ATRA可促进大鼠角膜上皮损伤修复的进行。
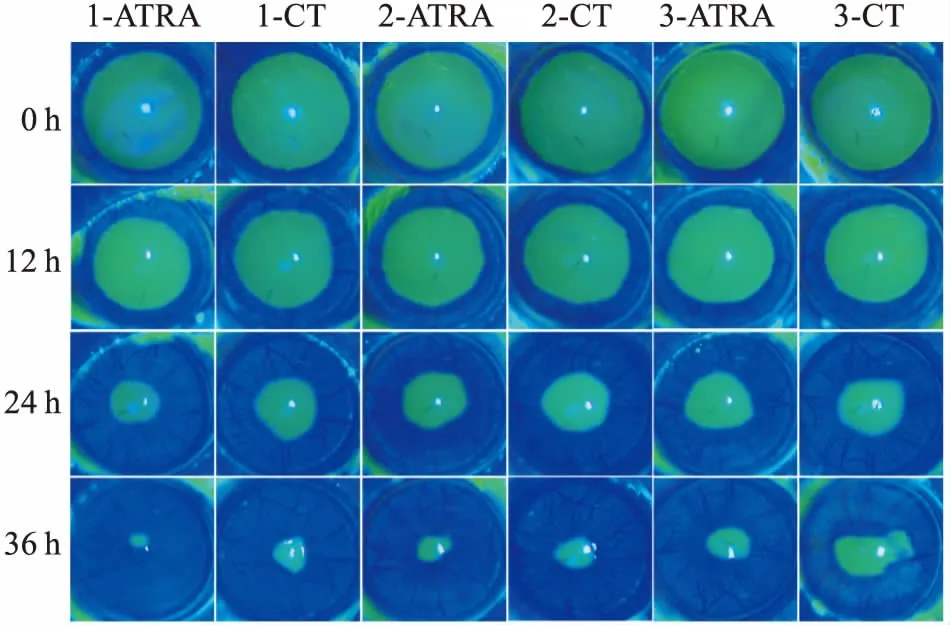
图1 ATRA对大鼠角膜上皮损伤修复的影响1、2、3:大鼠编号
2.2 ATRA可抑制角膜上皮损伤修复过程中细胞凋亡的发生大鼠角膜组织TUNEL结果显示,ATRA处理后角膜上皮细胞凋亡明显少于CT组和空白组(角膜损伤0 h未处理直接取材角膜)。见图2。
2.3 ATRA对角膜上皮组织细胞凋亡相关蛋白影响Western blot实验结果显示:与CT组比较,损伤修复之后,ATRA处理角膜上皮组织中促凋亡蛋白Bax表达量明显下降(F=2.589E3,P<0.05),抗凋亡蛋白Bcl-2表达量明显上调(F=4.808E3,P<0.05),Bcl-2/Bax比值ATRA处理后明显增多(F=1.563E4,P<0.05)。见图3。由此说明ATRA能抑制角膜上皮细胞凋亡的发生,从而对大鼠角膜损伤修复进程起促进作用。 同时Caspases家族蛋白表达结果显示:ATRA处理后角膜上皮组织Caspases-9(F=2.334E3,P<0.05),Caspases-3(F=1.536E3,P<0.05)表达明显降低,而其前体蛋白Procaspases-9(F=1.495E3,P<0.05), Procaspases-3(F=415.542,P<0.05)表达均高于CT组。 见图4。
2.4 ATRA对角膜上皮组织MAPK通路相关蛋白影响ATRA处理后Western blot检测MAPK通路蛋白结果显示:p38磷酸化水平ATRA处理组均下调(F=1.350E3,P<0.05),见图5。说明ATRA可能通过对MAPK通路蛋白活性的调节,从而对角膜上皮组织细胞凋亡起调控作用。
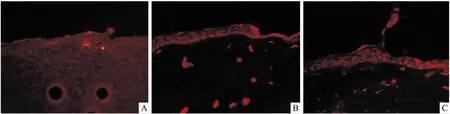
图2 ATRA对角膜上皮组织凋亡影响 TUNEL染色×100
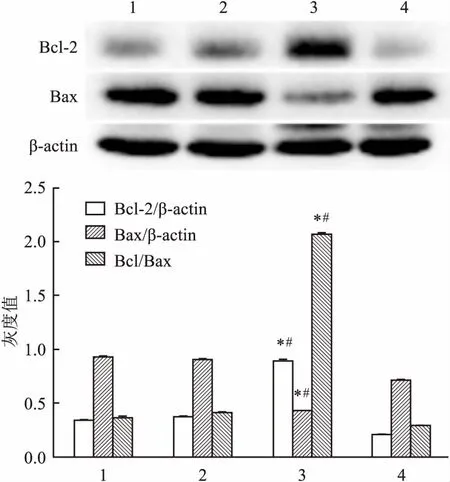
图3 ATRA对角膜上皮组织凋亡相关蛋白Bax、Bcl-2表达的影响
1:未损伤ATRA处理角膜上皮;2:未损伤 CT角膜上皮;3:角膜损伤36 h ATRA处理角膜上皮;4:角膜损伤36 h CT角膜上皮;与未损伤组1比较:*P<0.05;与CT组4比较:#P<0.05
3 讨论
角膜损伤修复是一个复杂的过程,该过程与多种因素密切相关。研究表明,晚期糖基化终末产物通过活性氧的形成从而延缓角膜损伤修复的速度[6],吸烟会延缓人角膜上皮损伤修复的速度[7],血钙浓度过高,会延缓去卵巢大鼠角膜损伤修复的速度[8]。角膜伤口愈合是在多种眼部手术及眼部损伤例如眼部化学灼伤引起的眼外伤后获得视力最佳恢复的必要临床步骤。角膜上皮作为抵御外界病原体入侵的第一道屏障,角膜损伤可导致视力减退,严重者可使角膜脱落、穿孔,导致失明。加快角膜损伤修复可以尽可能降低这些威胁的发生。因此,对有效促进角膜上皮损伤修复的药物机制的研究可以为临床治疗提供理论依据和研究方法。
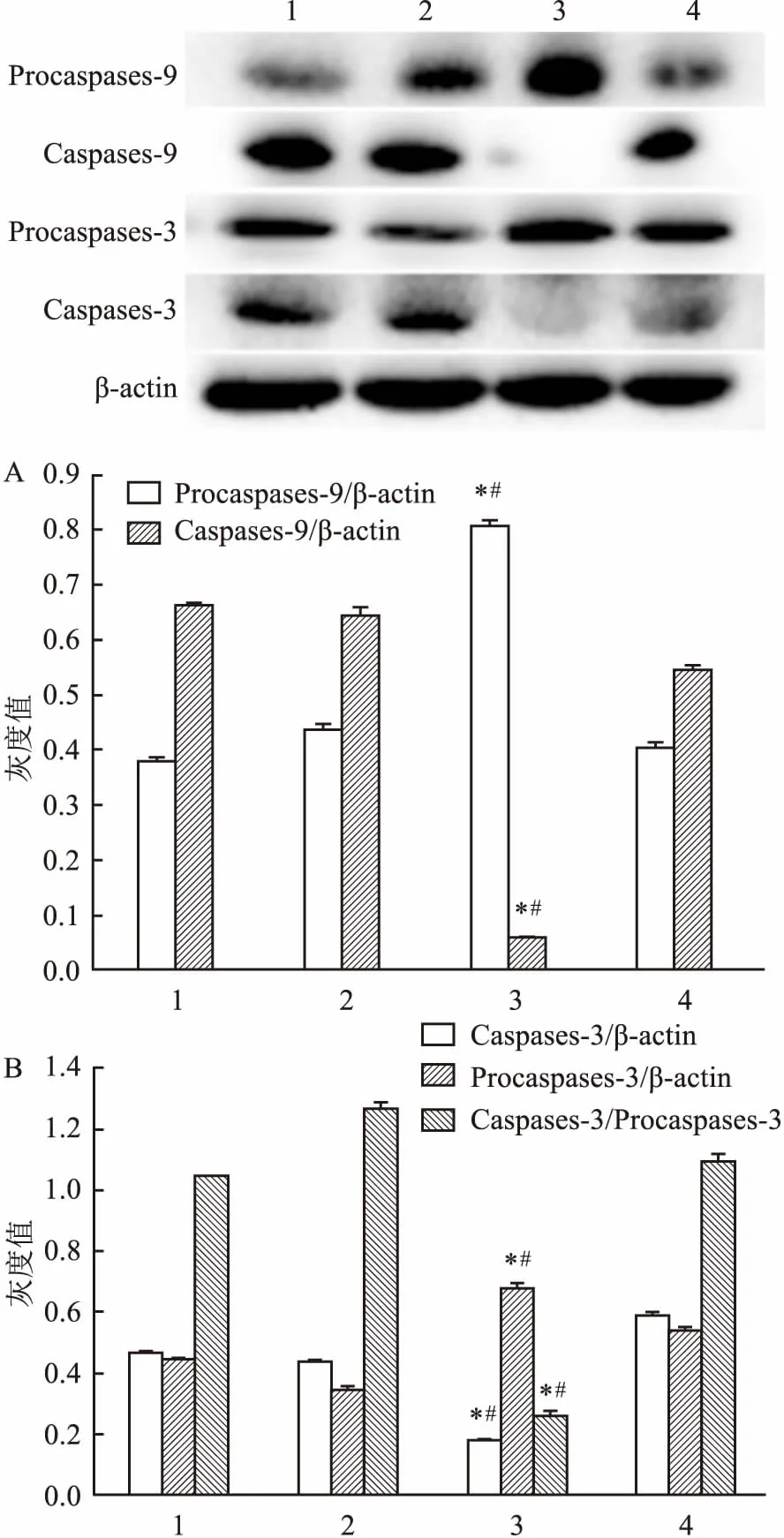
图4 ATRA对角膜上皮组织凋亡蛋白Caspase相关蛋白表达的影响
A:Caspase-9、Procaspase-9表达条带灰度值分析;B:Caspase-3、Procaspase-3表达条带灰度值分析;1:未损伤 ATRA角膜上皮;2:未损伤 CT角膜上皮;3:角膜损伤36 h ATRA角膜上皮;4:角膜损伤36 h CT角膜上皮;与未损伤组1比较:*P<0.05;与CT组4比较:#P<0.05
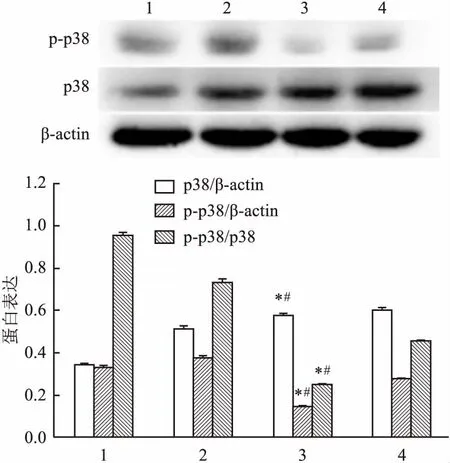
图5 ATRA对角膜上皮组织MAPK通路蛋白表达的影响
1:未损伤 ATRA角膜上皮;2:未损伤 CT角膜上皮;3:角膜损伤36 hATRA角膜上皮;4:角膜损伤36 h CT角膜上皮;与未损伤组1比较:*P<0.05;与CT组4比较:#P<0.05
已知ATRA可以改善皮肤伤口的愈合[9]。研究[10-11]表明ATRA在眼形态发生和维持角膜完整性方面起着至关重要的作用,是角膜上皮细胞增殖和分化所必需的。大量研究[12]表明ATRA可促进角膜上皮愈合,这为ATRA用于眼科临床试验提供了很好的依据,但是ATRA促进角膜损伤修复的机制目前仍未见相关报导。本实验结果显示,含0.5 mmol/L ATRA的滴眼液处理损伤后大鼠角膜,能有效促进角膜愈合,且初步证明该过程可能与ATRA对角膜上皮损伤修复过程中细胞凋亡的调控相关,且可能与MAPK通路相关蛋白磷酸化水平的改变相关。
细胞凋亡是指由基因控制的细胞为更好地适应生存环境而主动争取的一种死亡过程,即细胞的程序性死亡。该过程是多基因严格控制,这些基因包括Caspase家族、Bcl-2家族、癌基因、抑癌基因等,且彼此种属之间非常保守。角膜组织切片TUNEL实验提示,0.5 mmol/L ATRA处理后角膜上皮中凋亡细胞比例明显减少。Western blot结果显示,在角膜上皮组织中,ATRA处理后可有效抑制促凋亡蛋白Bax表达,同时上调抗凋亡蛋白Bcl-2,Bcl-2/Bax比值显著增高。研究[13]表明Caspases尤其是Caspases-3 受Bcl-2/Bax调控,并在凋亡的执行中起关键作用。凋亡发生时,受凋亡信号刺激后,效应Caspases对凋亡程序的进行至关重要,然而该过程的活化需要起始Caspases对其前体进行切割。其中Caspases-3作为效应Caspases其活化需要上游Caspase-8、Caspases-9激活[14]。本实验Western blot结果显示ATRA作用下前体蛋白Procaspases-9、Procaspases-3降解明显减少,从而抑制组织中Caspases-9表达,进一步抑制Caspases-3表达,最终抑制细胞凋亡的发生。
MAPKs信号途径普遍存在于多种生物细胞中,参与调控细胞生长、发育、分化、凋亡等多种生理过程。主要包括p38MAPK、c-jun N末端激酶/应激活化蛋白激酶、细胞外信号调节激酶3种通路。其中p38MAPK通路参与多种细胞凋亡的调控。研究[15]显示,ATRA可通过抑制p38磷酸化水平导致MAPK通路的下调,从而减少心肌细胞凋亡,有效预防心肌损伤。本实验研究结果显示,通过ATRA处理后,上皮组织中p38的磷酸化水平降低。提示ATRA对角膜上皮组织细胞凋亡的抑制作用可能与p38磷酸化水平的降低有关。
综上所述,在大鼠角膜上皮损伤修复过程中,ATRA对上皮愈合的促进作用与ATRA对凋亡发生的抑制密切相关,且该作用可能与MAPK通路调控相关,通过对凋亡相关蛋白Bax、Bcl-2及Caspases-3的调控,从而抑制角膜上皮组织凋亡的发生,为深入研究角膜损伤修复的机制打下良好基础,同时也为探讨角膜病变的发病机制奠定基础。

