环氧合酶-2 对酸和胆盐诱导的人鳞状细胞凋亡的影响及机制
申建刚 王红芳 陈丽 李俊达 李勇年
深圳市龙华区人民医院消化内科(广东深圳518109)
Barrett 食管(Barrett′s esophagus,BE)是指正常的复层鳞状上皮被单层柱状上皮所取代的一种病理现象,其发生主要与胃食管反流病(gastroesophageal reflux disease,GERD)、遗传、肥胖、生活方式、性别、种族等相关,其中GERD 最重要[1]。BE 伴肠上皮化生者属于食管腺癌(esophageal adenocarcinoma,EAC)的癌前病变[2]。阻止BE 发生、发展是避免EAC 的一个重要途径。目前BE 发病机制尚不清楚。研究[3-4]发现,在人BE 组织中环氧合酶-2(cyclooxygenase-2,COX-2)表达较周围鳞状上皮组织显著增高,所以推测COX-2 在BE 发病中起重要作用。
本研究通过体外培养人食管鳞状细胞,利用基因转染技术,在细胞内沉默COX-2 表达,探讨COX-2 对酸和胆盐诱导的人鳞状细胞凋亡的影响及可能机制。
1 材料与方法
1.1 试剂 COX-2、尾型同源盒转录因子-2(caudal-related homeoboxgene-2,CDX-2)、磷酸化核转录因子-κB(phosphorylation of nuclear factor-κB,NF-κB/p-P65)及GAPDH 鼠抗人单克隆抗体、荧光标记的羊抗鼠二抗均购自美国Epitomics 公司;MTT、二甲基亚砜(DMSO)购自美国Sigma 公司;RNA 提取Trizol试剂盒、脂质体Lipofectamine2000、RPMI1640、胎牛血清购自美国Invitrogen 公司。将胆盐成分[5](sigma 公司)牛磺胆酸、甘氨胆酸、甘氨鹅脱氧胆酸、牛磺鹅脱、氧胆酸、甘氨脱氧胆酸和牛磺脱氧胆酸按20∶15∶3∶6∶1 的比例混合加入培养基。
1.2 细胞培养 人食管鳞状细胞株HET-1A 购自美国标准菌库(ATCC,Manassas,VA,USA)。细胞用含有10%胎牛血清和RPMI 1640 培养基,于37 ℃、5%CO2环境中培养。
1.3 siRNA 的构建及转染 抗人COX-2 siRNA 购自上海吉玛制药技术有限公司,COX-2 siRNA 序列正义:5′-AACUGCUCAACACCGGAAUtt-3′;反义:5′-AUUCCGGUGUUGAGGAGUUtt-3′。阴性对照siRNA 序列正义:5′-UUCUCCGAACGUGUCACG Utt-3′;反义:5′-ACGUGACACGUUCGGAGAAtt-3′。待Het-1A 细胞生长到占培养瓶底90%时消化,离心,重悬后转入24孔板中。当细胞生长到约60%~70%的融合面积时进行转染。实验分为4 组:空白对照组(只接种HET-1A 细胞未作任何处理)、阴性对照组(用阴性siRNA 转染HET-1A 细胞)、COX-2 组(用COX-2 转染HET-1A 细胞)及COX-2 siRNA 组(用COX-2 siRNA 转染HET-1A 细胞)。通过Western blot检测COX-2表达判断转染效果。
1.4 流式细胞术检测细胞凋亡 收集细胞,加入100 μL buffer,混匀,用10 μL FIYC 和5 μL PI 进行染色,4 ℃避光作用30 min 后,再加入300 μL buffer,混匀,将细胞置激发光为488 nm 波长的FACS Calibur 型流式细胞仪检测。用ModFit LT 软件分析结果。
1.5 Western blot 检测蛋白表达 将待测细胞接种于6 孔板中,培养48 h 后收集细胞并用冰PBS 液洗涤3 次。用含1% Triton X-100 的细胞裂解液裂解细胞。收取总蛋白,按常规方法进行SDS-PAGE凝胶电泳、转膜。一抗为鼠抗人COX-2、CDX-2、p-P65 单克隆抗体及鼠抗人GAPDH 单克隆抗体,二抗为荧光标记的羊抗鼠抗体,进行抗原抗体反应,然后进行荧光显色并测定反应条带灰度值,以GAPDH 作为内参,计算相对值,重复3 次。
1.6 统计学方法 采用SPSS 19.0 统计软件进行统计分析,数据用均数±标准差表示,所用方法为析因方差分析、单因素方差分析,组间多重比较用LSD 法。
2 结果
2.1 siRNA 转染效果 利用基因转染技术,使COX-2 在HET-1A 细胞内过表达及基因沉默,48 h后收集细胞,用Western blot 检测COX-2 表达,可见COX-2 转染成功(图1)。

图1 COX-2 在HET-1A 细胞内过表达及基因沉默后的表达Fig1 Expression of COX-2 in HET-1A cells after overexpression and gene silencing
2.2 酸、胆盐和二者混合物诱导HET-1A 细胞凋亡 根据预实验结果,盐酸调整培养基PH 值,最终选取pH 值为6.0,作用时间30 min 干预细胞;胆盐浓度选取1 200 μmol/L,作用时间30 min。根据酸和胆盐浓度不同,实验分4组:(0 μmol/L,pH 7)、(1 200 μmol/L,pH 7)、(0 μmol/L,pH 6)、(1 200 μmol/L,pH 6),流式检测细胞凋亡(图2)。结果显示,以上4 组凋亡率分别为(2.52±0.45)%、(7.23±0.62)%、(4.49 ± 0.45)%和(28.37 ± 1.57)%,酸、胆盐及二者混合物均诱导细胞凋亡,酸的作用最弱,混合物作用最强[(4.49 ± 0.45)%vs.(28.37 ± 1.57)%,P<0.05)]。
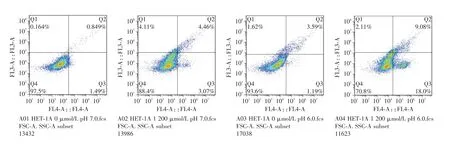
图2 流式细胞术检测酸、胆盐及二者混合物诱导的HET-1A 细胞凋亡Fig2 Apoptosis of HET-1A cells was induced by acid,bile salts and their mixture
2.3 在HET-1A 细胞内酸、胆盐和二者混合物增加了COX-2、p-P65和CDX-2的表达 根据前期结果设置分组为:(0 μmol/L,pH 7)、(1 200 μmol/L,pH 7)、(0 μmol/L,pH 6)、(1 200 μmol/L,pH 6),干预HET-1A 细胞30 min,Western blot 检测COX-2、p-p65及CDX-2的表达水平,见图3,处理组COX-2、p-P65 及CDX2 的表达相比正常组均上调,胆盐和盐酸混合处理组上调最明显。
2.4 基因沉默COX-2 对酸和胆盐混合物诱导的HET-1A 细胞凋亡的影响 根据前期结果设置实验分3 组:(0 μmol/L,pH 7)、(1 200 μmol/L,pH 6)和siCOX-2(1 200 μmol/L,pH 6)。HET-1A 细胞转染COX-2 siRNA,48 h 收样检测前取盐酸pH 6.0 联合1 200 μmol/L 的胆盐处理30 min,流式细胞术检测细胞凋亡(图4),结果显示细胞凋亡率分别为(3.69±0.44)%、(45.27±2.62)%和(53.67±1.26)%,基因沉默COX-2 后细胞凋亡增加(P<0.05)。
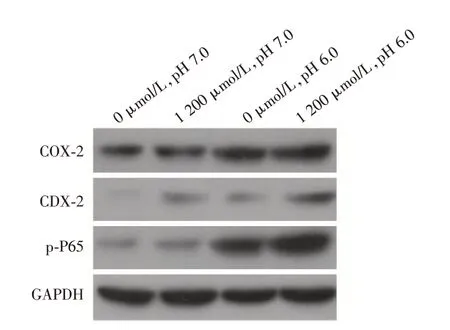
图3 在HET-1A 细胞内酸、胆盐和二者混合物增加了COX-2、p-P65 和CDX-2 的表达Fig.3 The expressions of COX-2,p-P65 and CDX-2 were increased in the presence of acid,bile salts and mixtures in HET-1A cells
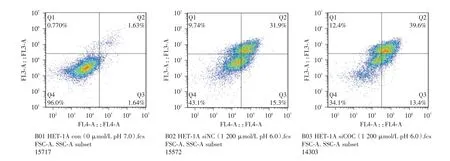
图4 基因沉默COX-2 增加酸和胆盐混合物诱导的HET-1A 细胞凋亡Fig.4 Gene silencing COX-2 increased apoptosis of HET-1A cells after acid and bile salts mixtures induction
2.5 基因沉默COX-2 后酸和胆盐混合物诱导的HET-1A 细胞内COX-2、p-P65 和CDX-2 表达均减弱 细胞转染COX-2 siRNA,48 h 收样检测前取盐酸pH 6.0联合1 200 μmol/L的胆盐处理,HET-1A处理30 min,Western blot 检测COX-2、p-P65 及CDX-2的表达水平,结果显示(图5),酸和胆盐混合物处理细胞后COX-2、p-P65 和CDX-2 蛋白表达均上调,干扰COX-2 后以上蛋白表达均下降。
3 讨论
目前研究认为BE 多由严重而长期的胃和十二指肠内容物反流刺激食管下段所致,主要是酸和胆汁反流[6-7]。BE 来源于食管鳞状细胞还是来源于干细胞有待研究,但多数认为BE 可能由食管鳞状细胞分化而来,BE 具体发生机制尚不明确[8-10]。研究发现[11-12],COX-2 在人BE 组织中表达明显高于周围鳞状细胞及对照组组织,炎症刺激后COX-2 在食管鳞状细胞内表达增强,提示COX-2 可能在BE 发生、发展中起重要作用。
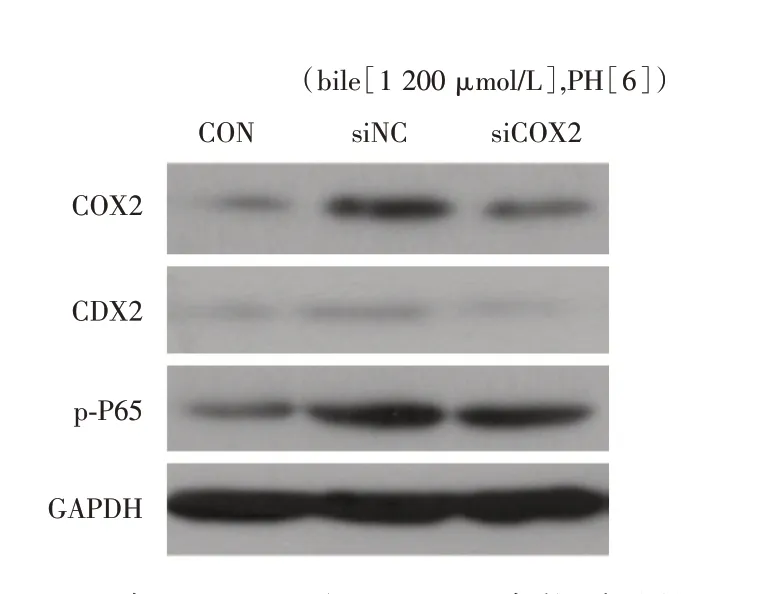
图5 基因沉默COX-2 后酸和胆盐混合物诱导的HET-1A细胞内COX-2、p-P65 和CDX-2 表达均减弱Fig.5 Gene silencing COX-2 decreased the expression of COX-2、p-P65 and CDX-2 in the presence of acid and bile salts mixtures in HET-1A cells
本研究模拟人体酸和胆盐环境,在酸、胆盐及二者混合物作用下培养食管鳞状细胞,探讨COX-2对食管鳞状细胞凋亡的影响。研究发现酸、胆盐及二者混合物均可诱导HET-1A 细胞发生凋亡,其中酸、胆盐二者混合物的作用最强,其作用是单独酸或胆盐的数倍,可能二者联合可以发挥协同作用。酸和胆盐诱导细胞凋亡的同时伴随COX-2 表达增强,基因沉默COX-2 后细胞凋亡增加,提示COX-2 参与调控了酸、胆盐诱导的食管鳞状细胞凋亡,COX-2 可能参与了BE 的发生、发展过程。
NF-κB[13-14]作为炎症反应的重要表达因子,被认为在炎症发展到癌症过程中起重要作用,NF-κB 在多种细胞、组织中参与细胞凋亡过程;研究发现[15]NF-κB 在BE 异型性、食管腺癌组织中表达增高,可能是通过激活生存素作为抗凋亡因子发挥作用。BUS 等[16]证实在食管鳞状细胞中抑制NF-κB可以抑制细胞增殖,伴随COX-2 表达降低。PARK等[17]发现在平滑肌瘤细胞中COX-2 抑制剂塞来昔布可以通过NF-κB 通路抑制细胞增殖。以上提示NF-κB 在BE 发生中起重要作用,NF-κB 与COX-2可互相调节。本研究发现COX-2可诱导HET-1A细胞凋亡,可能是通过NF-κB信号通路实现的。
CDX做为尾型同源核转录因子家族成员之一,是肠道发育过程中特异性表达的核转录因子,调节肠上皮细胞的增殖和分化[18]。CDX-2 在BE 肠化生中起关键作用,其在食管中的表达是肠化生的早期特异性标志[19]。本研究证实在HET-1A 细胞内COX-2 可以调节CDX-2 表达,提示COX-2 可能在食管鳞状细胞肠化过程中起重要的作用。
综上所述,基因沉默COX-2 表达可以促进酸、胆盐诱导的食管鳞状细胞凋亡,其机制可能是COX-2 通过调节p-P65 及CDX-2 表达实现的。提示COX-2 可能参与了BE 的发生、发展过程,需要进一步研究COX-2 在BE 发生、发展中的作用及机制。

