乙肝肝硬化患者中微小RNA-21、Th9 的表达及其对肠道屏障功能调控机制的影响
赵彩红 田志颖 张丽贤 何显 苏新爱 王丽华
衡水哈励逊国际和平医院消化内科(河北衡水053000)
微小RNAs(miRNAs)是一种大小在21~23 个碱基之间的单链小分子RNA,可参与调节、影响细胞增殖、脂肪代谢及细胞分化、细胞凋亡、细胞死亡,与许多疾病的发生与发展有关[1]。miR-21 最初在小鼠体内被检测出,是普遍的肿瘤相关性miRNA。相关研究报道miR-21 在慢性肝炎患者肝组织中下调,而在肝硬化患者肝组织中上调,但是具体的机制还不明确[2-3]。乙肝肝硬化患者常伴有不同程度的炎症反应,炎症因子通过介导肝细胞的损伤参与调节肝硬化的发病[4]。辅助性T 淋巴细胞9(Th9)是新发现的CD4+T 细胞亚群,具有促炎效应,在炎症性疾病中也发挥一定的免疫调节作用[5]。肝硬化发展过程中常伴随着不同程度的肠屏障功能障碍,可诱发与加重肠源性内毒素血症[6-7]。肠道屏障功能状态可以通过肠黏膜的通透性来反映,可通过检测血中二胺氧化酶(diamine oxidase,DAO)、内毒素(endotoxin,ET)、D-乳酸(D-lactic acid,D-lac)含量进行判定[8-9]。本研究具体探讨了乙肝肝硬化患者中miR-21、Th9 的表达及其对肠道屏障功能调控机制的影响,以明确肝硬化与肠道屏障的相关性,现报告如下。
1 对象与方法
1.1 研究对象 研究时间为2014年2月至2018年2月,此次研究获得医院伦理委员会批准,所有入选者知情同意本研究。采用回顾性总结研究方法,选择在哈励逊国际和平医院诊治的乙肝肝硬化患者144 例作为肝硬化组,纳入标准:影像学检查提示肝硬化改变;除外其他原因导致的肝硬化;既往存在乙肝病史或HBsAg 阳性≥6 个月,现HBsAg 和(或)HBV DNA 仍为阳性者。排除标准:合并严重呼吸道、泌尿系及其他部位的感染;乙肝肝硬化同时合并其他类型肝硬化;乙肝病毒以外的其他类型肝炎病毒感染;妊娠或哺乳期妇女;合并肝外胆道梗阻疾病、代谢性疾病、免疫系统疾病等。
同期选择体格检查健康者144 例作为对照组,纳入标准:实验室及影像学检查未发现肝损害表现;无饮酒史;无肝炎病毒感染史,肝炎病毒学结果阴性。排除标准:合并严重呼吸道、泌尿系及其他部位的感染;合并恶性肿瘤、免疫系统及代谢类疾病病史;妊娠或哺乳期妇女;合并心脏、脑、胆、肺、肾等器质性疾病。
肝硬化组中男74 例,女70 例;年龄24~76 岁,平均(48.22±8.29)岁;平均病程为(8.19±0.78)年;平均体质量指数为(23.11±2.48)kg/m2。对照组中男76 例,女68 例;年龄21~79 岁,平均(48.42 ±4.28)岁;平均体质量指数为(23.98 ± 2.11)kg/m2。两组患者上述资料对比差异无统计学意义(P>0.05)。
1.2 常规指标检测 采集所有入选者的空腹静脉血5~10 mL,1 500 r/min 离心5 min,取上清,采用速率法测定血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate transaminase,AST)、总胆红素(total bilirubin,TBIL)含量,检测仪器为美国贝克曼全自动分析仪。
1.3 miR-21、Th9、DAO、ET、D-lac 指标检测 取1.2 部分中的静脉血样本,每200 μL 血液样本中加入等体积裂解液,采用天根科技有限公司miRNA提取分离试剂盒提取总RNA,逆转录后进行PCR扩增。miR-21 特异性引物应用DNAMAN 软件设计并由上海生工生物工程技术有限公司合成,序列为:5′-UGAGAUGAAGCACUGUAGCUC-3′。PCR条件:94 ℃2 min,(94 ℃15 s,60 ℃15 s,72 ℃20 s)持续40 个循环,40 ℃10 s。PCR 反应结束后分析反应曲线,Real-time 分析采用2-ΔΔCt法进行。
取1.2 部分中的全血标本100 μL,分离PBMC,加入等体积的不含血清的RPMI 1640,加入1 μg/mL PMA 工作液50 μg/mL、0.1 mg/mL Momensin 工作液3.4 μL、Iomomycin 工作液4 μL,继续培养6 h,加入5 μg CD3-FITC 和5 μg CD8-PE-cy5,避光孵育15 min,固定后再次加入鼠抗IgG1-PE,IL-9-PE,重悬后1 200 r/min 离心5 min,流式细胞仪检测Th9细胞所占比例。
采用双抗体夹心酶联免疫吸附法(ELISA)检测血清DAO、ET、D-lac 含量,检测试剂盒来自大连赛拓生物科技有限公司。
1.4 统计学方法 选择SPSS 20.0 软件进行分析,相关性分析采用直线相关分析,计量资料数据与计数资料数据以均数±标准差或中位数(下四分位数,上四分位数)、百分比、例数表示,行t检验、χ2检验、秩和检验等,检验水准为α=0.05。
2 结果
2.1 ALT、TBIL、AST 含量对比 肝硬化组的血清ALT、TBIL、AST 含量都高于对照组(P<0.05)。见表1。
表1 两组ALT、TBIL、AST 含量对比Tab.1 Comparison of ALT,TBIL and AST contents in two groups ±s

表1 两组ALT、TBIL、AST 含量对比Tab.1 Comparison of ALT,TBIL and AST contents in two groups ±s
组别肝硬化组对照组t 值P 值例数144 144 ALT(U/L)188.39±45.29 26.20±10.29 23.198 0.000 AST(U/L)142.20±45.21 30.78±9.91 17.339 0.000 TBIL(μmol/L)102.49±22.84 34.29±11.81 15.292 0.000
2.2 miR-21 相对表达量与Th9 含量对比 肝硬化组的miR-21 相对表达量与Th9 含量都高于对照组(P<0.05)。见表2。
表2 两组miR-21 相对表达量与Th9 含量对比Tab.2 Relative expression of microRNA-21 and Th9 in two groups ±s
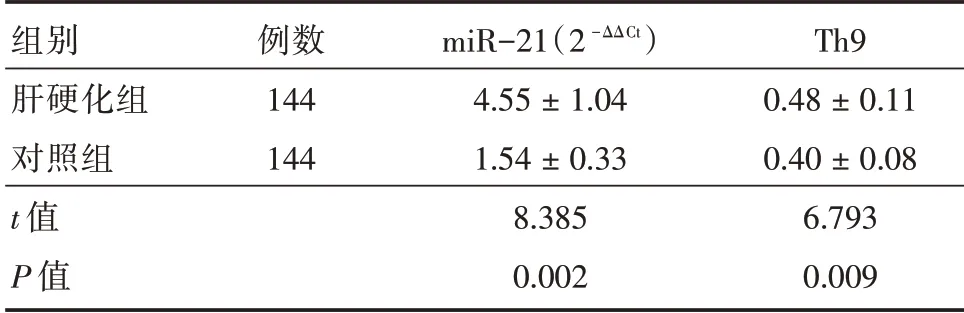
表2 两组miR-21 相对表达量与Th9 含量对比Tab.2 Relative expression of microRNA-21 and Th9 in two groups ±s
组别肝硬化组对照组t 值P 值例数144 144 miR-21(2-ΔΔCt)4.55±1.04 1.54±0.33 8.385 0.002 Th9 0.48±0.11 0.40±0.08 6.793 0.009
2.3 肠道屏障功能指标对比 肝硬化组的血清ET、DAO 与D-lac 值高于对照组(P<0.05)。见表3。
表3 两组肠道屏障功能指标对比Tab.3 Comparison of intestinal barrier function between two groups ±s
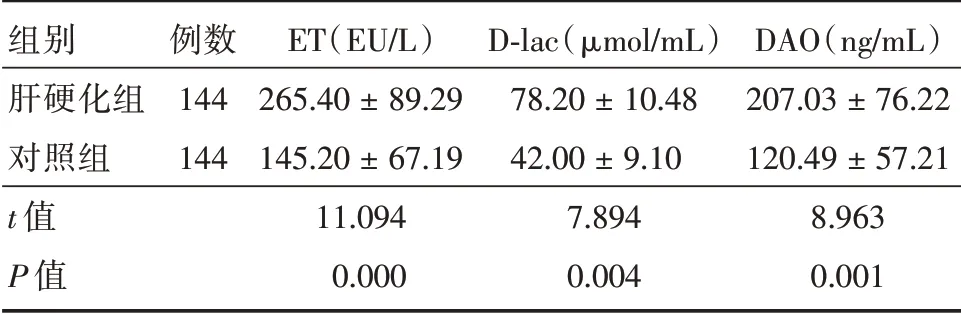
表3 两组肠道屏障功能指标对比Tab.3 Comparison of intestinal barrier function between two groups ±s
组别肝硬化组对照组t 值P 值例数144 144 ET(EU/L)265.40±89.29 145.20±67.19 11.094 0.000 D-lac(μmol/mL)78.20±10.48 42.00±9.10 7.894 0.004 DAO(ng/mL)207.03±76.22 120.49±57.21 8.963 0.001
2.4 相关性分析 在肝硬化组中,直线相关分析显示血清ET、DAO、D-lac 与ALT、TBIL、AST、miR-21、Th9 都呈现显著正相关性(P<0.05)。见表4。

表4 乙肝肝硬化患者肠道屏障功能与常规指标、miR-21、Th9 的相关性(n=144)Tab.4 The correlation between intestinal barrier function and routine parameters,miR-21 and Th9 in patients with hepatitis cirrhosis(n=144)
3 讨论
当前已发现的miRNA 接近万个,可在血清中稳定地存在[10]。miRNA 可利用自身调节其靶基因的表达水平从而影响疾病的进程,并且其变化程度还与疾病的分型分级以及预后密切相关。miR-21 与人类多种疾病的发生发展有密切的关系,定位于大约离染色体5q32 处。miR-21 在结肠癌、子宫颈癌、胃癌、B 细胞淋巴瘤患者中下调,当前有研究发现miR-21 在单独乙肝患者标本中下调,在乙肝肝硬化患者标本中上调[11]。有研究显示抑制miR-21 表达可遏制肝癌细胞的转移力及侵袭力,上调miR-21 表达可提高肿瘤细胞分化、转移及侵袭能力,遏制细胞凋亡,促使恶性肿瘤发生、发展[12]。当前研究发现CD4+Th 细胞除Th1 细胞和Th2 细胞外,Th9 细胞在许多疾病的病理过程中发挥重要作用[13]。有研究[14]显示在缺乏IL-4 的情况下,TGF-β1 可诱导初始T 细胞向调节性T 细胞转化,起到抑制炎症的作用,当加入IL-4 后初始T 细胞显著向Th9 转化,产生致炎效应。本研究显示肝硬化组的miR-21 相对表达量与Th9 含量都高于对照组(P<0.05),表明乙肝肝硬化患者的miR-21 呈现高表达状况,同时Th9 的含量升高,表明为免疫失衡状态。从机制上分析,乙肝肝硬化患者体内肝细胞HBV 复制强烈,但是HBV 并不能直接导致肝细胞病变,miR-21 在此条件下可调节NF-κB 的表达,从而发挥调节HBV 复制的作用[15]。
肠道屏障主要由物理屏障、生物屏障、化学屏障、免疫障碍等组成,特别是相关免疫活性物质构成的免疫屏障发挥着重要的作用。肝脏具有双重血供,可负责收集胃肠道等多数消化器官的血液[16]。当肠道屏障的完整性遭到破坏时,大量细菌及其代谢产物将穿过肠屏障进入血液,可影响肝脏固有免疫系统的平衡[17]。相关研究[18]显示肝硬化患者肝细胞功能受损后,血管活性肠肽、前列环素等物质合成增多,导致肠黏膜血管扩张、瘀血,使得肠黏膜通透性增加。特别是内毒素诱导产生的一氧化氮可使肠上皮结构疏松而增加通透性,导致益生菌减少,而致病菌增加,促使发生细菌移位。本研究显示肝硬化组的血清ET、DAO 与D-lac 值高于对照组(P<0.05)。ET是革兰阴性细菌的细胞壁中的一种成分,血清中ET主要来自于肠道里面内毒素的吸收,可反映肠黏膜通透性改变,也可反映肠源性内毒素血症的严重程度。D-Lac是肠道多种细菌发酵时产生的代谢产物,当肠屏障破坏时,D-Lac 吸收增加,使得血中D-Lac水平升高[19]。DAO存在于肠黏膜上皮细胞内,并且95%以上位于小肠黏膜绒毛;当肠屏障损伤时,肠黏膜通透性增加,可使血清DAO水平升高,为此,DAO可作为反映肠黏膜通透性的客观指标[20]。
本研究直线相关分析显示乙肝肝硬化患者的血清ET、DAO、D-lac 与ALT、TBIL、AST、miR-21、Th9 都呈现显著正相关性(P<0.05)。从机制上分析,随着肝硬化病情的加重,肠黏膜屏障的完整性受损,肠道内的内毒素、D-Lac 移位入血,引起血内毒素和D-Lac 异常升高[21]。还有研究显示肝硬化伴门脉高压时的D-Lac、DAO、ET 值较非门脉高压显著升高,当出现肝硬化时,可减弱肠黏膜上皮的修复能力,从而破坏肠屏障[22]。血清miR-21 可通过细胞内与细胞间信号通路来参与由HBV 介导的乙肝肝硬化发生过程,这可能是对乙肝肝硬化发生与发展通路的重要补充。不过本研究也有一定的不足,miR-21 的多功能特性、所调节靶基因的多样性决定了其在不同背景下具有不用的作用机制,并且miR-21 在不同的标本中的表达水平会有不同,其作用机制还有待深入分析。
总之,乙肝肝硬化患者中miR-21、Th9 都呈现高表达状况,也表现为肠道屏障功能紊乱状态,两者可互相形成,形成恶性循环,从而参与乙肝肝硬化的发生与发展。

