usp9y 与Nna1 基因的相互作用及对精子发生的影响
李文秀 高迎春 李蕊秀 刘静 吴家栋 边艳超 肖瑞
1内蒙古医科大学内蒙古自治区分子病理重点实验室(呼和浩特010059);2内蒙古自治区赤峰市医院病理科(内蒙古赤峰024000)
浦肯野细胞变性(Purkinje cell degeneration,pcd)小鼠是一类常染色体隐性突变种[1],成年早期小脑浦肯野细胞衰退而出现共济失调[2],并伴随着视网膜的光感受体细胞、嗅球的僧帽细胞以及一些丘脑神经元的缓慢退化[1-3]。此外,成年pcd 小鼠是不育的,因为有异常形状和精子数量的减少[4]。前期研究发现Nna1 功能的丧失是pcd 表型的基础[5]。Nna1 蛋白的表达局限在晚期的初级精母细胞和圆形精子细胞中,在精子发生和存活过程中起重要作用。usp9y 跨越170 kb的DNA,由至少46 个外显子组成,占据AZFa 间隔的一小部分[6],是编码2 555 个氨基酸的大多肽,其大小约为300 kDa[7],在pcd 小鼠的睾丸中高表达。
本研究构建了usp9y 真核表达载体,利用免疫共沉淀实验研究了usp9y 蛋白与Nna1 蛋白的相互作用。同时通过对pcd 小鼠睾丸基因表达的研究,了解usp9y 基因在小鼠精子发生异常中的作用和可能参与的信号通路。
1 材料与方法
1.1 试 剂 HEK293T 细 胞、DH5α 感 受 态 细 胞(Biotech 公司)、pcd3J 杂合型小鼠由韩国建国大学的ChankyuPark 教授馈赠、PEGFP 质粒载体(BD 公司)、usp9y 质粒载体(Origene 公司)、胶回收试剂盒(QIAGEN 公司)、质粒大提试剂盒(QIAGEN)、质粒小提试剂盒(TIANGEN)、免疫共沉淀试剂盒(SIGMA 公司)、usp9y 克隆全长质粒(Origene 公司)、胎牛血清(HyClone 公司)、DMEM 高糖培养液(Gibco 公司)、PEGFP 质粒载体(BD 公司)、usp9y克隆全长质粒(Origene 公司)
1.2 磁性转染 90 mm 培养皿中接种HEK293T 细胞2×106个,24 h 后利用磁珠将usp9y 质粒DNA 及pcmv-myc-Nna1-C/pcmv-myc-Nna1-N 质粒DNA 转染于细胞中,48 h 后提取细胞RNA,通过荧光定量PCR 检测表达量,提取蛋白进行Western Blot 实验。
1.3 重组载体构建 以usp9y 质粒为模板,上游引物:5′-CGCTCGAGACATAGGCACACCAGTAACT-3′;下游引物:5′-GAATTCCATTCTTGCTGTGACGGAGG-3′,扩增条件94 ℃预变性5 min,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸2 min;循环35 次后,72 ℃延伸10 min,用1.5%琼脂糖凝胶电泳验证产物。PCR 扩增产物经EcoRⅠ和XhoⅠ双酶切纯化后与相同酶切处理的载体pEGFP-C1 连接,通过化学转化法转化到到E.coliDH5α 中,涂板。
1.4 质粒提取 选单菌落5 个,摇菌。按照天跟小提试剂盒说明提取质粒并测质粒浓度。后通过PCR 反应、双酶切反应和基因测序反应验证质粒构建成功。
1.5 免疫共沉淀 收集转染后的HEK293T 细胞,加入lysis buffer 后匀浆机短暂匀浆两次,将细胞悬液4 ℃摇动1~2 h,后12 000 r/min 离心30 min,收集上清即为细胞总蛋白,加入5 μL myc-tag 抗体旋转摇床4 ℃孵育过夜,再加入琼脂糖珠4 ℃缓慢摇动2 h,进行免疫沉淀反应。沉淀反应后将琼脂糖珠离心至管底,用1×IP Buffer清洗4次,后加入适量蛋白上样缓冲液,95 ℃金属浴中热变性5 min,离心后收集蛋白。
1.6 pcd 小鼠基因型检测 取小鼠尾巴2 mm,提取DNA,PCR 扩增目的基因,后用琼脂糖凝胶电泳进行分析[8]。PCR 反应体系为25 μL,反应条件:95 ℃3 min;95 ℃30 s,59 ℃15 s,72 ℃15 s,35个循环;72 ℃延伸1 min。引物见表1。荧光定量PCR 结果采用2-△△CT法,其中△△CT=(CT目标基因-CT内参基因)样本-(CT目标基因-CT内参基因)对照。
1.7 小鼠睾丸组织表达谱分析 取野生型小鼠睾丸组织按手工法提取100 ng RNA,在nCounter Prep Station 机器上操作,后用nCounter®Digital Analyzer进行数据分析。采用nsolver2.5 软件(http://www.nanostring.com/)分析小鼠睾丸组织基因表达谱实验数据。
1.8 统计学方法 数据以x ± s表示, 采用SPSS13.0 统计软件进行分析,两组样本均数比较行t检验,P<0.05 为差异有统计学意义。

表1 基因引物信息Tab.1 Gene primer information
2 结果
2.1 pCMV6-Myc-DDK-usp9y 质粒的表达情况荧光定量PCR 检测显示转染质粒组的usp9y 基因的表达量显著升高,是正常对照组(未转染质粒的细胞)的1 460 倍(P<0.05,图1)。结果说明pCMV6-Myc-DDK-usp9y 质粒在转录水平上表达。
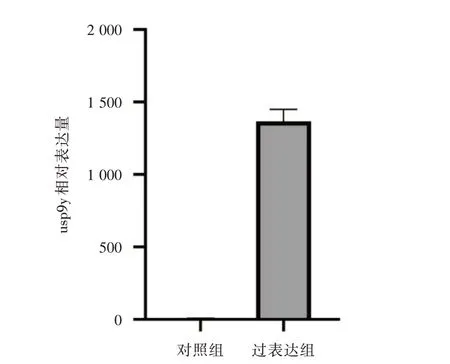
图1 荧光定量PCR 检测pCMV6-Myc-DDK-usp9y 质粒的表达情况Fig.1 Fluorescence quantitative PCR detection of pCMV6-Myc-DDK-usp9y plasmid expression
2.2 蛋白水平上pCMV6-Myc-DDK-usp9y 质粒的表达检测 使用Western Blot 检测usp9y 蛋白的表达,多次重复实验结果发现该质粒在翻译水平上不表达(图2)。通过分析该质粒的基因序列图发现序列正确,在转录水平上表达,但在翻译水平上并不表达,可能与载体有关,或蛋白序列过长。
2.3 pEGFP-usp9y-(nt1558-1955)表达载体的构建 由于pCMV6-Myc-DDK-usp9y 质粒在蛋白水平上不表达,设计位于usp9y uch 功能结构域UCH(ubiquitin carboxyl-terminal hydrolase)(图3A)编码区的上下游引物(包含EcoRⅠ和XhoⅠ酶切位点),以pCMV6-Myc-DDK-usp9y质粒为模板,PCR扩增获得携带EcoRⅠ和XhoⅠ酶切位点的usp9y-(nt1558-1955)编码序列(1 600 bp)(图3B)。
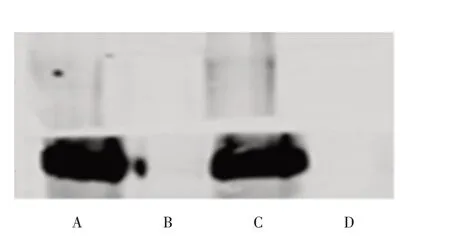
图2 蛋白印迹检测pCMV6-Myc-DDK-usp9y 表达Fig.2 Western blot analysis of pCMV6-Myc-DDK-usp9y expression

图3 PCR 扩增pCMV6-Myc-DDK-usp9y 的结果Fig.3 Results of PCR amplification of pCMV6-Myc-DDKusp9y
2.4 重组质粒的验证 分别通过PCR(图4),双酶(EcoRⅠ和XhoⅠ)切(图5)和测序(图6)的方法鉴定克隆质粒,结果均证明成功构建了重组质粒pEGFP-usp9y-(nt1558-1955)。
2.5 Western Blot 检测重组质粒表达 将构建好的重组质粒pEGFP-usp9y-(nt1558-1955)转染到HEK293T 细胞,48 h 后提取细胞全蛋白,用GFP 标签抗体,通过western blot 检测到重组质粒在蛋白水平上成功表达(用在线软件预测蛋白分子量约为100 kDa)。
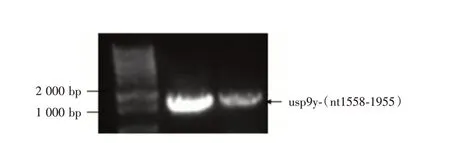
图4 PCR 检测重组质粒的结果Fig.4 Results of PCR detection of recombinant plasmid

图5 重组质粒双酶切后琼脂糖凝胶电泳检测结果Fig.5 Results of agarose gel electrophoresis after double digestion of recombinant plasmid

图6 重组质粒的测序结果Fig.6 Sequencing results of recombinant plasmid

图7 蛋白印迹检测重组质粒的表达Fig.7 Western Blot detection of recombinant plasmid expression
2.6 免疫共沉淀实验检测usp9y 与Nna1 蛋白的相互作用 将pEGFP-usp9y-(nt1558-1955)重组质粒同有myc 标签的pCMV-myc-Nna1-C 和pCMVmyc-Nna1-N 分别共同瞬时转染于HEK293T 细胞,48 h后提取蛋白,分别用GFP标签抗体沉淀pEGFPusp9y-(nt1558-1955)及与其相互作用的蛋白复合物,后用myc 标签抗体进行Western Blot 检测,结果显示(图8A、8B),pEGFP-usp9y-(nt1558-1955)可与pCMV-myc-Nna1-C 端蛋白形成免疫复合物共沉淀下来,反向验证(用Myc 抗体沉淀复合物,用GFP抗体检测蛋白表达)证明二者之间存在相互作用,但发现usp9y 可与Nna1 的C 端发生相互作用,而与Nna1-N 端没有相互作用。Nna1 蛋白的C 端片段包含其主要的羧肽酶功能结构域,该结果提示usp9y 与Nna1 相互作用,在pcd 小鼠精子发生中具有重要作用。
2.7 单分子基因表达谱分析结果 分析出生后19、31 和36 d 的小鼠睾丸中基因的表达,发现Nna1 基因表达下调,这与pcd 小鼠中该基因突变的基因型一致;usp9y 在出生后19 d表达下调,而在31 和36 d 表达上调,且呈增长趋势;细胞周期蛋白B3在pcd小鼠睾丸中表达下调;Nna1羧肽酶的底物alpha tubulin 在19 和31 d 的pcd 小鼠睾丸中的表达与正常对照相比变化不明显,但在出生后36 d 的pcd小鼠睾丸中表达下调,这与Nna1的表达一致,提示该蛋白在小鼠睾丸发育或精子发生中可能也具有重要的功能。另外检测MAPK和NF-κB信号通路中的关键因子Traf6、Grb2、PI3K 、Map2k1、Mapk1、Raf1、Kras、Ikbkb、Ikbkg 的表达变化,结果发现PI3K、Map2k1、Raf1、Ikbkb、Ikbkg的表达上调,其中Ikbkg和PI3K的表达上调较显著(表2)。
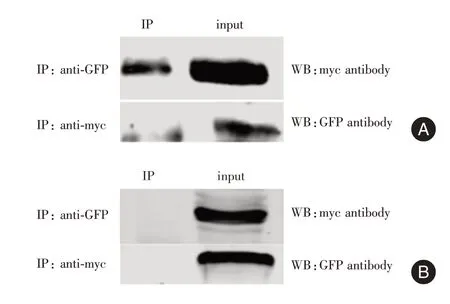
图8 免疫共沉淀实验检测usp9y 与Nna1 蛋白的相互作用Fig.8 Immunoprecipitation assay to detect the interaction between usp9y and Nna1 protein
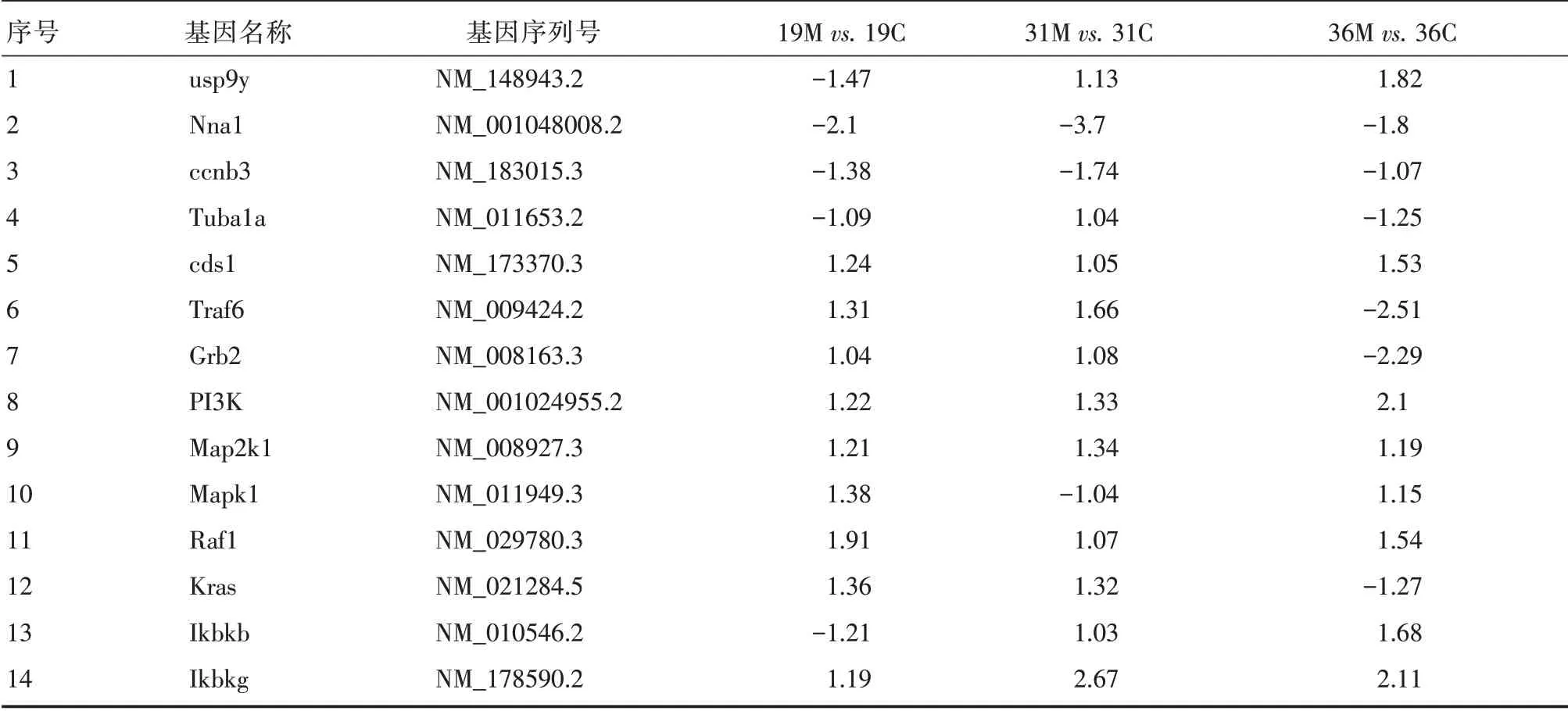
表2 相关基因表达倍数差异Tab.2 Differences in expression folds of related genes
3 讨论
Nna1 基因编码蛋白属于M14 金属羧肽酶家族的一个亚族[9]。目前发现其作用底物包括微管相关蛋白和参与转录及染色体重建的相关蛋白,通过催化作用缩短聚谷氨酸侧链及微管蛋白和肌球蛋白轻链激酶等基因编码的C 末端蛋白。研究发现Nna1 蛋白对谷氨酸和天冬氨酸酸性蛋白末端进行加工,进而调节蛋白质-蛋白质和DNA-蛋白质之间相互作用[9]。有研究[10]表明Nna1 基因突变所引起的聚谷氨酸的异常增高是造成pcd 小鼠神经退化表型的原因,目前研究发现数百种胞浆和线粒体蛋白在pcd 小鼠大脑内大量升高,并功能正常,高度提示Nna1 在蛋白降解的过程中发挥重要作用,浦肯野细胞的死亡很可能是由于大量肽不能降解成氨基酸[11]。该研究提示Nna1 突变的小鼠生殖异常可能和Nna1 缺失导致某种底物蛋白的异常表达相关。
usp9y 基因是AZFa 区最早被发现的与男性不育有关的候选基因,是泛素特异性蛋白酶,它从蛋白质数量、活性上进行微调节[12],在蛋白质的降解中发挥重要作用。在Nna1 突变的小鼠睾丸组织中,usp9y 的表达相对升高,提示usp9y 很可能是Nna1 的底物。据报道在人类精子发生过程中,usp9y 更有可能是提高效率的微调器,而不是基本功能的提供者[13]。免疫共沉淀发现Nna1 N 末端表达质粒的检测结果是阴性,Nna1 C 末端阳性的,Nna1 的C 端的结构域与锌羧肽酶具有很大的序列同源性[14]。由此推断Nna1 很可能是通过此结构域和usp9y 蛋白进行相互作用,但二者之间的作用是直接还是间接的仍然需要深入研究。
单分子基因表达谱系统发现cds1,ccnb3 的表达下调,二者分别在视神经和睾丸的发育中具有重要作用,这些因子表达的变化与pcd 小鼠的表型紧密联系,提示他们可能在pcd 小鼠精子发生障碍中扮演重要的角色。
有研究发现促凋亡因子如NF-κB 及Fas 在小鼠睾丸间质细胞的凋亡过程中发挥重要作用,最终导致雄性不育,主要表现为支持细胞综合征和少精子症[15]。信号通路的关键因子分析发现Ikbkg 基因升高最显著。IKK 是NF-κB 活化的关键因子,而Ikbkb 和Ikbkg 都是IKK 的重要组成成分,Ikbkb 是IKK 复合物的催化亚基,Ikbkg 为IKK 的调节亚基[16],参与NF-κB 细胞信号通路的Ikbkb 和Ikbkg 基因在雄性不育pcd 小鼠睾丸组织中表达上调,提示NF-κB 细胞信号通路很可能在精子发生障碍过程中发挥某种作用。

