CT引导下氩氦刀联合阿法替尼对肺腺癌患者的临床疗效研究
赵海斌, 冯华松, 张绍强
肺癌是目前全球发病率最高的恶性肿瘤之一,其中,以肺腺癌较为常见的非小细胞肺癌(non-small cell lung cancer,NSCLC)是主要的病理类型[1]。对于处于晚期的肺腺癌患者,放疗联合化疗是目前的标准方案,其中,外部束放疗可以明显改善局部控制,但对于控制患者远期生存的复发情况效果较差;且高辐射剂量可能对正常肺组织,周围重要器官和血管造成毒性,放疗与化疗导致的副作用明显降低了患者的生活质量。氩氦刀是常用的冷冻消融治疗方式,可以通过CT引导下进行微创治疗,局部和全身反应较小[2],在晚期肝癌等治疗中得到了较多应用。阿法替尼是第二代表皮生长因子受体(epidermal growth factor receptor,EGFR)靶向治疗药物,而腺癌中EGFR突变的发生率较高,其中以亚洲人群最为明显,多项应用阿法替尼治疗局部晚期和广泛晚期的国内外研究均取得了一定的疗效[3]。而氩氦刀联合阿法替尼用于晚期肺腺癌患者的研究较少,对于近期疗效与远期情况尚不十分清楚。为此,我院对100例晚期肺腺癌患者进行了1项对照研究,现将结果报道如下。
1 资料与方法
1.1 一般资料
选择2015年1月至2016年9月于固安县人民医院就诊的肺腺癌患者100例,随机数字法分为对照组(50例)和阿法替尼组(50例)。在应用CT引导下氩氦刀冷冻治疗的基础上,对照组采用吉西他滨联合顺铂的化疗方案,阿法替尼组采用口服阿法替尼治疗。纳入标准:①确诊为周围型肺腺癌的患者;②临床分期为ⅢA~Ⅳ期,无手术切除指征;③经检测明确存在EGFR常见突变(18号、19号和21号染色体);④KPS评分≥70分;⑤预生存期>3个月。排除标准:①年龄>75岁,或<18岁;②既往接受过针对性放化疗或手术治疗;③合并其他系统肿瘤或严重疾病;④对本研究所用药物过敏。两组患者一般资料差异无统计学意义(均P>0.05)(表1)。本研究经医院伦理学委员会审议通过(伦理审批号:GARMYY20150103),并与患者(或)其家属签订知情同意书。
表1 阿法替尼组与对照组一般资料比较
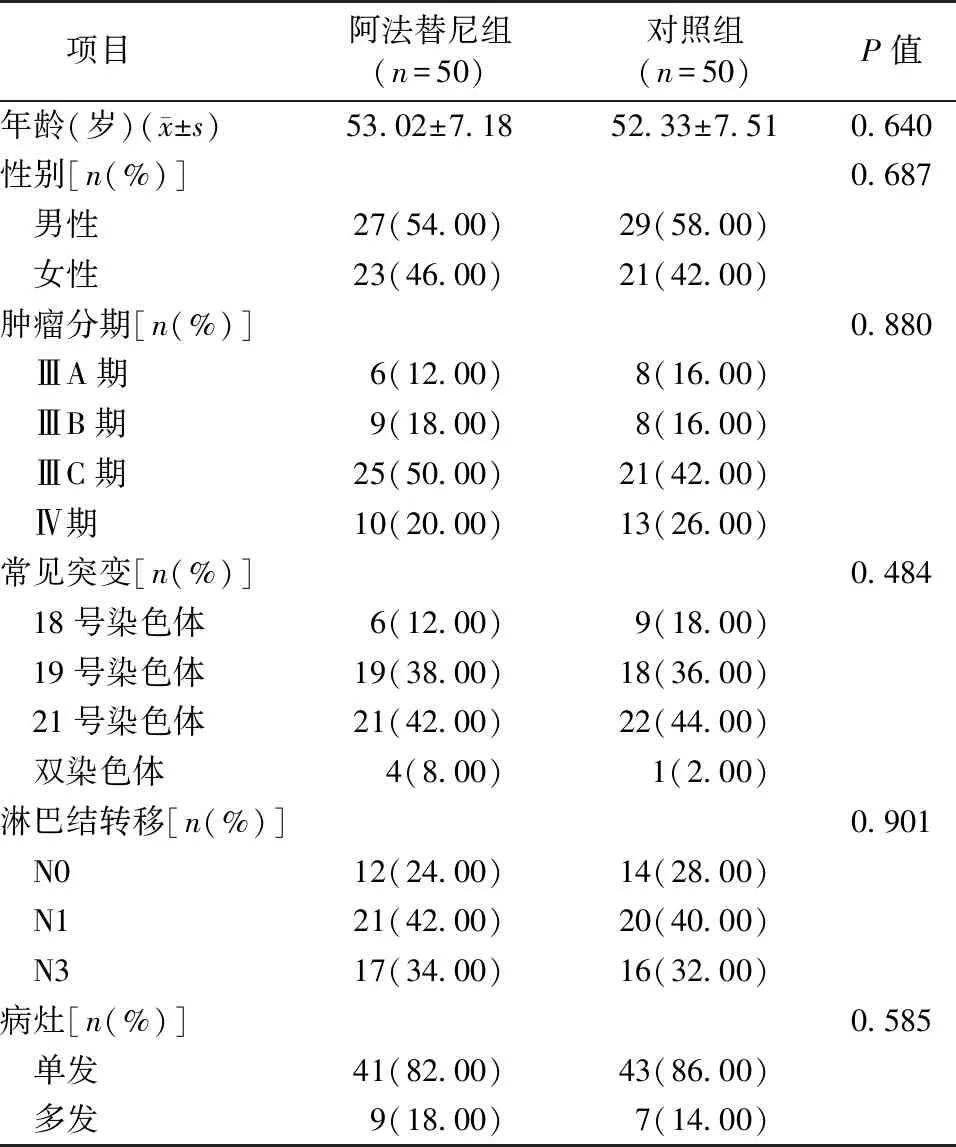
项目阿法替尼组(n=50)对照组(n=50)P值年龄(岁)(x±s)53.02±7.1852.33±7.510.640性别[n(%)]0.687 男性27(54.00)29(58.00) 女性23(46.00)21(42.00)肿瘤分期[n(%)]0.880 ⅢA期6(12.00)8(16.00) ⅢB期9(18.00)8(16.00) ⅢC期25(50.00)21(42.00) Ⅳ期10(20.00)13(26.00)常见突变[n(%)]0.484 18号染色体6(12.00)9(18.00) 19号染色体19(38.00)18(36.00) 21号染色体21(42.00)22(44.00) 双染色体4(8.00)1(2.00)淋巴结转移[n(%)]0.901 N012(24.00)14(28.00) N121(42.00)20(40.00) N317(34.00)16(32.00)病灶[n(%)]0.585 单发41(82.00)43(86.00) 多发9(18.00)7(14.00)
1.2 治疗方案
1.2.1 CT引导下氩氦刀消融方案 术前使用四排螺旋CT(Light Speed Plus,美国GE)增强扫描以确定肿瘤的大小、形状、位置,与周围脏器、大血管、神经的关系,选择需处理的病灶及所用氩氦刀的数量和进刀方向。操作方法:自制定位器结合CT扫描,确定穿刺点并做好标记,结合CT确定穿刺针推进方向、角度及到达肿块的深度,注意避开大血管、神经、周围重要脏器,局麻后于穿刺点将氩氦刀针穿刺进入预定部位,启动氩氦刀冷冻系统,刀尖温度迅速降至-140 ℃,冷冻15 min后,启动氦气1 min,再次启动氩气15 min,冷冻2次后退出氩氦刀针,穿刺部位包扎,术后给予常规抗炎、止血、对症等处理。典型病例手术前与术中胸部CT图像见图1。

图1 1例57岁男性患者氩氦刀冷冻消融前后的典型胸部CT图像1A:患者术前增强CT图像;1B:氩氦刀冷冻消融术中图像,可见3把氩氦刀自不同方向进行治疗
1.2.2 对照组化疗方案 氩氦刀消融后2周开始化疗,采用吉西他滨(1 000 mg/m2,d1、d8,哈尔滨誉衡药业股份有限公司,国药准字H20040958,规格0.2 g/支)联合顺铂(75 mg/m2,d1,齐鲁制药有限公司,国药准字H37021358,规格10 mg×1支)方案,每个周期21 d,疗程4~6个周期。
1.2.3 阿法替尼组 氩氦刀消融后2周后,采用阿法替尼(40 mg,1次/d,德国勃林格殷格翰药业公司,国药准字JX20150037,规格40 mg×7片)用药至疾病进展或患者不能耐受。
1.3 评价指标
比较两组患者的疗效、总生存期(overall survival, OS)、无进展生存期(progress free survival,PFS)、局部复发和远处转移情况,以及不良反应发生情况。
疗效评价:氩氦刀术后6个月进行评定,疗效评价采用实体瘤的疗效评价标准1.1版[4]:客观缓解率(objective response rate,ORR)=(完全缓解+部分缓解)/总例数×100%。OS:所有患者从开始治疗至死亡或随访截止的时间。PFS:从接受治疗开始,到观察到疾病进展或者发生因为任何原因的死亡之间的时间。不良反应根据常见不良反应术语评定标准(common terminology criteria for adverse events,CTCAE)4.0.3版[5]进行评估和统计,主要比较3级以上不良反应发生情况。
表2 阿法替尼组和对照组临床疗效的对比[n(%)]

组别完全缓解部分缓解病情稳定病情进展客观缓解率阿法替尼组(n=50)23(46.00)13(26.00)8(16.00)6(12.00)36(72.00)对照组(n=50)13(26.00)12(24.00)10(20.00)15(30.00)25(50.00) Z/χ2值2.7175.086 P值0.0300.024
1.4 随访
通过电话、微信或门诊检查进行随访。治疗期间,每2个周期进行评价;化疗结束后每2~3个月进行评价,总计2年。随访截止时间2018年9月30日。
1.5 统计学方法
2 结果
2.1 临床疗效对比
阿法替尼组的ORR明显高于对照组(72.00%和50.00%,χ2=5.086,P=0.024),见表2。
2.2 进展情况对比
对照组的中位PFS为10(6,14)个月,阿法替尼组的中位PFS为14(10,18)个月,阿法替尼组患者的PFS明显高于对照组,差异有统计学意义 (Log rankχ2=21.597,P<0.001),见图2。
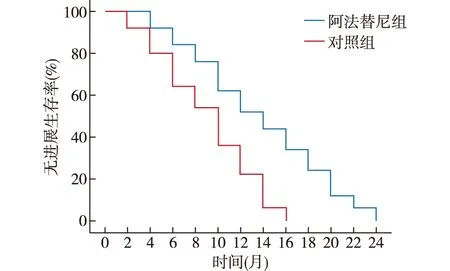
图2 无进展生存曲线
2.3 局部复发和远处转移情况的对比
对照组的中位远处转移时间为10(6,14)个月,阿法替尼组的远处转移为16(14,20)个月,阿法替尼组的远处转移时间明显高于对照组(Log rankχ2=25.908,P<0.001);对照组和阿法替尼组的局部复发时间差异无统计学意义[12(10,14)个月和12(8,18)个月,Log rankχ2=3.294,P=0.070]。
2.4 总生存情况的对比
对照组和阿法替尼组患者的2年死亡率分别为44%(22/50)和26%(13/50),阿法替尼组的死亡风险明显低于对照组(HR=0.457,95%CI[0.226,0.952],P=0.029),见图3。
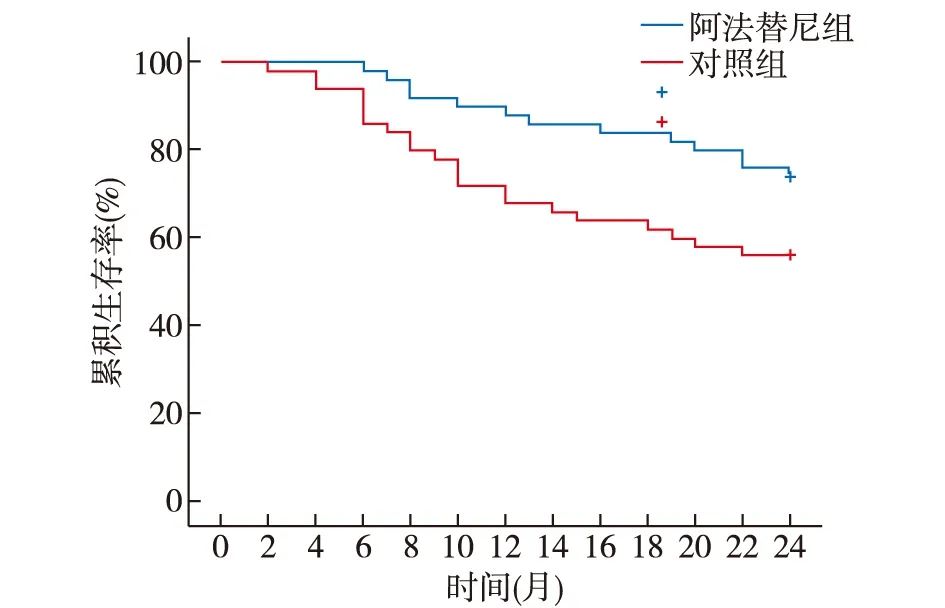
图3 总体生存曲线
2.5 并发症和不良反应发生情况的对比
对照组和阿法替尼组的并发症发生情况差异无统计学意义,阿法替尼组的不良反应发生率明显低于对照组,见表3。
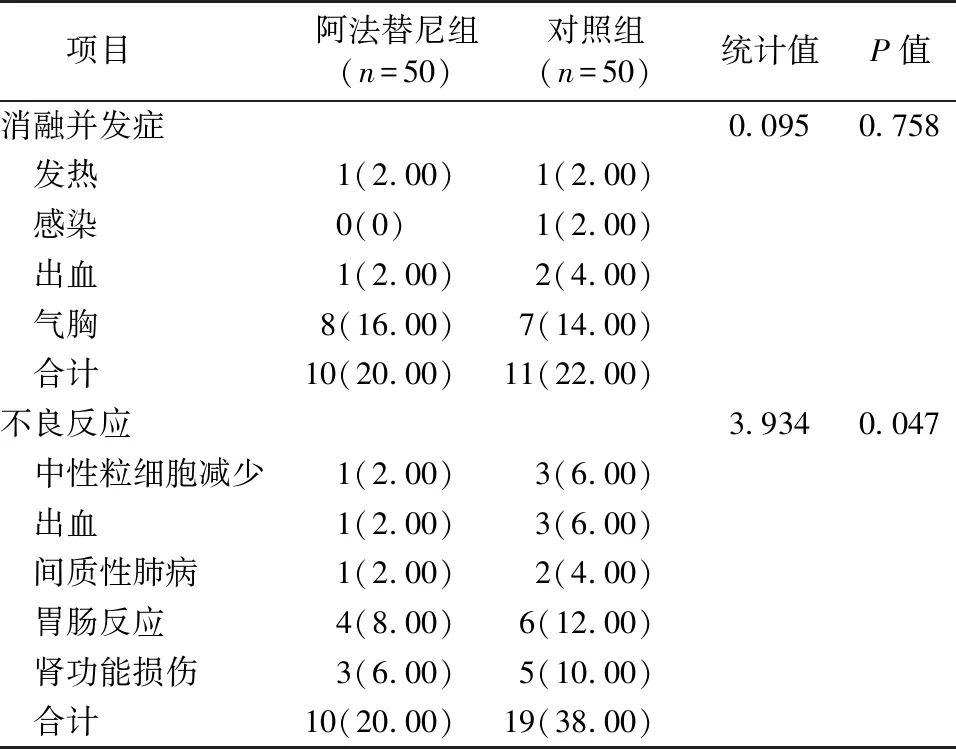
表3 慢性放射反应发生情况在阿法替尼组和对照组两组间的对比[n(%)]
3 讨论
在环境污染、吸烟以及人口老龄化等多种因素的持续作用下,我国肺癌的发病率呈逐年升高趋势,多数肺癌患者确诊时已处于晚期,生存预后较差。目前,进行局部放疗治疗与进行吉西他滨联合铂类全身化疗是最常用的晚期肺腺癌患者的主要治疗方案[6],但上述方案的临床疗效较低,且患者的疾病进展时间多短于1年。因此,探究新的综合治疗方法可以为晚期肺腺癌的治疗寻找新的方向。
氩氦刀是一种利用惰性气体进行冷冻消融治疗的物理治疗手段,在CT的精确引导下,可以经皮对靠近体表的肿瘤瘤体进行消融,具有精确、微创和无辐射的优点,对于肿瘤周围组织的损伤较小[7],并可以通过应用多把消融针从不同方向对不规则的瘤体进行消融。吉西他滨是一种嘧啶类抗代谢物,在细胞内经核苷激酶的作用被代谢为具有活性的二磷酸及三磷酸核苷产物,二者通过两种作用机制抑制DNA合成,从而实现吉西他滨的细胞毒作用;顺铂是应用广泛的铂类化疗药物,其具有广谱的抗癌功能,可以通过作用于DNA的碱基分子破坏DNA的正常复制,进而破坏细胞膜结构,是目前联合化疗中的常用药物。尽管吉西他滨+顺铂方案应用广泛,耐受性好,但作为一线治疗的疾病控制率和客观缓解率并不高,治疗后的耐药性较高[8]。
本研究通过对比在应用氩氦刀局部冷冻消融的基础上联合常规化疗或第二代EGFR靶向治疗药物阿法替尼的短期疗效与远期预后情况,研究发现阿法替尼组的ORR明显高于对照组,显示出了较高的近期疗效水平。随着基础研究的进展,靶向治疗成为肿瘤治疗领域的热点,EGFR突变作为腺癌较为常见的突变类型,在我国人群中具有较高的发生率[9],厄洛替尼或吉非替尼等第一代EGFR酪氨酸激酶抑制剂被研究证实可以作为EGFR突变NSCLC患者的标准治疗;然而,其治疗后的疾病进展风险仍然较高,并且联合常规化疗疗法也无法克服EGFR酪氨酸激酶抑制剂单药治疗的耐药性难题[10]。阿法替尼作为第二代EGFR相关靶向药物,能够不可逆地阻断EGFR相关通路,从而对于降低用药后的快速耐药风险、改善患者预后有积极意义[11]。
由生存曲线可以看出,应用氩氦刀联合阿法替尼的患者总体生存和无进展生存均明显优于对照组,而分析两组患者局部复发和远处转移情况发现阿法替尼组的中位远处转移时间16个月显著高于对照组的10个月,但对照组和阿法替尼组的局部复发时间差异无统计学意义。这表明在应用氩氦刀局部冷冻消融的基础上联合阿法替尼进行一线治疗,可以明显改善晚期肺腺癌患者的总体生存,延缓疾病进展,其中,阿法替尼对于降低远处转移风险的作用更为明显,分析产生这一现象的原因为氩氦刀冷冻治疗后局部肿瘤组织已得到较好的控制[12],从而无法显现出阿法替尼对控制局部复发的效果;而阿法替尼对EGFR相关通路广泛且不可逆的抑制作用,可以明显抑制肿瘤的转移,对于转移病灶的生长也具有明显的抑制作用[13],从而显示出较常规全身化疗方案更为明显的疗效与预后改善作用。此外,通过比较两组患者治疗相关并发症和不良反应发生情况,可见氩氦刀冷冻消融的并发症发生率较低,具有良好的安全性。与吉西他滨联合顺铂的全身化疗方案相比,阿法替尼的不良反应发生率更低,较低的不良反应发生率以及肺部症状也明显改善了患者的生活质量。
综上所述,CT引导下氩氦刀联合阿法替尼治疗晚期肺腺癌具有较高的疗效和较好的远期生存情况,能够明显降低患者远期远处转移风险,且安全性较好。

