开颅电凝法建立SD大鼠大脑中动脉阻塞脑梗死模型*
肖宗宇, 汪继
1青海大学附属医院神经外科(青海西宁 810001); 2中国人民解放军总医院第七医学中心附属八一脑科医院神经外科(北京 100000)
缺血性脑卒中是由脑的供血动脉狭窄或闭塞、脑供血不足导致的脑组织坏死总称[1]。由于大脑中动脉(middle cerebral artery,MCA)为颈内动脉(internal carotid artery,ICA)的直接延续,MCA常为缺血性脑卒中的好发部位。目前,大鼠大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)脑梗死模型已被广泛运用于局灶性缺血性脑梗死的研究[2-4]。目前有多种方法可成功制备大鼠脑梗死模型,其中最为经典的是开颅阻断法,但由于其对术者要求较高,使得该模型的运用低于线栓法[5-8]。2017年6—10月,我们采用右侧颞下入路进行开颅,形成约4 mm×4 mm大小骨窗后,显露右侧嗅束至大脑下静脉之间的这一段MCA,使用双极电凝,采用低功率电凝法将这段MCA凝闭后切断,成功制备了MCAO模型。该方法可在直视下明确阻断相应供血动脉,模型的稳定性较高,现将该方法介绐如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级SD雄性大鼠60只,体重约220 g,购自北京华阜康生物科技股份有限公司。
1.1.2 主要试剂 3.6%水合氯醛,10%多聚甲醛,Zeiss手术显微镜(型号为OPMI Pico),微型手持式颅钻(深圳市瑞沃德生命科技有限公司),显微外科手术器械1套,常规手术器械若干。
1.2 方法
1.2.1 开颅电凝法大鼠大脑中动脉脑梗死模型的建立 本实验由青海大学附属医院伦理委员会批准,遵循青海大学医学院实验动物保护和使用准则。本实验组共30只雄性SD大鼠,术前12 h禁食,但不禁水。采用3.6%水合氯醛,对大鼠按1 mL/100 g体重的剂量进行腹腔注射麻醉。右侧颞部备皮,取左侧卧位,固定于手术台上,局部采用碘酒、酒精消毒后,取右侧颞部直切口,切口垂直于外眦与外耳道连线,并经过其连线的中点,切口长约2 cm,切开皮肤,游离皮下组织,注意保护面神经。然后“T”形切开颞肌,首先在颞上线下缘2~3 mm,平行于颞上线切开颞肌筋膜及颞肌;再于该切口中点,垂直于该切口纵形切开颞肌,将颞肌从颅骨表面剥离,用丝线牵开。用直径为1 mm颅骨钻形成一直径约4 mm×4 mm骨窗,然后轻轻抬起脑组织,用磨钻进一步将颅底骨质打薄,显露MCA、大脑下静脉及深部的嗅束。充分显露右侧嗅束至大脑下静脉之间的这一段MCA,使用双极电凝,采用低功率将该段MCA凝闭后切断,然后明胶海绵局部覆盖,分层缝合颞肌及皮肤。另外,设置对照组30只,亦采用右颞直切口,切开颞肌,颅骨钻孔形成同样大小骨窗,显露MCA,但不对其进行电凝,操作完毕后,缝合肌肉及皮肤。两组大鼠术中均放置于恒温毯上,直至术后清醒。见图1。两组大鼠术后均连续3 d肌内注射青霉素4 000 U/d。
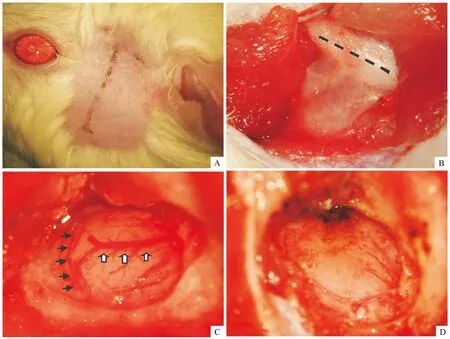
A:手术切口垂直于颧弓,经过外眦与外耳道连线,长约2 cm,切口下缘至颧弓;B:“T”形切开颞肌,并向两侧牵开,显露颞骨及颧弓(黑色虚线);C:右侧颞下入路开颅,并磨平颅底,显露大脑下静脉(白色箭头)及大脑中动脉(黑色箭头);D:已通过电凝并切断大脑中动脉,局部大脑表面略苍白
图1手术操作步骤
1.2.2 大鼠神经功能缺陷体征的观察 所有大鼠均在模型成功后观察大鼠行为。参考Longa评分标准进行神经功能评分:0分,无神经功能缺陷征;1分,一侧前肢部分屈曲;2分,一侧前肢完全屈曲;3分,向偏瘫侧转圈;4分,向偏瘫侧倾倒;5分,不能自发行走,意识丧失[9]。
1.2.3 TTC染色 所有实验大鼠于术后24 h断头后取脑,观察局部是否存在颅内血肿、蛛网膜下腔出血或脑组织挫伤,然后用生理盐水将脑组织反复冲洗干净,-20℃放置15 min后取出,行冠状位切片,厚度为2 mm,置2% 2,3,5-三苯基氯化四氮唑(TTC)中,避光37℃染色约20 min后,4%多聚甲醛固定,然后进行图像采集。
1.2.4 脑梗死体积的测定 以图像分析软件(Image Pro-Plus,IPP)对脑梗死体积进行分析,采用梗死率表示梗死体积,梗死体积比率=(各切面梗死面积相加之和/各切面面积相加之和)×100%[4]。
2 结果
2.1 神经功能缺失评分 本组实验模型大鼠共30只,除外1只术后1 h死亡外,共有模型大鼠29只,经神经系统检查,其中26只出现左侧肢体肌力减弱,左侧肢体疼痛觉减退,平地行走时向右侧转圈,而其余3只实验大鼠未见明显神经功能缺失表现。采用Longa的神经功能评分法,所有实验组大鼠评分均在3~4分,其中18只大鼠神经功能评分达3级,8只达4级,另外3只大鼠未见明显神经系统缺失表现,为0级。对照组30只大鼠,均无神经功能缺失表现,所有大鼠神经功能评分为0分。
2.2 脑组织的观察及TTC染色 所有大鼠取脑观察,除2只模型大鼠术区表面出现少量血肿外,其余大鼠无蛛网膜下腔出血、无明显脑挫伤、Willis动脉环无血栓形成。2只实验组大鼠行TTC染色,未见梗死灶。其余实验组大鼠梗死侧大脑半球外侧面及基底节区大部分颜色苍白,其余部分染成均匀红色,经IPP软件分析,各实验大鼠脑梗死体积基本一致,梗死体积约(29.85±7.43)%。对照组大鼠脑组织表面均无血肿,无蛛网膜下腔出血,Willis动脉环无血栓形成,经TTC染色,所有脑组织均染成均匀红色,无梗死灶发生。见图2、3。
2.3 模型成功率 两组实验大鼠共60只,在麻醉过程中,无麻醉意外死亡。实验组30只,3只实验大鼠在双极电凝过程中发生血管破裂出血,经反复烧灼,局部脑组织出现挫裂伤,其中1只大鼠在模型操作结束后1 h死亡,经解剖发现右侧术区出现大量血肿。术后2只大鼠在取脑组织时,观察到脑组织表面出现少量血肿。另有2只大鼠行TTC染色,未见梗死灶。将脑组织挫伤及死亡的3只大鼠及术后无梗死灶的2只实验大鼠剔除后,本组30只大鼠,成功制备模型大鼠25只,本组模型大鼠总成功率达83.3%。本组存活29只大鼠,经TTC染色共有27只大鼠出现脑梗死灶,梗死灶的发生率达93.10%。
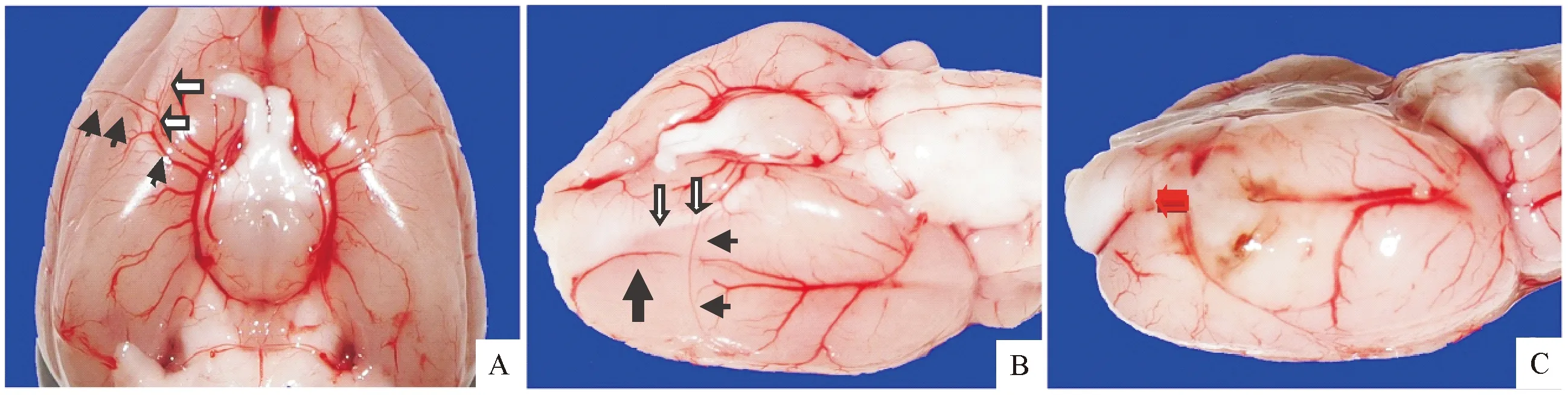
A:正常大鼠脑组织腹侧面观,黑色箭头为大脑中动脉,白色箭头为嗅束;B:正常大鼠脑组织右侧面观,黑色箭头为大脑中动脉,白色箭头为嗅束,黑色粗箭头提示为大脑下静脉;C:实验组大鼠脑组织照片,红色箭头提示为双极电凝烧灼后切断的大脑中动脉断端
图2各组大鼠脑组织观察
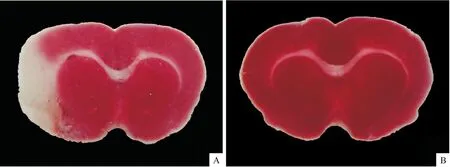
A:实验组右侧基底节区及大脑皮层大面积脑梗死;B:对照组大鼠未见脑梗死表现
3 讨论
脑卒中是当今世界上危害人类健康的最主要疾病之一,且其发病率呈逐年上升趋势[1,10]。脑卒中分为缺血性和出血性两大类,其中缺血性脑卒中的发病率显著高于出血性脑卒中。由于大鼠与人类具有极其相似的脑血管网,且因价格低廉等特点,大鼠大脑中动脉阻断脑缺血模型为目前研究缺血性脑卒中的主要动物模型[5]。目前有多种方法可成功制备大鼠脑梗死模型,其中最为经典的是开颅阻断法,但由于其对术者要求较高,使得该模型的运用低于线栓法,此外,其他还包括光化学法、双侧颈动脉阻断、单侧颈动脉阻断+低温或低血压法、全脑血管阻塞法等[3-4,7,11]。开颅法采用经颞下入路,在充分显露大脑中动脉各段后,在直视下予以双极电凝凝闭后切断,其优点是缺血效果准确可靠,模型成功率较高[7]。但该术式对操作者要求相对较高,需要具备一定显微外科技术,且开颅创伤相对较大,并发颅内感染的概率相对较高,并且经电凝后切断的血管无法进行再灌注,不能采用该方法进行再灌注损伤的研究。但采用开颅法亦可成功制备缺血再灌注损伤模型,陈前芬等[12]通过开颅法显露Wistar大鼠的MCA,然后采用特制的显微动脉夹将MCA夹闭,然后在相应时间点去除动脉瘤夹,成功用开颅法制备了MCA的缺血再灌注损伤模型。
在进行开颅法大鼠MCAO模型时,麻醉后,我们将实验动物左侧卧位置于操作台,无需固定。手术切口的选择与其他研究者相同,均选择通过耳眦线中点的直切口。一般情况下,在切开头皮后,即可观察到面神经跨过颞肌斜行向前,为保护面神经,只需要将面神游离后,向颧弓下缘移位即可。在颞肌的处理上,我们采用了“T”型切开,可增加颞肌及颧弓的暴露,同时该方法在颞上线上保留一条肌肉,以利于术后缝合,避免了实验大鼠同侧咬合力的下降。骨窗范围以4 mm×4 mm为宜,在暴露大脑中动脉的远端后,可通过此部位MCA逆行追踪至其中段及近端。
以嗅束和大脑下静脉这两个结构,将MCA分为3段:起始段位于MCA的起点至嗅束内侧;第二段为嗅束至大脑下静脉之间,亦称为中段;第三段为大脑大静脉以远的MCA及其终末支[5]。其中MCA的末段和终末分支均位于大脑半球背外侧面,而MCA的起始段及中段位于大脑腹侧面。在本实验中,我们拟阻断MCA中段,因其位于大脑腹侧面,为减轻脑组织的牵拉,我们将颅底骨质磨薄,以增加显露空间。在使用微钻磨除颅底骨质时,为避免对硬脑膜及脑组织的误伤,我们采用显微镊或显微神经剥离子对脑组织进行保护,并反复予以生理盐水冲洗,以达到降温及保持术野干净的目的。
然后调整显微镜角度,从颅底方向观察,显露MCA后,无需切开硬脑膜,将显微双极电凝置于MCA中段两侧,予以反复多次、低功率电凝后切断MCA,在电凝过程中,为减轻对周围脑组织的损伤,可采用小块明胶海绵绵对周围脑组织进行保护,同时给予生理盐水反复冲洗降温。在双极电凝过程中,若功率过大,易导致局部脑组织并发挫裂伤,MCA断裂出血;而功率过低,亦可能出现电凝不确切,切断MCA后,断端仍出血。在本实验中,3只实验大鼠在术中出现MCA破裂出血,原因系局部双极电凝的使用不当,导致局部电凝过度,因此,在手术操作中,应从低功率电凝开始进行,逐步提高电凝功率,以达到彻底凝闭MCA的目的。在这3只术中MCA破裂的大鼠,其中1只模型大鼠在术后1 h发生死亡,经解剖发现,术区大量血肿,多考虑术中MCA破裂出血后,虽经电凝止血,但MCA的电凝不彻底,导致术后MCA断端再次出血。此外,在本实验中,另有2只大鼠在取脑组织时,观察到脑组织表面有少量血肿,但血肿与局部脑组织无明显粘连,考虑该血肿不是由脑组织来源的血管断裂所致,而该出血可能是颞肌渗血所致。
Bederson等[8]根据MCA阻断的不同部位,发现阻断从MCA起始部至大脑下静脉这一段MCA,或嗅束近端2 mm至大脑下静脉这一段MCA时,脑梗死的发生率均为100%。在本实验中,我们将嗅束至大脑下静脉这一段MCA予以凝闭,术后24 h,经TTC染色证实脑梗死发生率为100%,脑梗死范围基本相同,变异性较低,脑梗死面积达(29.85±7.43)%,与Bederson等[8]研究结果相符。
此外,在实验中,在无神经功能缺失表现的3只实验大鼠中,行TTC染色证实仅1只模型大鼠存在确切脑梗死病灶,大脑皮层及基底节区均有明显梗死灶,且梗死灶范围与其他有神经系统缺失表现者基本相似。而其余2只神经功能评分正常的模型组大鼠,经TTC染色,脑组织切片未见梗死灶,分析原因可能是因为侧支循环的存在。温学花、杨利霞等[13-14]采用MRI扩散加权成像(DWI),对雄性SD大鼠进行线栓模型的成功率评判,发现神经功能缺失评分对脑梗死模型的评判敏感性仅为89%。因此,不能通过单纯的神经功能评分来判定脑梗死模型的成功与否,在模型制备过程中,可结合MRI、超声多普勒监测脑血流量等其他非有创性检测,协助模型成功率的判定。
综上所述,经改良,我们采用开颅电凝法成功建立了SD大鼠大脑中动脉脑梗死模型,该模型具简便、易行、稳定、可靠特点,为脑梗死模型的进一步研究提供了动物模型。

