Apelin-13对人巨噬细胞极化的影响*
孙梦娜, 徐予△, 刘洪智, 岳凤阳, 郝家亮, 陈昌, 孙志阔, 张春丽
1郑州大学人民医院(河南省人民医院)心血管内科(河南郑州 450003); 2阜外华中心血管病医院心内科(河南郑州 450018)
Apelin是1998年发现的G蛋白耦联受体APJ的内源性配体,广泛存在于机体多种器官,如心、肺、肾、肝、脂肪组织、胃肠道、脑、肾上腺、内皮、血浆等。Apelin-13是含有13个氨基酸的短肽,是人体血液中常见的Apelin亚型之一,具有较强的生物活性,其在外周组织和中枢系统中均有表达。已有研究显示Apelin-13参与机体多个系统的病理生理过程,具有调控细胞增殖、自噬、氧化应激和凋亡的作用,故Apelin-13的研究具有一定的临床意义[1-2]。而巨噬细胞可以在不同的刺激条件下分化为经典的促炎亚群M1型或选择性的抗炎亚群M2型。M1型巨噬细胞主要分泌促炎细胞因子,比如白细胞介素(IL)-6、IL-1β、肿瘤坏死因子-α(TNF-α)等,表达CD86、CD16/32等[3]。M2亚型为选择性激活亚型,其作用与M1亚型相反,主要以分泌IL-10,表达CD206为主。有研究显示Apelin可通过调节核因子-κB(NF-κB)/JNK通路的基础机制抑制炎症,在缺氧条件下,Apelin可保护巨噬细胞免受凋亡,并可增强细胞迁移[4],该结论具有一定的临床意义。本研究旨在探讨不同浓度Apelin-13对THP-1来源的人巨噬细胞极化的影响,其具有一定的临床应用前景。
1 材料与方法
1.1 材料 本实验于2017年12月至2018年5月在郑州大学人民医院中心实验室完成。人单核细胞THP-1购自中国科学院干细胞库(引进于American Type Culture Collection ATCC)。RPMI 1640培养基、胰蛋白酶均购自Solarbio公司,体积分数 10% 胎牛血清 (fetal calf serum,FCS) 购自Gibco公司,佛波酯(PMA)和脂多糖(LPS) 购自 Sigma 公司,重组人γ干扰素(IFN-γ) 购自 Peprotech 公司,Apelin-13购自Cayman公司,抗体 FITC CD86 和 PE CD206 购自EXBIO公司,人转化生长因子-β1(TGF-β1)、人IL-1β、人TNF-α、人IL-6、人IL-10、人IL-4 ELISA 试剂盒购自欣博盛公司。
1.2 方法
1.2.1 人巨噬细胞的体外诱导 人单核细胞THP-1复苏后加入5 mL含10%FCS的RPMI 1640培养基(包含青霉素1 000 U/mL、链霉素100 mg/mL和谷氨酰胺2 mmol/L)后转移至25 cm2细胞培养瓶中,在37℃,5%CO2培养箱中培养,每2~3 d换液传代。待THP-1细胞状态良好时离心去除培养基,用PMA 50 ng/mL刺激培养THP-1,并接种在6孔板中,用加入体积分数10% FCS的RPMI 1640培养基培养48 h,获得未分化巨噬细胞(M0)[5];参照Martinez等[6]的方法将M0 进一步诱导,采用IFN-γ 20 ng/mL和LPS 200 ng/mL刺激培养48 h,诱导出M1型巨噬细胞,流式细胞仪鉴定细胞表型后进行下一步实验。
1.2.2 不同浓度Apelin-13干预诱导后的巨噬细胞 将生长状态良好的诱导后的M1型人巨噬细胞胰蛋白酶处理后以5×104/孔浓度接种于12孔培养板上。贴壁生长6 h后,分别添加不同终浓度(100、500、1 000 ng/mL)的药物Apelin-13(分别为低浓度组、中浓度组、高浓度组),未添加药物干预的人巨噬细胞组设为空白对照组,于37℃、5%CO2、饱和湿度的培养箱中培养48 h。
1.3 细胞膜蛋白表达的流式细胞仪检测 分别收集THP-1来源经 PMA+IFN-γ+LPS 诱导刺激48 h的贴壁细胞及Apelin-13干预后的贴壁巨噬细胞,调整至每管1×106,PBS洗1次,50 μL鞘液重悬,加入PE CD206 及FITC CD86, 避光室温孵育30 min, 鞘液洗2遍,再用鞘液500 μL 重悬后用 BD FACS Calibur 流式细胞仪检测。根据实验分组,未与抗体作用的巨噬细胞作为阴性对照。
1.4 ELISA检测细胞因子分泌 分别收集对照组及不同浓度Apelin-13干预组的细胞培养上清。按照试剂盒说明操作, 将标准品及上述收集的培养上清加入相应孔内,100 μL/孔,37℃孵育90 min,洗板5次,分别加入生物素标记人的 IL-6/TNF-α/IL-4/IL-10/TGF-β1/ IL-1β 抗体稀释液及工作液(100 μL/孔),37℃孵育60 min; 洗板5次,分别加入酶结合物稀释液及工作液(100 μL/孔),37℃ 避光孵育30 min; 洗板5次,加入TMB显色工作液(100 μL/孔),37℃避光孵育 15 min;加入终止液(100 μL/孔),测定450 nm的吸光度(OD450)值。
2 结果
2.1 THP-1细胞来源的巨噬细胞的诱导和鉴定结果 THP-1细胞呈类圆形,悬浮生长(图1-A),经PMA+IFN-γ+LPS诱导后细胞形态逐渐变不规则,胞体增大,细胞表面伸出伪足,呈树突状、梭状及放射状,6 h开始逐渐贴壁,24 h基本贴壁,48 h后完全贴壁生长成巨噬细胞(M1,图1-B)。流式细胞仪检测显示M1型巨噬细胞分化比例达到92%以上,适用于后续试验。
2.2 M1型巨噬细胞细胞因子分泌水平的检测 通过ELISA法检测了空白对照组及不同浓度Apelin-13干预组中巨噬细胞几种细胞因子的分泌水平(OD450值), 结果如表1所示, 与空白对照组相比,不同浓度Apelin-13干预组中巨噬细胞的IL-6、IL-1β、TNF-α的分泌水平明显降低(P<0.05),且随Apelin-13干预浓度升高,细胞因子分泌量逐渐减少,但中浓度组与低浓度组相比,细胞因子IL-1β的分泌量减少不明显,差异无统计学意义(P>0.05);低浓度组与空白对照组相比,细胞因子TNF-α的分泌量减少不明显,差异无统计学意义(P>0.05)。而TGF-β1、IL-10、IL-4的分泌增加,尤其 TGF-β1分泌水平明显增加(P<0.01),且呈Apelin-13浓度依赖性,但中浓度组与低浓度组相比,细胞因子IL-10、TGF-β1的分泌量增加不明显,差异无统计学意义(均P>0.05)。
2.3 M1型巨噬细胞表面分子表达的检测 对已报道M1型巨噬细胞的标志CD86和M2型巨噬细胞的标志CD206的表达进行了FACS检测,结果如表2所示, Apelin-13干预后巨噬细胞表面CD86的表达阳性率较空白对照组显著降低(P=0.000),CD206的表达阳性率较空白对照组有显著增加(P=0.000), 由低浓度组至高浓度组,CD86的阳性率逐渐减低,但中浓度组较低浓度组略有减低,差异无统计学意义(P=0.077),而CD206的阳性率依次增加,但高浓度组较中浓度组略有增加,差异无统计学意义(P=0.058)。

A: 未诱导的THP-1细胞; B:诱导刺激后的M1细胞

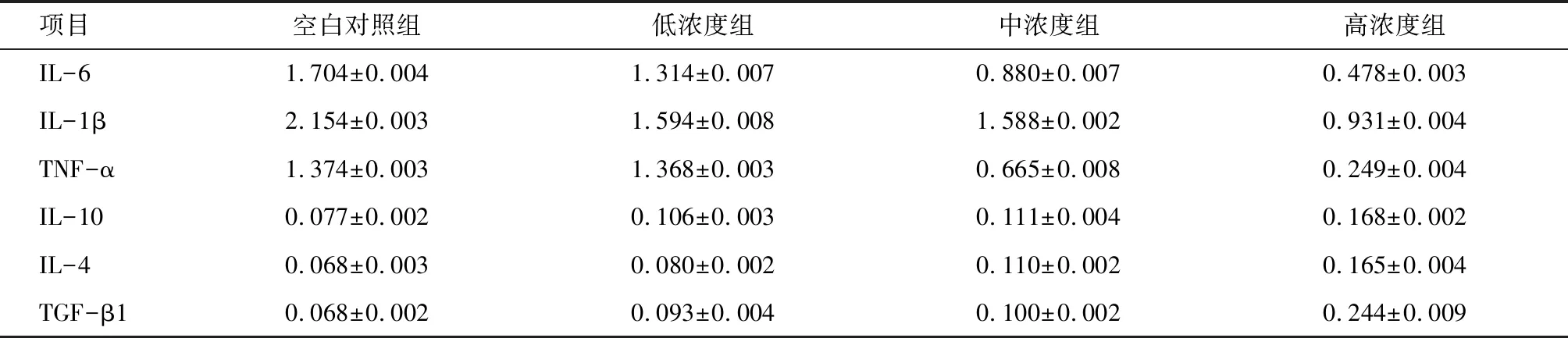
项目空白对照组低浓度组中浓度组高浓度组IL-61.704±0.0041.314±0.0070.880±0.0070.478±0.003IL-1β2.154±0.0031.594±0.0081.588±0.0020.931±0.004TNF-α1.374±0.0031.368±0.0030.665±0.0080.249±0.004IL-100.077±0.0020.106±0.0030.111±0.0040.168±0.002IL-40.068±0.0030.080±0.0020.110±0.0020.165±0.004TGF-β10.068±0.0020.093±0.0040.100±0.0020.244±0.009
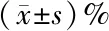

项目空白对照组低浓度组中浓度组高浓度组CD8683.633±0.75121.400±0.40020.467±0.58614.733±0.451CD20612.067±1.73965.967±0.66676.133±1.00278.134±0.657
3 讨论
巨噬细胞存在一系列连续的功能状态,M1型与M2型分属两个极端[7],M1型巨噬细胞通过分泌促炎细胞因子IL-6、IL-1β、TNF-α等以及驱化因子参与正向免疫,发挥免疫监视功能;M2型巨噬细胞通过分泌抑制性细胞因子IL-10 、TGF-1β 、IL-4等对免疫应答进行负向调节[8]。
有研究报道巨噬细胞不具有APJ受体,且不能对Apelin产生反应[9-10],而本研究发现:与空白对照组相比,随药物Apelin-13浓度的增加,Apelin-13干预组中棒状、放射状以及树枝状形态的巨噬细胞逐渐减少,细胞变圆,黏附性增强,细胞内颗粒增多;且流式细胞术鉴定发现巨噬细胞表面标志CD206阳性率依次增加,巨噬细胞表面标志CD86均为阴性(表2)。说明Apelin可以抑制M1型巨噬细胞的活性,进一步促进M1型巨噬细胞向抗炎M2型分化,进而导致IL-6、IL-1β、TNF-α等炎性因子表达降低,TGF-1β、 IL-10、IL-4等抗炎因子表达增加(表1)。已有文献报道Apelin-13可以通过抑制巨噬细胞来源的脂蛋白脂肪酶(LPL),从而减少脂质积累以及促炎细胞因子分泌,如IL-6、IL-1β、TNF-α[11-12],该结论与本研究结果吻合,表明Apelin-13其在机体免疫反应调节中起一定作用。巨噬细胞可借 Toll 样受体4(TLR4) 或 IL-1 信号激活 IκB 激酶(IKK) 复合物,通过 TLR2/核因子 κB(NF-κB) 关键炎症信号通路调节巨噬细胞的 M1型活化[13-15], 而Apelin可抑制NF-κB /JNK信号通路,降低磷酸化NF-κB和磷酸化JNK的表达[4]。因此,这一机制可能是Apelin-13影响M1型巨噬细胞活性的原因。但本研究的一个局限性是没有进行拮抗实验,因此不能证实Apelin-13的应用与Apelin/APJ系统直接相关。
综上所述,Apelin-13可以促进THP-1来源巨噬细胞由M1型向M2型分化,抑制M1型巨噬细胞分泌促炎细胞因子,促进抗炎细胞因子分泌。且细胞因子的分泌与Apelin-13呈一定的浓度依赖性。

