坎地沙坦对脂多糖刺激巨噬细胞炎症因子释放的影响
艾文伟 张明 雷梦觉 胡杰 孟哲 高登峰
江西省人民医院二部1心内二科,2心内一科(南昌330006);3西安交通大学第二附属医院心内科(西安710004)
过去的二十年中,越来越多的研究表明:慢性炎症在动脉粥样硬化发病过程中起到了举足轻重的作用;炎性细胞富集、炎症因子释放和脂质氧化堆积均伴随炎症反应的发生[1-2]。巨噬细胞以及由巨噬细胞吞噬脂质形成的泡沫细胞在斑块内聚集是包括人类在内的哺乳动物血管内粥样斑块的主要病理改变[3]。因此,减少巨噬细胞的迁入和泡沫细胞的生成将明显减缓粥样斑块的形成。
Toll样受体是一组高度保守的病原模式识别受体,其对免疫和炎症反应具有多样的调节作用,因此在天然免疫过程中起到关键作用,而Toll受体4(TLR4)是这一家族的重要成员之一[4]。TLR4主要分布于包括巨噬细胞、树突状细胞及T细胞在的内多种免疫细胞[5];当其与内毒素(LPS)等特异性配体结合后,可上调NF-κB(p65)等转录因子,增加多种炎症因子的表达,从而诱发炎症反应[6-8]。在动脉粥样硬化等多种疾病中,血管、心脏等靶器官内TLR4的表达明显增加,提示以TLR4主导的天然免疫过程可能部分参与了上述病变的发展过程[9]。坎地沙坦是临床常用的AT1受体拮抗剂,临床用于治疗高血压[10]、糖尿病肾病[11]以及慢性心功能衰竭[12]。已有研究提示坎地沙坦可抑制LPS诱导的脑及脾脏炎症反应[13-14];减少斑块面积[15]。本研究旨在探寻坎地沙坦对LPS诱导巨噬细胞炎症因子释放的影响及机制,以期拓展改善动脉粥样硬化进程的细胞学机制。
1 材料与方法
1.1 药品及试剂坎地沙坦(日本Wako公司),RPMI1640完全培养液(美国Gibco公司),胎牛血清(北京transgen公司)及real-time RT-PCR试剂盒(北京transgen公司),四氮唑蓝(MTT)和内毒素(LPS)(美国Sigma公司),TNF-α和IL-1β ELISA试剂盒(美国BioSource International公司),兔抗鼠TLR4、髓样分化因子88(Myd88)、NF-κB(p65)和β-actin抗体(Santa Cruz Biotechnology,Santa Cruz,CA,USA)。
1.2 巨噬细胞培养小鼠巨噬细胞株RAW264.7细胞株购于中科院上海细胞库,培养于完全RPMI1640培养液中,含12%胎牛血清、青霉素(100 U/mL)和链霉素(100 U/mL)。37℃下置于5%CO2培养箱中,传代至4~6代后进行试验。
1.3 实验分组将细胞分为5组:对照组、LPS干预组、LPS+坎地沙坦10-7mol/L、LPS+坎地沙坦10-6mol/L和LPS+坎地沙坦10-5mol/L。LPS的浓度为500 ng/mL。
1.4 细胞活性测定采用MTT比色法测定细胞活性[16]。
1.5 实时定量PCR检测TLR4、MyD88和NF-κB(p65)mRNA的表达按4×105个/孔将细胞接种于6孔板,含血清培养基培养至70%~80%融合,无血清培养基孵育12 h。不同浓度坎地沙坦无血清培养基孵育1 h后,加入LPS(500 ng/mL)刺激4 h,用Trizol试剂(北京Transgen公司)提取各组总RNA。逆转录试剂盒(Transgen公司,北京)将其反转录为cDNA。
1.6 免疫印迹检测TLR4、MyD88和NF-κB(p65)蛋白的表达细胞接种于6孔板培养至80%~90%融合。换用无血清培养基12 h。后以不同浓度坎地沙坦孵育1 h,加入LPS刺激9 h,RIPA细胞裂解液提取总蛋白。10%SDS-PAGE凝胶电泳,半干转膜仪转膜。化学发光法检测条带,Quantity one软件行图像分析。
1.7 ELISA测定白介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)水平细胞接种于96孔板,不同浓度坎地沙坦孵育1 h,加入LPS刺激24 h,收集各孔中上清液。ELISA试剂盒测定IL-1β和TNF-α浓度。自动酶联免疫吸附仪在450 nm处读取吸光度值,绘制标准曲线,据此计算各组定IL-1β和TNF-α浓度。
1.8 统计学方法所有统计学分析均应用SPSS 19.0软件进行,结果采用均数±标准差表示,组间比较使用单因素方差分析,多重均数比较使用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 坎地沙坦对细胞活性的影响见表1,浓度在10-8~10-4mol/L范围内时,坎地沙坦对RAW264.7细胞活性无显著影响。因此,后续实验中选用10-7~10-5mol/L浓度的坎地沙坦进行进一步干预实验。
2.2 坎地沙坦对 TLR4、MyD88及 NF-κB(p65)mRNA表达的影响LPS刺激4 h后,可明显上调TLR4、MyD88及NF-κB(p65)的mRNA表达。坎地沙坦预处理1 h后,再给予相同浓度LPS刺激,与LPS刺激组比较,TLR4、MyD88和NF-κB(p65)的mRNA表达呈现剂量依赖性降低(图1)。提示坎地沙坦可有效抑制TLR4炎症通路的激活。
2.3 坎地沙坦对TLR4、MyD88及NF-κB(p65)蛋白表达的影响500 ng/mL LPS刺激9 h后,TLR4、MyD88和NF-κB(p65)的蛋白表达明显上升。坎地沙坦预处理1 h后,再给予相同浓度LPS刺激9 h,TLR4、MyD88和NF-κB(p65)的蛋白表达较LPS组明显下降,并呈剂量依赖性(图2)。提示坎地沙坦可抑制TLR4通路相关因子蛋白表达。
2.4 坎地沙坦对IL-1β和TNF-α分泌的影响LPS刺激24 h后,细胞上清液中IL-1β和TNF-α分泌明显增加。不同浓度坎地沙坦预处理可呈剂量依赖性降低IL-1β和TNF-α浓度(图3)。
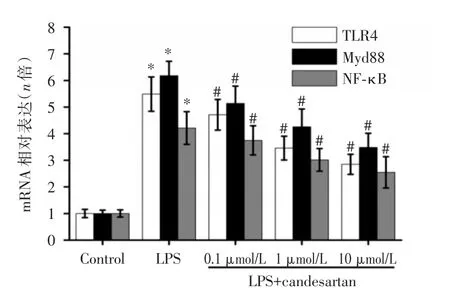
图1 坎地沙坦对RAW264.7细胞TLR4、MyD88及NF-κB(p65)mRNA表达的影响Fig.1 Effects of candesartan on the mRNA expression of TLR4,MyD88 and NF-κB(p65)in LPS-stimulated RAW264.7 cells
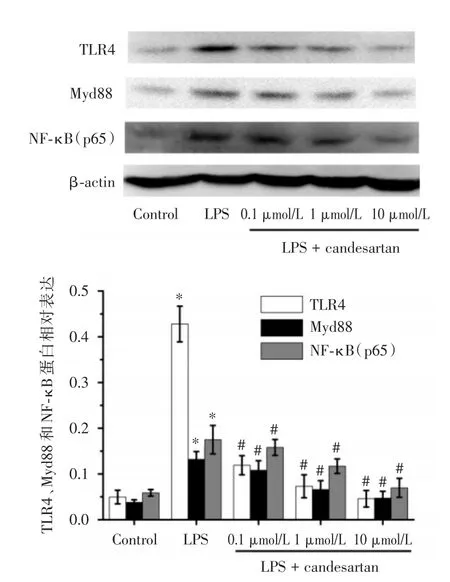
图2 坎地沙坦对RAW264.7细胞TLR4、MyD88及NF-κB(p65)蛋白表达的影响Fig.2 Effects of candesartan on the protein expression of TLR4,MyD88 and NF-κB(p65)in LPS-stimulated RAW264.7 cells
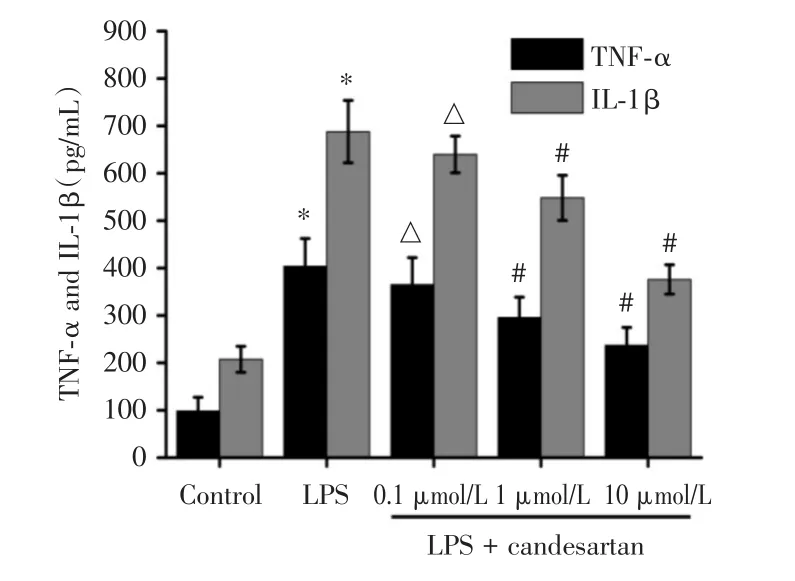
图3 坎地沙坦对IL-1β和TNF-α分泌的影响Fig.3 Effects of candesartan on the expression of IL-1β and TNF-α in LPS-stimulated RAW264.7 cells
3 讨论
研究表明,Toll样受体可调控天然免疫、抗原呈递和获得性免疫等多个免疫和炎症环节,而这些作用主要是通过控制细胞因子表达得以实现的[6]。目前已经发现10余个Toll样受体家族成员,均可通过与TIR结构域接头分子(TIRAP)/Myd88结合,将外源性信号传入胞内,从而促进细胞因子、趋化因子及膜表面分子的合成[17]。TLRs参与了粥样硬化斑块发生、成熟和最终破裂的各个发展阶段,通过多重效应促进斑块的形成和易损性[18-20]。与配体结合后,TLRs可通过Myd88依赖的信号传导通路诱导NF-κB核转位,继而上调IL-6、IL-1β等炎症因子的表达;亦可能通过非Myd88依赖的信号转导通路诱导干扰素调节因子3(IRF3)发生核转位,从而增加干扰素分泌。上述途径在促进斑块的形成和易损性中起重要作用[21]。研究表明,人及动物模型的粥样斑块组织内TLR4的表达明显升高[19];高脂饮食的TLR4基因敲除小鼠动脉粥样斑块体积显著减小;同时稳定性增强[22]。提示TLR4及其下游通路的激活是粥样硬化疾病进展的一个重要促进因素。
本研究重点聚焦于TLR4及其下游通路的激活,及由此引发的炎症因子释放和炎症反应的扩大。在给与单核细胞LPS刺激后,TLR4/Myd88 mRNA水平明显升高,NF-κB(p65)合成增加。NF-κB由P65和P50二聚体组成,活化的NF-κB随即从胞浆向核内转位,与DNA上的靶向序列结合,进而调节下游多个因子的活化。因此NF-κB二聚体的激活已被认为是炎症反应的关键通路之一[23]。本研究发现,给予巨噬细胞LPS刺激后,TLR4及Myd88表达明显增加;伴随NF-κB(p65)合成增加,下游IL-1β和TNF-α的分泌显著升高。以上结果说明Myd88依赖性TLR4信号通路的激活参与了LPS诱导的巨噬细胞炎症因子分泌的过程。
血管紧张素Ⅱ1型受体阻滞剂(ARB)类药物被广泛用于原发性高血压、糖尿病肾病及慢性心功能不全等疾病[11-13]。多项试验证实:ARB类药物通过抑制氧化应激反应和改善内皮功能等机制,能够有效地减轻高糖诱发的心肌炎症反应[24],抑制内膜增生和减少平滑肌增殖等[25]。慢性心功能不全和高血压患者接受坎地沙坦治疗一段时间后,其血浆中C反应蛋白、白介素-6(IL-6)及单核细胞趋化蛋白-1(MCP-1)等炎症因子水平明显下降[25]。坎地沙坦能够有效抑制LPS诱发的小鼠肾上腺炎症反应[15];通过降低TLR4通路激活,调节天然免疫减轻LPS引起的小鼠脾脏炎症反应[27]。本研究中坎地沙坦可以有效降低巨噬细胞TLR4表达;抑制Myd88依赖性TLR4通路的激活;减少NF-κB依赖性炎症因子的释放。巨噬细胞在粥样硬化发病过程中的重要作用早已被学术界广泛认同,而TLR4又在巨噬细胞膜表面高表达。因此,笔者推测坎地沙坦通过对巨噬细胞TLR4炎症通路的抑制,应该能够起到延缓粥样斑块形成的作用。本研究能为坎地沙坦在粥样硬化疾病治疗方面的应用提供一定的依据。

