食管癌合并迷走右锁骨下动脉的诊治分析
黄伟钊 吴颖猛 叶红雨 梁毅 吴汉明 姜海明 傅剑华
1中山大学肿瘤防治中心胸科,华南肿瘤学国家重点实验室,广东省食管癌研究所(广州510060);2中山市人民医院心胸外科(广东中山528403)
迷走右锁骨下动脉(aberrant right subclavian artery,ARSA)是指右锁骨下动脉直接开口于左锁骨下动脉远端的左位降主动脉上,其发病率约为0.16%~4.4%[1],是主动脉弓及其分支变异中最为常见的一种,多数无明显临床症状。而食管癌的发病率位于恶性肿瘤的第8位,我国是食管癌高发国,发生在我国的食管癌病例约占全球新发病例的50%[2]。因主动脉与食管的解剖关系密切,ARSA合并食管癌在临床上并不少见,对于诊断和治疗上的难度都会增加,诊疗策略上也往往有一定的影响。中山市人民医院在2013-2018年共收治5例ARSA合并食管的患者,现对其诊治情况作一分析,以为临床医师的诊疗决策上提供参考。
1 资料与方法
1.1 一般资料中山市人民医院2013年6月至2018年7月共收治合并ARSA的食管癌5例,全部为男性患者,年龄为53~70岁。全部患者均有不同程度的吞咽困难症状。患者均经颈胸腹CT增强、内镜、食管造影等检查,胸上段病灶行支纤镜检查;均获得明确的病理学诊断,其中病灶位于胸上段2例,胸中段3例。病灶平均长度为4.6(2.0~7.2)cm。分期方法按AJCC2008版临床分期。患者一般资料见表1。
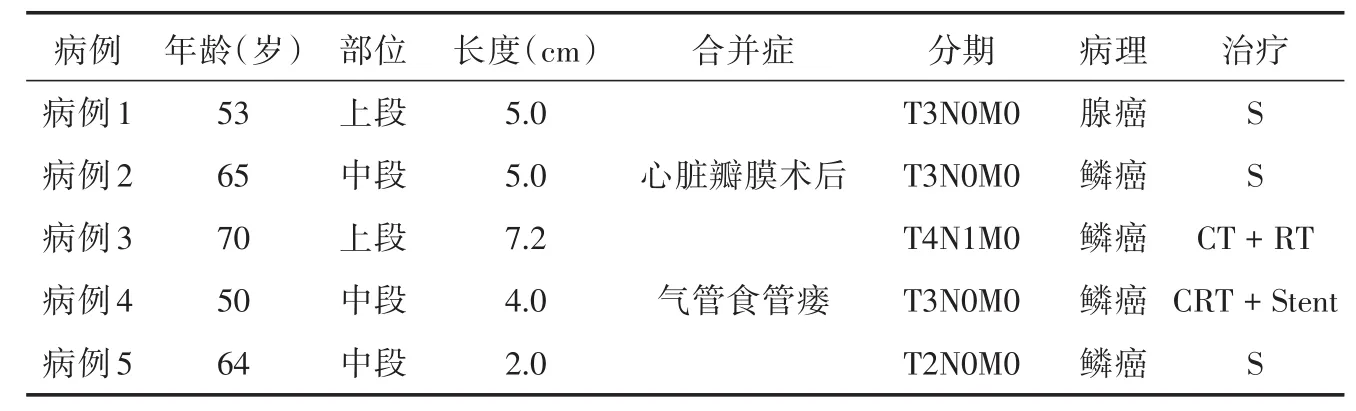
表1 5例患者的一般临床资料Tab.1 The clinical data of 5 cases esophageal carcinoma involving ARSA
1.2 治疗情况
1.2.1 手术方法行胸腹腔镜联合食管癌切除术。采用侧俯卧位、压力为6~8 cmH2O的人工气胸,胸腔镜经右胸切除食管、清扫纵隔淋巴结包括双侧喉返神经旁淋巴结;腹腔镜游离胃,清扫腹腔淋巴结;上腹部小切口把胃拉出体外制作管状胃,游离胸骨后隧道,管状胃经胸骨后/食管床路径上提,于左颈部行机械吻合。
1.2.2 放疗方案放疗方式采用容积调强放疗(VMAT),治疗剂量为60 Gy/30 F。采用热塑体模及AB胶联合固定,CT扫描模拟定位,5 mm层厚连续扫描病变区域。图像经数字化传输,使用瓦利安Eclipse 10.0计划系统。根据食管造影和纤维食管镜显示病变长度以及CT显示外侵深度范围勾画靶区,GTV四周各外放0.5~0.8 cm、上下方向各外放3.0 cm为CTV,CTV再均匀外放0.5 cm为PTV;同时勾画邻近组织和器官如脊髓、气管、心脏及双侧肺。靶区剂量满足95%以上体积PTV>95%的处方剂量,危及器官未超出剂量限制要求。用剂量体积直方图评价治疗计划。
1.2.3 化疗方案多西他赛20~30 mg/m2D1,顺铂20~30 mg/m2D1,每周1次,共5周。
1.2.4 食管支架植入术在DSA下置入导丝,穿过食管狭窄管腔后,置入带膜金属支架。
2 结果
2.1 接受同期放化疗1例根据CT分型,全组5例患者均为食管后型(图1A-1C)。其中接受同期放化疗1例,疗效评价PR。10个月后因食管气管瘘及肺部感染,予以植入了长度为14 cm带膜自膨式支架(图1D)。支架植入后可正常进食,肺部感染减轻。但患者拒绝行继续放化疗等治疗。
2.2 接受序贯化放疗1例先行多西他赛+顺铂方案化疗,疗效PR。再按上述放疗计划行放疗。疗效评价PR。至今无进展生存期6个月。
2.3 接受胸腹腔镜联合食管癌根治术3例其中1例术中损伤迷走右锁骨下动脉导致大出血,故改为中转开胸,修复ARSA,并顺利完成余下手术。术中因出血导致双侧喉返神经旁淋巴结无法清扫。患者术后出现肺部感染及ARDS,经治疗后于术后13 d死亡。其余2例在胸腔镜下完成手术,术中发现多项变异(图2):(1)右锁骨下动脉直接开口于左锁骨下动脉远端的左位降主动脉上,形成迷走右锁骨下动脉,沿脊柱旁上升至右胸顶;(2)胸腔内右侧喉返神经缺如;(3)自降主动脉发出异常粗大的支气管动脉,越过隆突下方供应右主支气管及右肺,术中并因应变异进行手术操作,游离ARSA,清扫双侧喉返神经旁淋巴结,保留异常的支气管动脉手术顺利完成,患者随访至今。
3 讨论

图1 CT分型Fig.1 CT classification
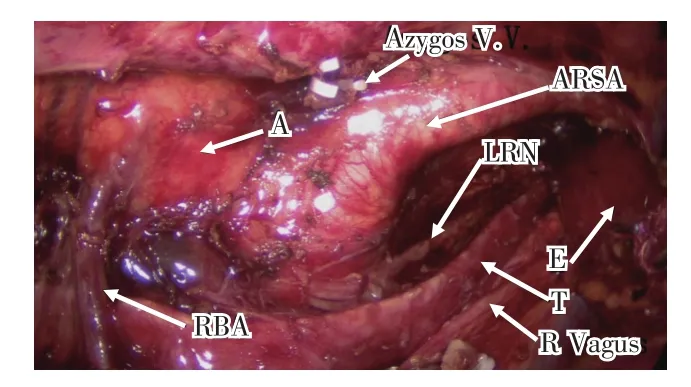
图2 术中显示的迷走右锁骨下动脉的毗邻结构Fig.2 The adjacent structures of the right vagal artery revealed during operation
ARSA是一种少见但有重要临床意义的血管变异,根据Edwards发育模式,ARSA是由胚胎早期弓动脉系演变的过程中出现异常而形成[1],也是主动脉弓分支变异中最常见的一种。与正常的右侧锁骨下动脉不同,ARSA不发自无名动脉,而是发自左锁骨下动脉起始部之后的主动脉弓或降主动脉。一般在第4颈椎至第4胸椎之间,约80%位于食管后,15%位于食管与气管间,仅5%~10%走行于气管前[3]。不管哪种类型,ARSA对食管和气管均有不同程度的推压。本组中5例均为食管后型。ARSA因与食管关系密切,故在合并食管癌时,对患者诊断和治疗均存在重要影响,值得引起临床医师注意。但目前国内对ARSA合并食管癌的报道多侧重在诊断方面,本文则在治疗方面作一分析,从新的角度为临床实践提供借鉴。
诊断上,ARSA本身的诊断比较容易,CT增强或CT血管造影可以明确诊断ARSA存在和走行方向[4]。ARSA可以压迫食管,引起不同程度的吞咽困难。文献报道约有10%的ARSA会引起吞咽困难,食管造影检查可见明显压迹,容易被误诊为食管癌[5-6]。但当ARSA和食管癌两者同时存在时往往容易漏诊其中一种,本组中病例1因术前检查未能对ARSA有效识别,导致术中误伤血管。另外CT发现ARSA的患者有吞咽困难症状时,必须行食管内镜检查,以免漏诊合并存在的食管癌。故为避免漏诊、误诊,本组中所有患者均完善CT增强及食管内镜检查。
治疗上,ARSA往往会导致食管癌放疗方案的修订。有文献报道,误诊ARSA可以不同程度地增加胸段食管癌精确放疗的靶区体积,从而导致危及器官受照剂量增加甚至超过安全剂量范围,最终可能增加放疗不良反应的发生率和严重程度(如放射性肺炎)。这与原发肿瘤瘤体位置、大小,纵隔淋巴结情况及与ARSA的空间关系,CTV及PTV规划、射野设计等有关[7]。故发现ARSA合并食管癌,放疗时应注意区分血管和纵隔淋巴结,控制毗邻器官的收照剂量。
部分患者需要行食管支架植入时,也要关注ARSA和食管肿瘤的关系。有报道食管带膜支架可引起个别患者的致命性大出血,原因为支架和主动脉弓等大动脉产生摩擦导致血管破裂出血[8-9]。故如上段食管癌合并ARSA患者需要支架植入时应谨慎考虑,因为ARSA引起上纵隔空间狭小更容易产生与支架的摩擦而导致致命性的大出血。
手术治疗上,术前必须清楚ARSA与食管的解剖关系,避免术中损伤ARSA导致大出血;已有文献报道术中ARSA损伤,而需要改为中转开胸[10]。故术中注意保护ARSA是顺利完成手术的关键。另外,因ARSA往往合并后右侧喉返神经、胸导管、支气管动脉等的变异,尤其右喉返神经变异最大,胸部手术中往往难以暴露右侧喉返神经;而左侧喉返神经位于食管、气管和ARSA之间,由于空间狭小清扫左侧喉返神经旁淋巴结难度增大[11],容易损伤ARSA和左侧喉返神经。然而目前采用的侧俯卧位+人工气胸的胸腔镜下对上纵隔的显露明显优于开放手术,故尽管存在血管的变异、上纵隔空间狭小,胸腔镜仍然是手术的首选方式[12]。本组病例数少,有必要积累更多的临床病例再做系统总结。
综上所述,食管癌合并ARSA时,容易被漏诊和误诊,增强CT和内镜检查时是明确诊断的有效手段;对合并ARSA的食管癌进行放化疗、介入治疗和外科手术时,必须考虑到ARSA的影响并相应调整治疗方案。因此,充分认识ARSA,对于食管癌的临床诊疗工作有重要意义。

