系膜IgA沉积的心脏死亡器官捐献供肾的移植效果观察
赵贺,王凯,孙东,李明,曲青山(新乡医学院附属郑州人民医院,河南郑州 450053)
自2015年以来,心脏死亡器官捐献(donation after cardiac death,DCD)成为我国器官捐献的唯一来源,器官短缺的问题日益严重[1]。免疫球蛋白A(immunoglobulin A,IgA)肾病在亚洲是最常见的肾小球肾炎类型[2]。患有IgA肾病的患者移植术后的复发率为12%~65%[3]。但目前对系膜IgA沉积DCD供肾移植效果及复发研究报道较少。本文对郑州市人民医院移植中心2015年以来收治的92例系膜IgA沉积的DCD供肾情况及移植效果进行汇报。
1 资料与方法
1.1 供体选择:① 术前供体检查均无蛋白尿或血尿;② 根据Remuzzi评分标准[4],排除评分≥6分的供体;③ 排除二次肾移植受体;④ 排除双肾移植。
1.2 供、受体资料:选取2015年6月—2017年6月在郑州市人民医院收治的92例DCD供肾资料,根据术前病理活检结果,将供肾分为两组,分别为IgA DCD供肾组(24例)与非IgA DCD供肾组(68例)。将受体分为两组,分别为原发疾病为IgA 40例,原发疾病不是IgA为52例,根据术后1年病理穿刺结果将40例原发疾病为IgA的受体分为两组,即受体复发IgA肾病14例,未复发IgA肾病26例。
1.3 器官移植:受体应用常规手术方式。所有受体患者术中应用兔抗人T细胞免疫球蛋白诱导治疗,剂量为7~9 mg/kg。术后应用他克莫司(tacrolimus,Tac)+吗替麦考酚酯(mycophenolate mofetil,MMF)+泼尼松三联免疫抑制抗排斥反应治疗,术后1~6个月内维持Tac的血药浓度为8~11 μg/L。6~12个月内维持Tac的血药浓度为 6 ~ 8 μg/L。
1.4 主要观察指标:观察供体临床指标包括供体性别、年龄、获取前肌酐值、有无高血压或糖尿病病史、死亡原因、人类白细胞抗原(human leukocyte antigen,HLA)错配数等指标。观察受体临床指标包括年龄、性别、高血压病史、透析时间、1年移植肾功能、1年移植肾存活率、蛋白尿、血尿等指标。
1.5 肾穿刺活检的方法:供肾获取修整后用巴德自动16 G活检枪于肾下极穿刺获取一条长约1.5 cm肾组织,穿刺点用小块脂肪组织覆盖后缝合。肾脏组织病理检查(石蜡切片、免疫荧光、电镜检查)。对供肾组织病变程度行Remuzzi评分。1年后对移植肾进行常规病理活检。
1.6 伦理学:本研究符合医学伦理学标准,得到医院伦理委员会审批(20150522)。
1.7 统计学方法:采用SPSS 20.0统计软件进行统计分析。资料采用均数±标准差(±s)或百分数表示,组间均值差异性比较使用两独立样本t检验,组间率的差异性比较使用卡方检验或Fishier确切概率法,移植肾存活时间的比较采用Kaplan-Meier分析与Log-Rank检验,P<0.05为差异有统计学意义。
2 结 果
2.1 IgA DCD受体组术后1个月蛋白尿、血尿7例(29.2%,7/24),无IgA DCD受体组术后1个月蛋白尿、血尿11例(16.2%,11/68),两组相比无统计学意义(χ2=4.0,P>0.05)。术后12个月、24个月检测血肌酐值,IgA DCD受体组肌酐值分别为〔(92.48±9.70)μmol/L、 (89.64±7.61)μmol/L;P>0.05〕,无IgA DCD受体组的血肌酐值分别为〔(93.77±8.82)μmol/L、(90.95±7.71)μmol/L ;P>0.05〕。两组肌酐值比较无统计学意义 (表1)。
2.2 原发疾病为IgA的受体为40例,原发疾病不是IgA的受体为52例,根据术后1年病理穿刺结果,受体复发IgA肾病14例,未复发IgA肾病26例。受体IgA复发组接受系膜沉积IgA DCD供肾7例(50%,7/14),受体IgA未复发组接受系膜沉积IgA DCD供肾8例(30%,8/26),比较两组接受系膜沉积IgA DCD供肾分布无统计学意义(χ2=1.44,P>0.05)(表2)。
2.3 随访12~36个月,IgA DCD受体组与无IgADCD受体组经过生存曲线Kaplan-Meier分析显示(图3),2年的移植肾存活率并没有统计学意义(χ2=1.18,P>0.05)。
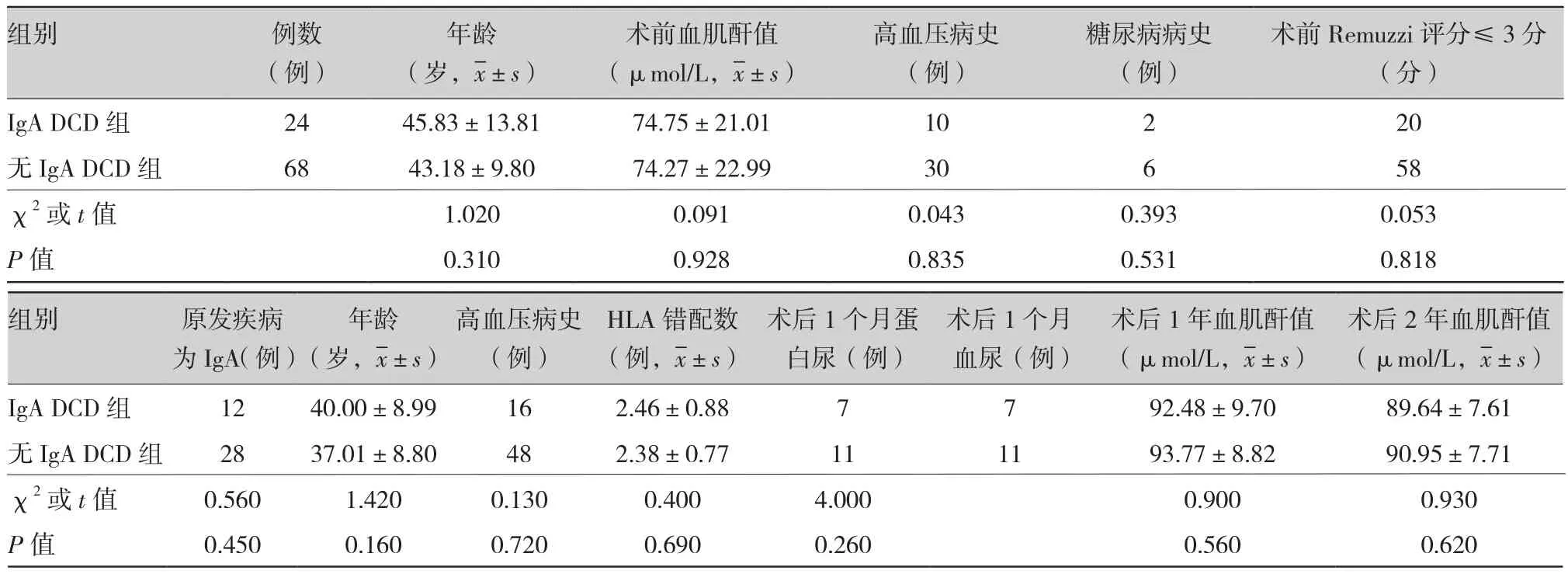
表1 系膜IgA沉积DCD与无IgA沉积DCD的供受体临床资料比较
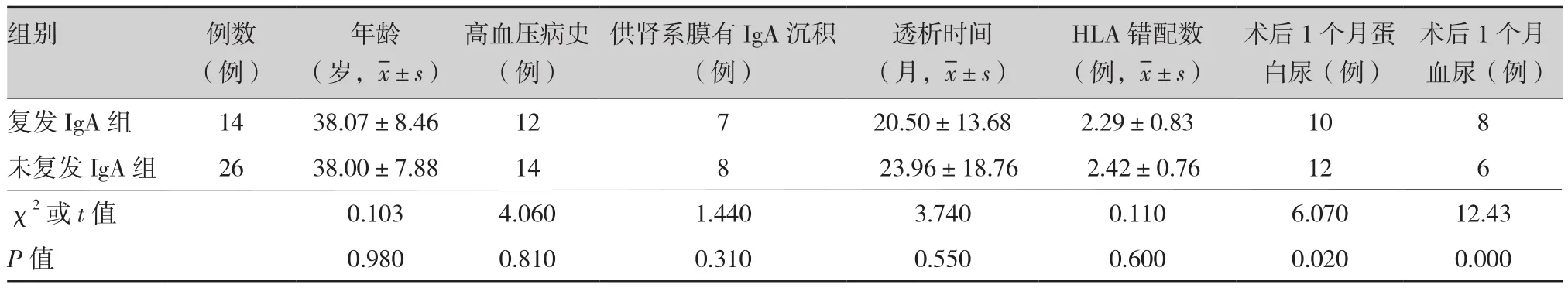
表2 IgA复发受体组与IgA未复发受体组资料比较
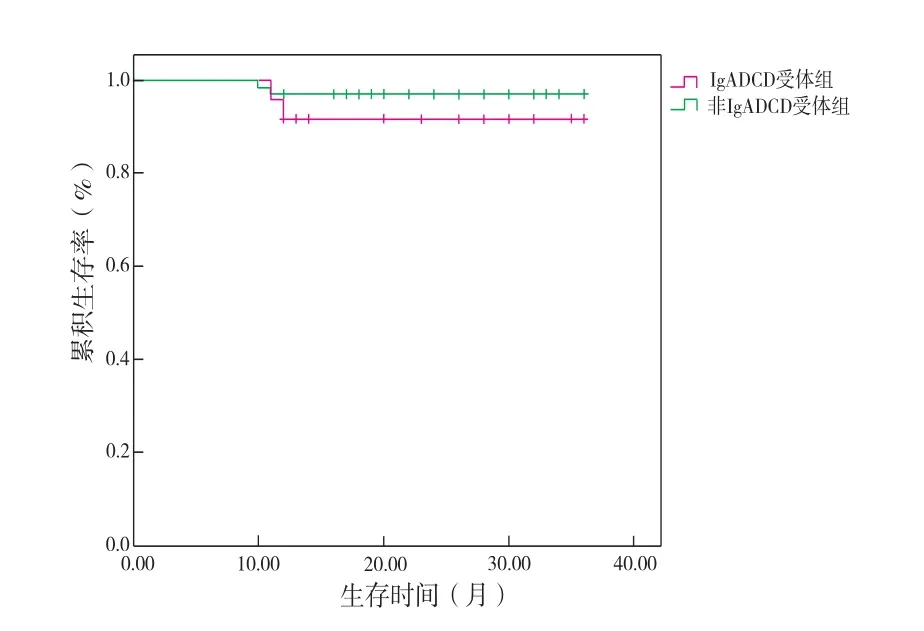
图3 IgA DCD受体与无IgA DCD受体的生存曲线分析
3 讨 论
术后1年、2年受体血肌酐值无明显差异,随访12~36个月,IgA DCD受体组与无IgA DCD受体组生存曲线Kaplan-Meier分析显示(图3),2年移植肾存活率无统计学意义,说明IgA DCD不影响短期移植肾功能及短期移植肾的生存率。Sofue等[5]回顾性分析68例活体供肾零点活检和肾移植受者术后第1年程序化肾活检结果,发现活体供肾内隐匿性IgA沉积并不影响移植肾的预后。多数研究显示IgA肾病复发患者在肾移植术后3年内很少出现移植肾功能不全,而且术后1年移植肾存活率明显优于其他类型肾脏疾病的肾移植受者,他们认为这可能与IgA肾病受者体内存在过度活跃针对异源性IgA分子HLA的抗体相关[6]。术后5年,10%~15%的复发患者出现移植肾功能不全,其中仅5%出现移植肾失功[7]。术后10年,其人、肾存活率与原发病为其他类型肾小球肾炎(非糖尿病肾病性)的受者相比依然无显著差异[8]。但对IgA DCD远期移植肾功能与预后报道较少,仍需进一步研究。
IgA肾病是肾小球肾炎的常见病因,20%~40%的患者最终需透析治疗[9],部分患者选择肾移植治疗,Ortiz等[10]报道的肾移植术后受者IgA肾病复发率为32%,其中约52%患者未出现临床症状,IgA肾病复发的诊断基于术后肾活检。Lionaki等[11]总结了近30年来32项相关研究显示,肾移植术后IgA复发率从4.5%~70.5%不等。本次研究纳入原发疾病为IgA肾病40例,其中14例复发,发生率为35%(14/40),与国内报道的复发率31%相似[12]。本研究发现14例IgA肾病复发受体有7例受体的供肾为系膜沉积IgA DCD,26例IgA肾病未复发受体有8例受体供肾来自系膜沉积IgA DCD,两组比较IgA DCD供肾分布无统计学差异,说明系膜IgA沉积DCD供肾不影响IgA肾病的复发。这与Lionaki等[11]研究发现供肾肾小球系膜区IgA沉积可增加受者IgA复发率结果不同,这可能与本次纳入样本量少有关。但也有学者发现IgA供肾在移植术后1年行移植肾穿刺活检发现IgA消失,可能原因为供肾的IgA基因表达不良[13]。日本学者认为[14]移植术后IgA的复发与以下4种因素有关:① 活体供肾因素;② 特定HLA受体中的等位基因,包括HLA-B35、HLA-DR4、HLA-B8 DR3;③ 良好的HLA配型;④ 血清中IgA浓度高。因此,供肾IgA沉积对移植肾IgA复发的影响还有待进一步的研究。
通过以上研究,系膜IgA沉积的DCD供肾不影响受体短期移植肾功能、受体生存率及IgA肾病的复发。本研究存在的问题:① 样本例数少;② 随访的时间短;③ 未对影响IgA复发的因素进行研究。

