再次肝移植术后免疫抑制剂的应用分析
孙晓叶,沈中阳(天津市第一中心医院移植外科,天津 300192)
尽管肝移植技术取得了巨大进步,但仍有部分患者在首次移植后,由于多种原因需要再次接受肝移植手术。术后合理的免疫抑制方案是提高再次移植患者存活率的关键。下面就本中心54例再次肝移植术后患者的免疫抑制剂方案的应用进行回顾性分析。
1 资料与方法
1.1 一般资料:回顾性分析2014年1月—2017年12月本中心实施的54例成人再次同种异体原位肝移植患者的临床资料,其中首次肝移植在本中心施行者37例,在外院实施者17例;54例患者中,男性46例,女性8例,中位年龄为55(18~71)岁。
1.2 手术方式
1.2.1 供肝均为公民逝世后器官捐献(donation after citizen's death,DCD)供肝,2例患者为劈离式右半肝移植,供肝切取采取腹主动脉和门静脉或肠系膜上静脉插管灌注,肝肾联合切取方法。
1.2.2 再次肝移植手术 54例再次肝移植手术均为经典非转流术式,门静脉端端吻合。肝动脉的重建:拆除原动脉吻合口端端吻合。胆道重建:54例供受体胆道端端吻合,放置T管。
1.3 免疫抑制治疗方案
1.3.1 皮质激素应用方案:术中供肝血流开放前甲强龙10 mg/kg或半量冲击治疗,术后甲强龙80 mg/d起逐天减量至口服甲泼尼龙4~8 mg/d维持,术后根据患者免疫状态、原发病、血糖、血脂等进行方案调整。如自身免疫性肝病患者皮质激素长期服用,非自身免疫性良性肝病患者术后3~6个月停用皮质激素,肝癌患者术后1个月内停用皮质激素。
1.3.2 巴利昔单抗应用方案:术中供肝血流开放前及术后第四天分别静脉输注巴利昔单抗20 mg。
1.3.3 他克莫司(tacrolimus,FK506) 应用方案:因术中应用巴利昔单抗,因此肝移植术后FK506首次给药时间由术后6 h延长至术后36 h,且考虑到再次肝移植患者免疫力低下,为减少再次肝移植术后感染的发病率,FK506起始剂量为0.08 mg (/kg·d),此后根据FK506血药浓度调整用药剂量。
1.3.4 吗替麦考酚酯(mycophenolic acid,MPA)应用方案:此回顾性研究早期阶段以应用MPA为主,后期阶段以应用麦考酚钠肠溶片为主,MPA起始剂量为750 mg Q 12 h,麦考酚钠肠溶片起始剂量为540 mg Q 12 h,之后根据患者免疫功能,尤其是B细胞功能调整用药剂量及用药时间,大部分患者再次肝移植术后6个月停用MPA,B细胞功能增强患者长期服用MPA。
1.3.5 临床中,54例再次肝移植患者使用皮质激素+巴利昔单抗+ FK506 + MPA四联免疫抑制方案 (方案1)为31例;皮质激素+巴利昔单抗+ FK506三联免疫抑制方案(方案2)为15例;巴利昔单抗+FK506 + MPA三联免疫抑制方案(方案3)为1例;巴利昔单抗+ FK506两联免疫抑制方案(方案4)为7例。
1.4 急性排斥反应的诊断和治疗:临床表现以发热、胆汁量减少或稀薄、胆红素和转氨酶持续升高等为主,肝穿活检病理是诊断的金标准。本资料的急性排斥反应诊断均为肝穿活检病理诊断。轻度急性排斥反应,首先通过提高FK506浓度进行治疗,中、重度急性排斥反应,给予激素冲击治疗。
1.5 术后感染的诊断和治疗:每例再次肝移植术后患者均常规检测血液巨细胞病毒及EB病毒DNA,血液G试验,留取痰液、腹水、胆汁、导管尖端行病原菌检测,发热体温超过38.5℃留取血培养,有泌尿系症状,如尿频、尿急、尿痛留取尿培养,局部感染或渗出留取局部体液标本等等。感染的确诊以再次肝移植术后血液检测及病原菌培养发现致病菌为准。明确病原菌后,根据临床症状应用敏感药物对症治疗。
1.6 其他治疗:对于原发病为乙肝相关性肝病患者,术后继续使用核苷类药物及乙肝免疫球蛋白预防乙肝复发。术后10~14 d常规应用更昔洛韦 (0.25 g静脉滴注,每天2次,用14 d)预防巨细胞病毒感染;常规预防真菌及细菌感染。
1.7 统计学分析:使用SPSS 21.0进行数据分析,计量资料用均数±标准差(±s)表示,FK506谷值浓度比较使用F检验,同法检测排斥患者与未排斥患者、感染患者与非感染患者不同时间段FK506谷值浓度,P<0.05为差异有统计学意义。
2 结 果
2.1 再次肝移植的存活率及围术期死亡:回顾性分析54例再次肝移植患者的临床资料,术后1年内死亡15例,病死率27.8%,15例患者均为术后3个月以内死亡,其中死于肺感染7例,死于腹腔感染3例,死于腹腔出血2例,死于肝功能衰竭合并肺感染1例,死于胆道感染1例,死于移植肝原发无功1例。长期存活患者39例(72.2%),按时间划分:2014年实施17例,死亡8例,存活9例,1年存活率52.9%;2015年实施11例,死亡5例,存活6例,1年存活率54.5%;2016年实施12例,死亡1例,存活11例,1年存活率91.7%;2017年实施14例,死亡1例,存活13例,1年存活率92.9%。
2.2 54例再次肝移植受者术后均服用以FK506为主的免疫抑制剂方案,术后1周、2周、4周、3个月、6个月、12个月FK506血药浓度(谷值)见图1。
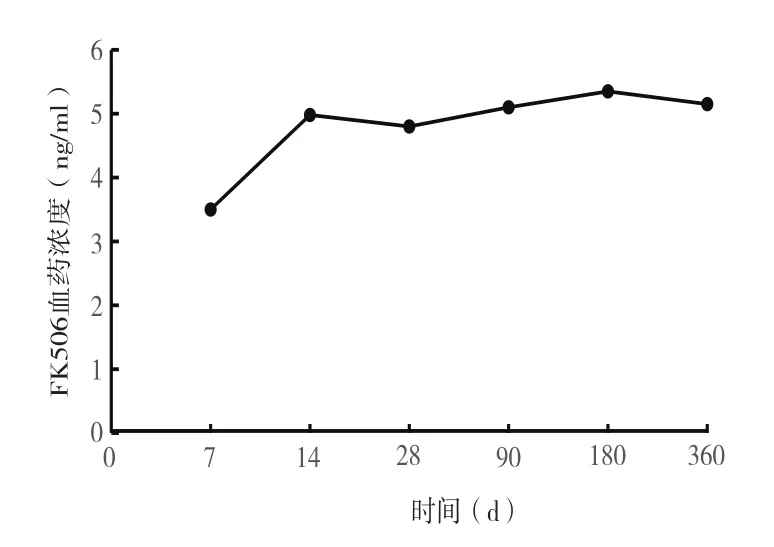
图1 再次肝移植术后FK506血药浓度(谷值)
2.3 再次肝移植术后急性排斥反应的发生率及治疗:方案1共31例患者,其中4例发生经病理证实的急性排斥反应,发生时间分别为术后18 d、1个月、3个月及6个月。其中2例患者原发病为自身免疫性肝炎,1例患者原发病为胆管细胞癌,另1例患者首次肝移植术后因急性排斥反应行激素冲击治疗。4例发生急排的病例经增加FK506用量后症状均缓解。
方案2共15例患者,其中3例发生经病理证实的急性排斥反应,发生时间分别为术后9 d、3个月及6个月。其中1例患者原发病为自身免疫性肝炎,1例患者自行减少FK506服用剂量后出现排斥反应,1例因严重感染,免疫抑制剂用量较少发生急性排斥反应。2例发生急排的病例经增加FK506用量后症状均缓解,1例除增加FK506用量外,加用甲强龙冲击治疗后症状缓解。
方案3共1例患者,无急性排斥反应发生。
方案4共7例患者,其中2例发生经病理证实的急性排斥反应,发生时间分别为术后1个月、术后2个月。其中1例患者原发病为自身免疫性肝炎,另1例患者首次肝移植术后因慢性排斥反应再次肝移植手术。2例发生急排的病例经增加FK506用量后症状均缓解。
经统计,方案1与方案2发生排斥反应患者与未发生排斥反应患者在术后第七天的FK506谷值浓度差异有统计学意义,余不同时间段几种方案FK506浓度无明显差异,详见表1。
表1 再次肝移植术后第七天FK506谷值浓度对比(±s)
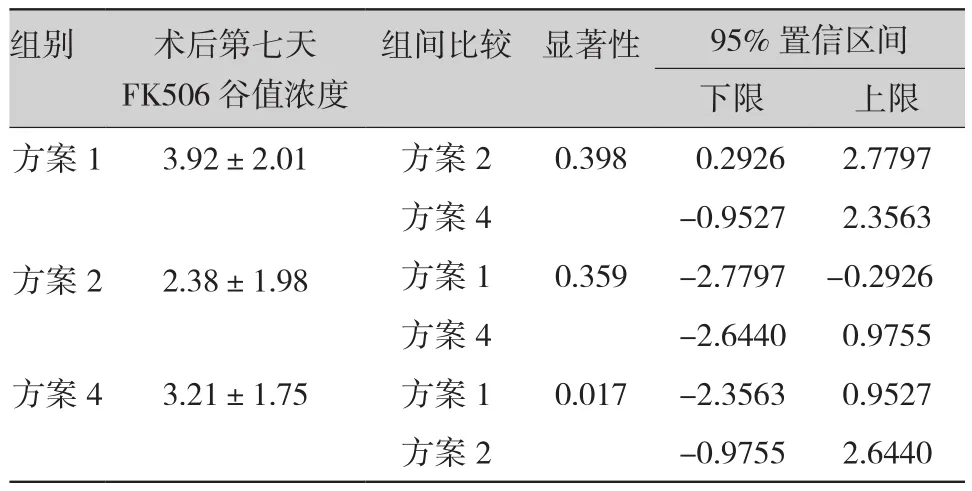
表1 再次肝移植术后第七天FK506谷值浓度对比(±s)
组别 术后第七天FK506谷值浓度组间比较 显著性 95% 置信区间下限 上限方案1 3.92±2.01 方案2 0.398 0.2926 2.7797方案4 -0.9527 2.3563方案2 2.38±1.98 方案1 0.359 -2.7797 -0.2926方案4 -2.6440 0.9755方案4 3.21±1.75 方案1 0.017 -2.3563 0.9527方案2 -0.9755 2.6440
2.4 再次肝移植术后感染发生率及治疗:所有感染的确诊均依赖于相应部位病原学检测阳性,感染部位包含胆道、腹腔、肺、血液、导管尖端、伤口分泌物、尿等。方案1共31例患者,其中20例发生经病原菌证实的感染,20例患者均有细菌感染。其中3例合并有真菌感染,胆道真菌感染2例,肺部真菌感染1例。20例细菌感染患者,9例为单一部位感染,胆道感染6例,腹腔感染3例,11例为两个或两个以上部位感染,较常发生的为胆道、肺部、腹腔的感染。共7例患者死亡。方案2共15例患者,其中10例发生经病原菌证实的感染,9例患者细菌感染。3例真菌感染,其中合并有细菌感染及真菌感染患者2例。胆道真菌感染1例,肺部真菌感染2例。9例细菌感染患者均为两个或两个以上部位感染。共6例患者死亡。方案3共1例患者,腹腔细菌感染。方案4共7例患者,其中5例发生经病原菌证实的感染,5例患者均为细菌感染。其中1例为单一腹腔感染,4例为两个或两个以上部位感染。共2例患者死亡。
发生感染患者与未发生感染患者再次肝移植术后不同时间段FK506浓度对比未见明显差异。
3 讨 论
随着肝移植技术不断进步,肝移植受者术后存活时间明显延长,生存质量明显提高,但是仍有少部分肝移植受者,由于胆道并发症、慢性排斥反应、血管并发症、移植肝原发无功、原发病复发等各种原因需要再次肝移植手术[1]。再次肝移植患者,免疫抑制剂的应用方案较首次肝移植患者更为复杂,维持免疫平衡对提高患者术后存活率至关重要。本中心在肝移植开展早期,经验性免疫抑制治疗占主导地位,随着经验的不断积累,越来越重视术后患者免疫功能监测,尤其是检测T细胞及B细胞功能,如果单纯T细胞功能亢进,增加FK506剂量疗效可靠,合并有B细胞功能亢进,则需要加用MPA药物[2]。在明确患者免疫状态后,结合患者免疫抑制剂浓度检测及感染相关风险因素,及时调整免疫抑制剂方案,进行个体化治疗,可明显提高再次肝移植受者生存率。文献报道,再次肝移植术后1年病死率为30.4%~51.5%[3-4],本中心54例再次肝移植资料显示,2014年实施17例,死亡8例,病死率47.1%;2015年实施11例,死亡5例,病死率45.5%;2016年实施12例,死亡1例,病死率8.3%;2017年实施14例,死亡1例,病死率7.1%,近年病死率明显下降。
目前尚无统一的再次肝移植术后免疫抑制剂应用方案,普遍的观点认为,再次肝移植术后免疫抑制强度应低于首次肝移植术后。主要原因是患者经历了首次肝移植,自身已处于免疫抑制状态,容易出现感染及肿瘤复发。本研究分析表明,再次肝移植术后患者在术后不同时间段(1周、2周、4周、3个月、6个月、12个月)FK506血药浓度均较首次肝移植相应时间段低,甚至出现早期FK506血药浓度高于后期的现象,这主要是因为,再次肝移植患者术前免疫抑制状态,术后为了减少感染发病率,免疫抑制剂早期应用剂量较少,随着患者状态好转,感染风险下降,排斥风险升高,逐渐增加了FK506剂量,否则,一旦发生慢性排斥反应,则又增加再次肝移植发生率[5]。分析本研究中发生排斥反应的患者情况,共9例患者发生排斥反应,排斥反应发生率为16.7%,进一步分析发现,其中4例患者原发病为自身免疫性肝病,2例患者首次移植后发生过急性或慢性排斥反应,因此提醒我们,对于排斥反应高发的患者,在手术后免疫抑制剂的减量应用还是需要慎重的。
再次肝移植术后早期最主要的死亡因素是各种病原菌导致的感染,进一步发展为多器官功能衰竭,再次肝移植术后感染的发生率明显高于首次肝移植术后[6],而在因感染致死的病例中,真菌感染更高达50%。本中心资料分析表明,再次肝移植术后感染的发生率很高,感染是再次肝移植术后最主要的致死原因,患者的主要死因为腹腔、肺部或者胆道的感染,本中心完成的54例再次肝移植病例,15例死亡,其中11例死于感染,占总的死亡人数的73.3%。所有死亡患者均死于肝移植术后3个月以内,且主要为多部位细菌感染,真菌感染的发生率明显低于文献报道,这与本中心再次肝移植术后常规预防真菌感染治疗有关。有文献认为再次肝移植术后高感染率和术后高强度免疫抑制治疗相关,本研究分析表明,再次肝移植术后感染患者与未感染患者术后相应时间段FK506血药浓度无统计学差异。再次肝移植术后高感染率可能与再移植患者术前大剂量广谱抗菌药物及术前免疫力低下有关。在明确患者发生感染后,应针对性使用敏感抗菌药物,还需在避免排斥反应的前提下,最小化免疫抑制治疗或延迟免疫抑制剂应用,甚至停用免疫抑制剂[7]。除此之外,甚至需要提高患者的免疫功能,如丙种球蛋白或者输注新鲜血浆等提高患者的抵抗力。本研究中,我们后期采取以上措施,感染患者的治愈率明显升高。
虽然再次肝移植感染及排斥风险高、生存率低、预后差,但再次肝移植也是挽救特殊群体患者的唯一有效手段。详细评估再次肝移植受者,在适当时机进行肝移植手术[8-9],术后个体化免疫抑制方案是提高术后生存率的关键。

