大鼠脊髓背角HCN通道的分布及在部分坐骨神经结扎术后的表达变化*
冯小金, 程小娥, 马龙先, 张达颖, 蒋昌宇, 柳涛△
南昌大学第一附属医院 1医学科研中心, 2麻醉科, 3疼痛科(江西南昌 330006); 4深圳市南山医院韩济生院士疼痛医学工作站(广东深圳 518052)
超极化激活环核苷酸门控阳离子(HCN)通道广泛分布于哺乳动物的神经系统,由HCN1~4 4个同源成员组成[1]。HCN通道对神经细胞静息膜电位和兴奋性的调控具有重要作用,其表达及功能的异常改变可致心律失常、癫痫和慢性疼痛等疾病[2-4]。脊髓背角是伤害性信息传递和整合的初级中枢[5],由浅至深分为Ⅰ~Ⅵ层[6]。目前关于HCN通道在脊髓背角分布的研究多以HCN1、HCN2及HCN4为主,较少涉及HCN3亚型,尚存在不足且具争议性。有学者认为HCN1不表达于脊髓背角Ⅱ层[7-8],而另一些学者认为HCN1在Ⅱ层有表达[9]。近年发现,脊髓背角HCN通道部分亚型在坐骨神经缩窄性损伤(CCI)及奥沙利铂诱发的神经病理性疼痛模型中表达上调[1,10],表明其与神经病理性疼痛密切相关。临床工作中神经病理性疼痛的病因错综复杂,不同疼痛模型的致痛机制也不同[11],提示HCN通道在不同疼痛模型中的表达变化可能不同。部分坐骨神经结扎(PSNL)模型是一种常用的模拟外周神经损伤后烧灼样痛的神经病理性疼痛动物模型,脊髓背角HCN通道在PSNL中的表达是如何变化的目前尚不明。因此,2017年3月至2018年7月,本研究运用免疫组织化学与荧光定量PCR方法,观察了HCN通道4种亚型在大鼠脊髓背角的分布特点及其在PSNL模型中的表达变化,以期为临床工作中对该类型的神经病理性疼痛治疗提供理论依据。
1 材料与方法
1.1 实验动物 本实验采用健康SD(Sprague Dawley)大鼠,体重150~250 g,雌雄不拘,均来源于南昌大学动物中心。动物实验严格按照《南昌大学实验动物管理办法》和《南昌大学动物实验伦理审查》原则进行。实验大鼠饲养于清洁笼具中,室内光照保持12 h/12 h昼夜循环,室温控制在22~25℃,自由摄取水和食物。
1.2 主要试剂及仪器
1.2.1 主要试剂 抗HCN1~4抗体购自Alomone Labs公司,抗Biotinylated-IB4(IB4)抗体购自Vector Lab公司;Alexa Fluor(AF) 488购自Invitrogen公司,Rhodamine RedTM-X-conjugated Streptavidin(Rhodamine)购自Jackson公司。反转录试剂盒(RR037A)及荧光定量试剂盒(RR820A)购自Takara公司;基因特异性引物由上海生工公司设计合成。人工脑脊液组成(mmol/L):NaCl 117、KCl 3.6、CaCl22.5、MgCl21.2、NaH2PO41.2、NaHCO325、D-glucose 11、ascorbic acid 0.4、sodium pyruvate 2,pH=7.4。封闭液组成:0.3% Triton X-100、1% BSA、1% NDS和0.01 mol/L PBS。人工脑脊液组成成分、Triton X-100及BSA均购自Sigma公司,NDS购自Abcam公司。
1.2.2 仪器 冰冻切片机(CM1950)及振动切片机(VT1000 S)购自Leica公司。激光共聚焦显微镜(LSM700)购自Carl Zeiss公司。紫外分光光度计(U2900)购自Hitachi公司。梯度PCR仪(Veriti)及荧光定量PCR仪(StepOnePlus)购自Applied Biosystems公司。Von Frey电子测痛仪(Bio-EVF-4S)购自Bioseb公司。
1.3 方法
1.3.1 免疫组织化学染色脊髓标本制备 给大鼠腹腔注射乌拉坦(1.5 g/kg)麻醉后开胸,首先用预冷的生理盐水行心脏灌流约100 mL后,换4%多聚甲醛溶液继续灌流约250 mL,待大鼠组织固定后迅速取出腰骶段脊髓,剪去脊髓两侧附着的神经根并剥离脊髓表面的硬脊膜和软脊膜[12]。然后将脊髓置于4%多聚甲醛溶液(4℃)中固定至少6 h后,置于30%的蔗糖溶液中4℃冷保护3 d。其后将脊髓包埋于OCT胶中,在冰冻切片机(-20℃)下切取厚度为30 μm的横切片备用。
1.3.2 免疫组织化学方法 将上述脊髓横切片采用两步法进行常规漂染:一抗(Anti-HCN1~4,1∶ 200; IB4,1∶ 100)4℃孵育3 d;二抗(AF 488,1∶ 500; Rhodamine,1∶ 1 000)4℃孵育过夜。阴性对照实验在一抗孵育的同时加入与之对应相同浓度的抗原肽,其他步骤相同,以此检测抗体特异性。IB4主要分布于脊髓背角Ⅱ内层,是区分脊髓背角Ⅱ层和Ⅲ层的标记物。为更好地观察HCN通道在脊髓背角的表达情况,我们参照以往研究,将脊髓背角分成6层[6]。激光共聚焦显微镜采集图像,采用ZEN 2010(version 6.0,Carl Zeiss)软件分别测量大鼠脊髓背角HCN1~4通道亚型的浅层(Ⅰ~Ⅱ)和深层(Ⅲ~Ⅵ)的平均荧光强度,将Ⅰ~Ⅱ层平均荧光强度作为标准化1,计算脊髓背角Ⅲ~Ⅵ层相对Ⅰ~Ⅱ层荧光强度比值,以此反映HCN通道各亚型在脊髓背角浅层和深层的分布特点。
1.3.3 荧光定量PCR方法
1.3.3.1 cDNA的提取 正常SD大鼠或模型及假手术制备后14 d,腹腔注射乌拉坦深麻醉,以人工脑脊液心脏灌流后取出L4-5段脊髓,振动切片机切取厚度为600 μm的横切片。取其脊髓背角组织,经RNAisoTMPlus裂解、氯仿萃取、异丙醇沉淀及乙醇洗涤等过程后,进行紫外分光光度计定量,根据反转录试剂盒说明书加入反应体系及样本,于梯度PCR仪中行逆转录反应合成cDNA。反应结束后所得cDNA存于-20℃保存备用。
1.3.3.2 荧光定量PCR反应 用逆转录所得cDNA产物,根据荧光定量试剂盒说明书在荧光定量PCR仪进行荧光定量PCR反应。基因特异性引物序列见表1。选取同龄SD大鼠,根据随机数字表法将其随机分为两组:模型组(PSNL组)和假手术组(sham组)。结果分析:反应结束后根据溶解曲线确定产物特异性,根据StepOnePlus软件计算得到CT值,以β-actin作为内参,将正常SD大鼠HCN1~4的CT值分别与之比较[13];依2-ΔΔCT法量化PSNL组HCN1~4 mRNA表达值,sham组数据平均值作为标准化1。

表1 PCR特异性引物序列
1.3.4 神经病理性疼痛模型制备及疼痛行为学测定 参照Seltzer等[14]方法制备PSNL神经病理性疼痛模型。大鼠经1.5%异氟烷吸入麻醉后,无菌操作下在右侧股段高位切开皮肤,钝性分离肌肉,暴露坐骨神经干,用7-0尼龙丝线缝入神经干内较松结扎神经背侧的1/3~1/2。假手术组仅暴露右侧坐骨神经,不结扎。采用Von Frey电子测痛仪评估术前,术后1、3、7、10和14 d机械痛敏,以机械痛阈值(paw withdrawal threshold,PWT)表示。所有行为学实验均在双盲情况下进行。
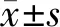
2 结果
2.1 HCN通道各亚型在脊髓背角的大体分布 我们在HCN通道1~4亚型在一抗与抗原肽进行预吸附的阴性对照实验中并未检测到荧光信号,而在未进行抗原肽预吸附的实验中可见绿色荧光信号,左下角插图为明场下脊髓片大体观。见图1。HCN1~4在脊髓均有分布,在脊髓灰质部分染色较深,白质部分基本未见染色;HCN通道4个亚型在脊髓背角各层(Ⅰ~Ⅵ层)均有不同程度分布,并以Ⅰ~Ⅱ层居多,以HCN1~4通道在Ⅰ~Ⅱ层的平均荧光强度为各自的参照,我们发现Ⅲ~Ⅵ层的HCN1~4平均荧光强度远低于Ⅰ~Ⅱ层,HCN1~4各亚型在Ⅲ~Ⅵ层的荧光强度分别为Ⅰ~Ⅱ层的(0.37±0.06)倍、(0.37±0.02)倍、(0.29±0.04)倍、(0.53±0.02)倍(n=3)。见图2~3。
图1 HCN通道1~4亚型的抗体特异性

图2 HCN通道1~4亚型在脊髓背角的大体分布

* 与Ⅰ~Ⅱ层比较P<0.05
2.2 HCN通道各亚型在脊髓背角浅层的局部分布情况 HCN1、HCN2及HCN4多在细胞膜或细胞膜以外的区域表达,HCN3则在整个细胞均有表达。4种亚型中,HCN1和HCN4与IB4共染较明显,而HCN2和HCN3与IB4共染较少。见图4。
2.3 HCN通道各亚型的mRNA在脊髓背角的表达 HCN1~4及β-actin的代表性引物扩增曲线和熔解曲线见图5-A、5-B,可见PCR扩增反应已完全,PCR产物具有很高的均一性。荧光定量PCR结果与免疫组织化学染色结果相似,即HCN1~4 mRNA在脊髓背角均有不同程度表达,它们的表达值分别为0.012 12±0.001 58、0.059 66±0.003 09、0.000 47±0.000 04和0.001 67±0.000 20。HCN2的表达量最高,与HCN1相比差异有统计学意义(P<0.05),HCN1次之,而HCN3和HCN4表达量较少,与HCN1相比差异有统计学意义(P<0.05)(n=5)。见图6。
2.4 PSNL对脊髓背角HCN通道表达的影响 两组大鼠术前的基础PWT差异无统计学意义(P>0.05)。与sham组(n=4)相比,PSNL组(n=4)大鼠PWT在术后1 d即明显降低(P<0.05),并持续到术后第14天。见表2。我们在术后第14天取sham组及PSNL组大鼠右侧脊髓背角组织,对两组HCN1~4 mRNA表达进行检测。结果发现,与sham组(n=4)相比,PSNL组(n=4)HCN2 mRNA表达显著增加,是sham组的(1.34±0.10)倍,差异有统计学意义(P<0.05);而HCN1、HCN3及HCN4 mRNA表达变化差异无统计学意义(P>0.05),分别是sham组的(1.24±0.17)倍、(1.86±0.47)倍和(1.40±0.25)倍。见表3。

A:扩增曲线;B:熔解曲线

*与HCN1比较P<0.05
3 讨论
HCN通道广泛分布于伤害性感觉传导通路及 各级神经元,如在中脑导水管周围灰质腹外侧区(vIPAG),HCN2表达量最高,HCN1、HCN3及HCN4相对较少[15];在DRG,HCN1及HCN2高表达,且HCN1主要分布于大中直径神经元细胞膜上,而HCN2表达在中小直径神经元细胞膜上,HCN3及HCN4的表达相对较少[16-17]等。脊髓背角是接受外周伤害性信息并向高级中枢传递的中继站,也是调制伤害性信息传递的脑干下行抑制/易化系统投射纤维的终止部位,对伤害性信息的传递和调制起关键作用[5,18]。本研究以大鼠脊髓为研究对象,运用免疫组织化学方法和荧光定量PCR技术,探讨了HCN通道4种亚型在正常和神经病理性痛大鼠脊髓背角的分布和表达情况。

组别术前术后1 d3 d7 d10 d14 dsham组75.3±3.774.9±1.676.6±4.372.1±1.072.0±2.273.8±2.8PSNL组74.9±3.654.3±2.7∗51.8±2.7∗44.6±2.0∗44.6±0.8∗48.1±0.9∗
*与sham组比较P<0.05


组别HCN1HCN2HCN3HCN4sham组1.02±0.101.01±0.061.00±0.041.00±0.05PSNL组1.24±0.17 1.34±0.10∗1.86±0.471.40±0.25
*与sham组比较P<0.05
目前关于HCN1~4在脊髓背角分布表达的研究存在争议:例如,Tu等[7]发现HCN1在成年Wistar大鼠脊髓背角中仅存在于Ⅰ层、Ⅲ层和Ⅳ层,而在Ⅱ层没有表达,而Milligan等[8]发现HCH1主要表达在成年Wistar大鼠脊髓背角的Ⅲ层,在Ⅰ层和Ⅱ层几乎不表达。与大鼠的研究结果不同,在成年C57BL/6J小鼠中,HCN1被发现在Ⅰ层和Ⅱi~V层均有表达[9]。我们的免疫组化结果表明,成年SD大鼠的HCN1~4主要在脊髓灰质中表达,白质中几乎不表达;其中HCN1在背角Ⅰ~Ⅵ各层均有分布,且以Ⅰ~Ⅱ层为主。以上研究的差异可能与实验动物的种属不同有关。本研究中的HCN2及HCN4的大体分布特点与之前报道基本一致,即它们在脊髓背角Ⅰ~Ⅵ层均有分布,其中以Ⅰ~Ⅱ层表达居多[7]。HCN3在脊髓背角的分布特点鲜见相关报道,我们发现其在脊髓背角的表达特点与其余3种亚型相似,即在Ⅰ~Ⅵ层具有表达,且以Ⅰ~Ⅱ层最多。因此,本研究首次阐明了HCN1~4 4种亚型在脊髓背角的表达特点。
脊髓背角的初级伤害性传入纤维末梢的递质主要有2种,即肽类(P物质和CGRP)和非肽类(IB4)。在小鼠脊髓背角,HCN1及HCN2与肽类的P物质和CGRP有共染[9]。我们的研究发现HCN1和HCN4与IB4存在共染,表明其在非肽类的初级神经传入纤维末梢也是有表达的。与Antal等[19]关于HCN2与IB4共染不明显的结果一致,本研究发现HCN2和HCN3与IB4几乎不共染。此外,本研究进一步发现HCN1、HCN2及HCN4多在胞膜或胞膜外区域表达,而HCN3主要在整个胞体表达。
目前检测mRNA水平常用的方法有:原位杂交技术、常规PCR及荧光定量PCR法等。原位杂交技术可检测mRNA的相对表达情况,但不能确定其绝对含量;常规PCR及荧光定量PCR都可定量分析mRNA的含量,不同点在于,前者是在PCR反应结束后对产物进行定量分析,而后者可在PCR扩增的指数期对起始模板进行定量分析,具有灵敏度高、定量准确及实时监测等优点[20]。我们的荧光定量PCR结果发现,HCN1~4 mRNA在大鼠脊髓背角均有表达,其中,HCN2具最高表达,HCN1次之,HCN3及HCN4表达量较少,这与Santoro等[21]应用原位杂交技术在小鼠脊髓背角的研究结果相似,即表达量由高到低为HCN2、HCN1及HCN4,但其未研究HCN3的表达。本研究进一步明确了HCN通道1~4亚型mRNA在大鼠脊髓背角的表达特点。
神经病理性疼痛以自发性疼痛、痛觉过敏和异常性疼痛等为特征,尚缺乏有效治疗措施。神经系统的异常兴奋是产生神经病理性疼痛的基础,主要机制是外周及中枢敏化。研究表明,HCN通道在神经病理性疼痛的起始及维持中发挥重要作用,如在vIPAG神经元,CCI可增加HCN1和HCN2表达、Ih电流密度[22];在DRG神经元,mSNA(脊神经损伤)不仅增加HCN2表达、Ih电流密度和激活速度,还可使受损的神经纤维出现异位放电[23];在脊髓背角,CCI可上调HCN1、HCN3及HCN4通道的表达[10],奥沙利铂诱发的神经病理性疼痛可上调HCN2的表达[1];而HCN通道特异性阻断剂(ZD7288)能明显降低动物疼痛模型的神经元异常放电频率,同时缓解痛行为学[24]等。以上CCI、mSNA及奥沙利铂诱发的神经病理性疼痛模型都可模拟人类神经病理性疼痛的特点,但也存在不同点:如CCI模型可诱发很强的自发痛和冷痛敏,大约术后2周神经损伤区域远端的有髓鞘纤维几乎全部脱髓鞘,常用于模拟临床慢性神经压迫性损伤;mSNA模型表现为自发痛行为增加,有利于对比研究损伤和非损伤脊髓节段的初级传入与疼痛的诱导和维持之间的机制关系,常用于模拟神经丛和背根的损伤;奥沙利铂是广泛用于结直肠癌化疗的关键药物,常用于模拟临床抗肿瘤药物所致的周围神经病变。
此外,PSNL模型是一种常用的模拟外周神经损伤后的烧灼样痛的动物模型,具有痛相关行为(自发痛、机械痛和冷痛敏等),出现早且持续时间长等优点。不同神经病理性疼痛模型的痛行为学特征不同,提示在痛觉传导通路中某些通道的表达可能是不一样的,因此,我们进一步探讨了脊髓背角HCN通道在PSNL神经病理性疼痛模型中的表达变化。与既往报道相似[14, 25],本实验中PSNL模型术后PWT显著降低,表明我们的疼痛模型制备成功。我们进一步的研究发现PSNL可上调大鼠脊髓背角HCN2通道mRNA的表达,与奥沙利铂诱发的神经病理性疼痛模型中脊髓HCN2 mRNA及蛋白表达上调的结果相似[1],加之敲除HCN2基因可使神经病理性疼痛的机械痛敏消失[26],以上结果提示脊髓背角HCN2通道上调在PSNL诱发的神经病理性疼痛中具有关键作用。与杨舒蕾等[10]关于HCN1、HCN3及HCN4通道蛋白在CCI模型的脊髓背角表达上调的报道不同,本研究发现PSNL并不改变这3种HCN通道亚型的mRNA表达水平,这可能与疼痛模型种类及HCN通道的翻译后调控的分子机制不同等原因相关,有待将来进一步研究。
综上所述,本研究阐明了HCN通道4个亚型在大鼠脊髓背角分布特点以及其在PSNL模型中的表达变化,为今后HCN通道在神经病理性疼痛方面的研究提供了理论依据,有助于深入研究HCN通道在脊髓背角的调控机制,对于临床开展精准药物治疗具重要意义。

