三维生物打印结合海藻酸钠和纤维蛋白原构建仿生尿道修复补片的实验研究
张楷乐 杨 熙 牛长梅 赵伟新 杨冉星 王 营 胡晓勇 傅 强
尿道狭窄是泌尿外科的常见疾病,严重影响患者的排尿功能和生活质量[1]。采用自体口腔黏膜等进行尿道修复,会不可避免地引起取材部位的并发症,如口腔出血、炎性反应、感染、疼痛、麻木、咬合困难等[2]。近年来组织工程支架材料的改性研究取得了长足的进步,能够为细胞提供必要的支撑结构和孔隙,但是现有的组织工程尿道在临床转化中仍有不足之处。传统的组织工程技术在控制支架孔隙率、微观结构和孔隙连接等方面仍然有困难,限制了细胞的长入,以及营养物质与细胞废物的交换[3]。鉴于传统组织工程尿道的局限性,探索更加科学的组织工程尿道构建技术迫在眉睫。
近年来,三维(3D)打印技术因其能够突破传统组织工程领域遇到的多重挑战已受到广泛关注,其基本概念是利用纸层叠原理进行快速成型的技术。3D打印机与普通喷墨打印机的工作原理相似,只是改变了喷墨材料的结构,3D打印机的喷头根据数字建模添加每一层材料,最后得到3D结构原型[3]。这一技术能够自由控制组织工程支架的规格和形状、孔径的分布和连接等指标。目前在无生命体3D打印技术的基础上,已能够通过打印多种细胞实现3D结构组织和器官的构建,包括心脏瓣膜[4-5]、血管[6-7]、骨骼肌[8-9]、神经[10-11]、皮肤[12]等,该技术被命名为生物打印技术,有望解决传统组织工程尿道中存在的问题[13]。本课题研究组在前期研究[14]中使用聚乳酸和纤维蛋白原水凝胶3D打印,构建了世界上第1例尿道管腔结构,获得了尿路上皮细胞和平滑肌细胞的生长数据,然而该管腔结构的力学性能较弱,尚不适合应用于体内修复。
本研究使用兔尿道组织和脱细胞基质作为模板,分离兔尿道成纤维细胞,使用3D生物打印技术结合海藻酸钠和纤维蛋白原水凝胶共同制备两种负载兔成纤维细胞的仿生尿道修复补片,是国际上第1项将3D生物打印技术应用于组织工程尿道补片的制备和评估的研究,将对后续的尿道再生医学的研究起到借鉴作用。
1 材料与方法
1.1 尿道组织学指标和细胞获取 提取兔自体尿道组织,石蜡包埋。将包埋的组织切至0.8 μm厚,之后进行H-E染色,获得尿道的组织学信息。应用Image J软件进行兔尿道上皮层和平滑肌层的测量。兔尿道经0.9%氯化钠溶液反复冲洗后去除黏膜层面,剪碎黏膜下层,以0.25%胰酶消化1 h,使用加入10%FBS的DMEM培养液培养和扩增,用于3D生物打印。
1.2 仿生尿道修复补片结构设计
1.2.1 补片结构设计1 内层(底层)为2层无孔隙的海藻酸钠水凝胶;中间层为2层有孔隙的海藻酸钠水凝胶,含上皮细胞;外层(顶层)为4层有孔隙的海藻酸钠水凝胶,含平滑肌细胞。海藻酸钠水凝胶配置:明胶20 mg/mL、海藻酸钠20 mg/mL(辐照灭菌)溶于PBS中,在37 ℃溶解混匀。交联剂为5%氯化钙。打印过程:将配置好的水凝胶装入3D打印针筒中,边打印边雾化5%氯化钙交联以维持水凝胶形态。打印参数:大小分别为2 cm×2 cm和2 cm×5 cm;针头300 μm;丝距1.5 mm(中间层和顶层),500 μm(底层,无孔隙);速度180 mm/s;机械挤压量0.345 μL/s;层高0.15 mm。仿生尿道修复补片1打印完成后,再将水凝胶浸入5%氯化钙中交联30 min。
1.2.2 补片结构设计2 内层(底层)为2层无孔隙的海藻酸钠水凝胶;中间层为2层有孔隙的海藻酸钠水凝胶和纤维蛋白原水凝胶,纤维蛋白原水凝胶中含上皮细胞;外层(顶层)为4层有孔隙的海藻酸钠水凝胶和纤维蛋白原水凝胶,纤维蛋白原水凝胶中含平滑肌细胞。纤维蛋白原水凝胶配置:明胶45 mg/mL、纤维蛋白原30 mg/mL、透明质酸3 mg/mL、甘油100 g/L。配置方法:将透明质酸溶于高糖DMEM中于37 ℃搅拌过夜,加入纤维蛋白原、明胶、甘油搅拌1 h,用0.45 μm过滤器过滤备用。交联剂:凝血酶溶液20 U/mL。打印过程:将配置好的水凝胶装入3D打印针筒中,边打印边雾化5%氯化钙交联以维持水凝胶形态,在海藻酸钠水凝胶的网格中填充纤维蛋白原水凝胶。打印参数:大小分别为2 cm×2 cm和2 cm×5 cm;针头200 μm;丝距1.5 mm;速度180 mm/s;机械挤压量0.1 μL/s;层高0.15 mm。仿生尿道修复补片2打印完成后,再将水凝胶浸入含有5%氯化钙和20 U/mL的凝血酶中交联30 min。
1.3 生物降解实验和生物力学测试 生物降解实验:制备仿生尿道修复补片1,分成两组,每组每个时间点设置3个平行样,提前称重每个离心管并标号(W1),将样品分别放入标记好的离心管中,放入37 ℃烘箱中烘干。烘干后精确称重(W2)。离心管中加入75%乙醇溶液,并用紫外辐照30 min,弃去乙醇,用灭菌水清洗3遍。将Ⅱ型胶原酶溶于DMEM中配制成2 U/mL的溶液。其中一组样品放入含有Ⅱ型胶原酶(2 U/mL)的溶液中,另一组放入灭菌水中作为对照组,每管放入的溶液均为2 mL。将全部样品放入37 ℃培养箱中孵育,每2 d换液。设置的时间周期为30 d,时间间隔分别是第7、14、21、30天。在每个预定的时间点取出样品后,用灭菌水轻轻洗涤2次,然后将含有样品的离心管放入37 ℃烘箱中烘干。称取含有样品的离心管(W3),根据公式即可得到降解后每个时间点样品的剩余量。剩余量百分数=(W3-W1)/(W2-W1)×100%。降解时间分别为7、14、21、30 d。
生物力学测试:使用电子游标卡尺测量支架的横切面,分别测量仿生尿道修复补片1的尿道支架,以及兔自体尿道的宽度和厚度。设置拉力机两个钳夹的距离为1.4 cm,配置100 N的拉力单位。以2 mm/min的牵拉速度测量仿生尿道修复补片1的牵拉强度。
1.4 细胞活性检测 采用钙黄绿素-AM(Calcein-AM)/碘化丙啶(PI)双染细胞的方法染色活细胞和死细胞。试剂:①Calcein-AM 100 μL(-20 ℃避光保存),100~1 000倍稀释(一般为试剂盒母液的1 000倍稀释),染色时间为15~30 min;②PI 50 μL(2~8 ℃保存),5 000~30 000倍稀释(常用10 000~20 000倍稀释);③10倍染色缓冲液。用Hank’s平衡盐溶液(HBSS缓冲液)或无血清培养基配置。PBS清洗细胞2次,先用Calcein-AM染色,再用PI染色,于室温或37 ℃避光孵育,染色完成后可用PBS清洗,避免背景太亮。应用荧光显微镜观察,在490 nm波长下,活细胞呈绿色,死细胞呈红色;在545 nm波长下,仅观察死细胞。观察并计算0、3、6 d仿生尿道修复补片1和2中的细胞存活率。采用Cell Counting Kit-8(CCK-8)实验检测仿生尿道修复补片2内纤维蛋白原水凝胶中细胞的扩增速率,以分光光度计吸光度(A值)表示。
2 结 果
2.1 兔尿道组织学模板 H-E染色结果显示,兔尿道上皮细胞覆盖于黏膜下组织,连续分布,将用于3D打印尿道补片内层结构模板(图1A);兔尿道脱细胞后可见细胞外基质有序分布,可作为3D打印尿道补片海藻酸钠水凝胶打印模板(图1B)。

A 兔尿道组织学结构 B 兔尿道脱细胞基质图1 兔尿道组织病理学图片(H-E染色,×20)
2.2 两种仿生尿道修复补片外观 使用3D生物打印机,根据补片结构设计1和2均可制备大小为2 cm×2 cm的仿生尿道修复补片,两者的结构完整性无明显差异。使用交联剂作用于打印后的仿生尿道修复补片1和2,可增强补片力学性能,1 h后即可使用手术镊子操作。见图2。

A 仿生尿道修复补片1交联前的外观 B 仿生尿道修复补片1交联后30 min的外观 C 仿生尿道修复补片1交联后1 h的外观 D 仿生尿道修复补片2交联前的外观 E 仿生尿道修复补片2交联后30 min的外观 F 仿生尿道修复补片2交联后1 h的外观图2 两种仿生尿道修复补片大体观
2.3 生物降解实验和生物力学测试结果 生物降解实验结果显示,仿生尿道修复补片1在Ⅱ型胶原酶溶液和灭菌水中均有明显的降解,10 d内其在Ⅱ型胶原酶溶液中的降解速率明显快于在灭菌水中,10~20 d时的降解速率较在灭菌水中平稳,>20~<30 d时与在灭菌水中的同步,30 d时在两种溶液中的降解率均接近50%(图3A)。生物力学测试结果显示,仿生尿道修复补片1的力学性能表现为线性增加,最大牵拉强度为6 N(图3B)。
2.4 两种仿生尿道修复补片内细胞的活性比较 细胞活性染色结果示,仿生尿道修复补片1内的细胞为点状分布,无明显的舒展(图4A~C),细胞死亡率较高,细胞在培养0、3、6 d的存活率分别为62.91%±3.39%、41.92%±8.86%和57.11%±6.12%;仿生尿道修复补片2内细胞形态舒展,死亡率较低(图4 D~F),在培养第6天时即有明显的细胞扩增,细胞在培养0、3、6 d的存活率分别为95.12%±1.37%、79.46%±4.77%和84.70%±8.62%。

A 生物降解实验结果 B 生物力学测试结果图3 仿生尿道修复补片1的生物降解实验和生物力学测试结果
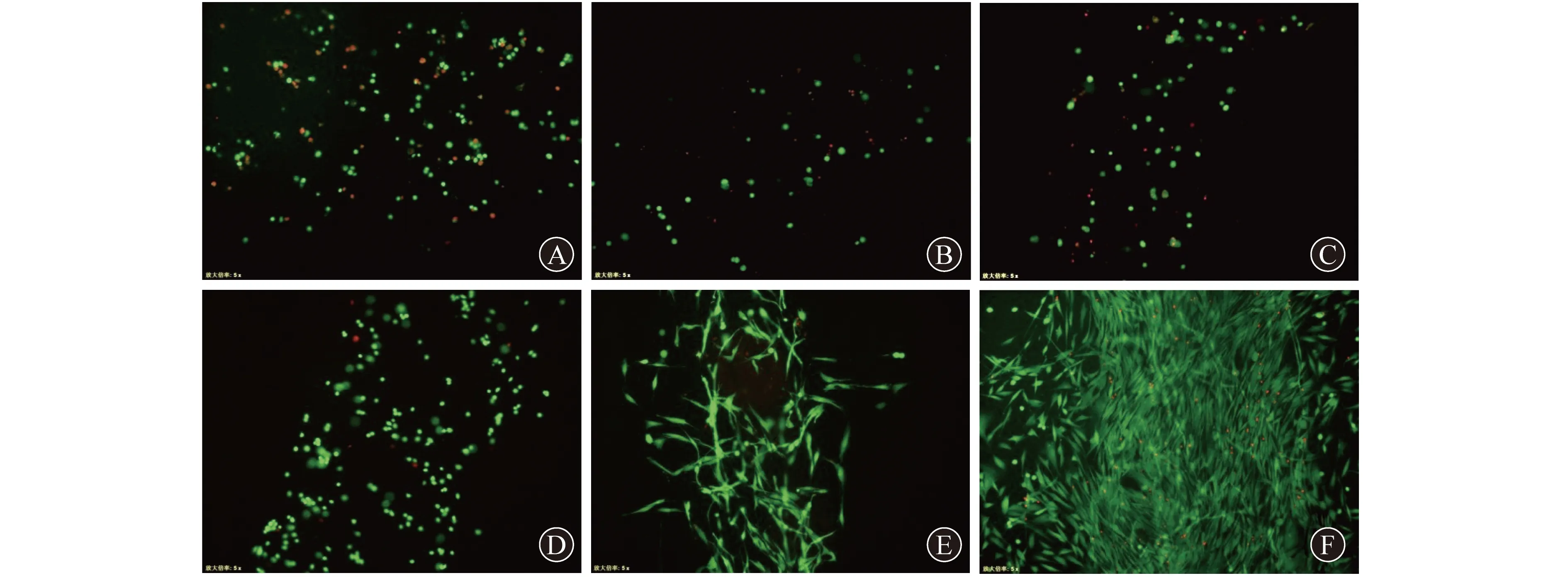
A 仿生尿道修复补片1打印即刻 B 仿生尿道修复补片1培养3 d C 仿生尿道修复补片1培养6 d D 仿生尿道修复补片2打印即刻 E 仿生尿道修复补片2培养3 d F 仿生尿道修复补片2培养6 d图4 不同时间两种仿生尿道修复补片内的成纤维细胞(Calcein-AM/PI双染,×20)
CCK-8实验结果显示,仿生尿道修复补片2内纤维蛋白原水凝胶中的细胞在培养1、4、7、10、15 d的扩增率的A值分别为0.012 752 083、0.131 895 833、0.208 958 333、0.430 608 333、0.623 875 000,有明显的扩增表现。
3 讨 论
本研究应用3D生物打印技术制备了两种结构的仿生尿道修复补片,通过比较单纯海藻酸钠水凝胶和在海藻酸钠水凝胶基础上的纤维蛋白原水凝胶构建的尿道补片,发现海藻酸钠可为尿道修复补片提供充足的力学性能,纤维蛋白原可提高细胞的存活率和扩增率,结合两者的优势可制备仿生尿道修复补片。
本研究中,仿生尿道修复补片2在海藻酸钠水凝胶基础上使用纤维蛋白原水凝胶,由纤维蛋白原、明胶、甘油、透明质酸加入至高糖DMEM中制成,打印完成后再由凝血酶交联,使纤维蛋白原内形成化学键,增强力学性能[15]。这一过程类似于血液凝固和伤口愈合的反应机制[16]。最新的研究[17]发现,纤维蛋白原内有微米级别的孔隙,能够将培养液渗透进入10 μm的水凝胶内部,如果打印结构的厚度大于这一距离,将会降低水凝胶内细胞的代谢,从而降低存活率。细胞活性实验和CCK-8实验结果显示,仿生尿道修复补片2内的成纤维细胞的存活率和扩增率均较高,证明了在海藻酸钠水凝胶基础上使用的纤维蛋白原水凝胶具有高度生物相容性。
细胞负载于水凝胶中,使组织工程尿道获得多层次细胞结构成为可能,采用该方法能够解决传统支架所面临的细胞层次单一的问题。在传统组织工程的尿道支架材料中,为了给细胞黏附提供充足的区域,支架的孔隙往往非常小,仅为纳米级别。这种类型的结构无法促进外层的基质细胞与内层的上皮细胞交流,宿主生物体内的血管仅能通过材料边缘进入支架的管腔内部,而无法获得新生组织周围血管化提供的营养,因此容易造成管腔内面的细胞缺氧坏死,导致修复失败[18]。由于上述原因,经常导致移植物发生坏死,上皮下层的纤维化和手术的失败,使用3D生物打印技术克服了支架孔隙小的问题,可以保证大量细胞进入支架内部。
本研究的细胞活性实验结果显示,在培养第6天时,两种仿生尿道修复补片内的细胞数量均明显增多,但要达到正常兔尿道细胞的数量,仍需对多个指标进行改进,如增加打印时所使用的细胞数量、延长培养时间、采用动态培养方式、改良水凝胶配方等。由于本研究中使用的细胞为成纤维细胞,其在提取、培养、扩增方面都较上皮和平滑肌细胞要容易,为了满足生物打印对细胞数量的要求,需要提取大面积的膀胱进行上皮细胞的分离培养,从而造成对宿主的伤害,因此在今后的实验中,可能会引入干细胞作为生物打印的细胞来源,如脂肪干细胞、胎盘干细胞、胎盘上皮细胞等[19-20]。
生物打印尿道的另一项优势是可以方便地在水凝胶内加入各种相关的生长因子和信号通路调节剂来促进组织的生长和分化,具有广阔的研究前景[21]。由于临床实验或干细胞临床的要求严格,使用细胞进行3D打印将面临更大的应用难度。在现阶段,本课题组会最大限度地优化3D打印尿道补片结构,包括提高力学性能,提高孔隙率,促进细胞长入,在体外细胞实验和动物体内实验中进行观察性研究,之后可单独使用无细胞水凝胶补片或加入生长因子进行临床转化研究。
综上所述,本研究探索了3D生物打印技术用于构建仿生尿道修复补片的可行性,为进一步体内试验奠定了坚实的基础,为生物打印应用于尿道狭窄治疗积累了经验。

