双氢青蒿素联合吉非替尼抑制肺腺癌细胞周期和迁移能力的体外研究
宋芳华,罗 蒙,范 宁,周佳静,李 岩
肺癌是全世界最常见的恶性肿瘤之一,约占全部癌症病例的11.6%,同时也是癌症相关死亡的主要原因,约占全部癌症死亡病例的18.4%[1],其发病率高,5年生存率低于17%。肺癌包括小细胞肺癌和非小细胞肺癌(non-small cell lung cancer, NSCLC),NSCLC包括腺癌(adenocarcinoma, AD)、鳞状细胞癌(squamous-cell carcinoma, SCC)和大细胞癌(large cell carcinoma,LCC)等,约占肺癌的80%[2],AD是肺癌最常见的病理类型。目前肺癌的治疗手段包括手术、放疗、化疗、分子靶向治疗、免疫治疗及中医中药治疗等,临床上根据不同患者的个体情况,采取由多种治疗方式组成的综合治疗。超过70%的NSCLC患者在确诊时处于晚期[3],原发肿瘤的快速生长和远处转移是导致患者预后不良的重要因素[4, 5]。由于各种治疗手段疗效有限,晚期NSCLC无法根治,此外,约30%的患者由于高龄及身体状态评分较差等原因无法使用化疗[6]。目前,亟需寻找新的药物和联合治疗方案进一步提高晚期NSCLC的疗效。
约25%的NSCLC患者存在表皮生长因子受体(epidermal growth factor receptor, EGFR)突变[7],亚裔患者突变率高于西方患者,达51.4%[8]。文献[9]已证实,与化疗相比,EGFR酪氨酸激酶抑制药(tyrosine kinase inhibitor, TKI)GEF,能显著改善携带某些EGFR突变的NSCLC患者的无病生存时间(10.8个月vs5.4个月;HR:0.30;95%CI: 0.22~0.41;P<0.001)。但是原发耐药和继发耐药限制了TKI类药物的疗效。
青蒿素是从黄花蒿茎叶中提取的一种有过氧基团的倍半萜内酯的复合物,是临床一线的抗疟疾药物,DHA是青蒿素化合物的活性代谢物。研究发现,DHA对肿瘤具有一定的抑制作用[10, 11]。
本研究旨在利用DHA联合GEF处理人肺腺癌A549和SPC-A-1细胞系,探究其对肺腺癌细胞增殖、细胞周期及迁移的影响,以期为下一步研究和临床用药提供基础实验依据。
1 材料和方法
1.1 材料 人肺腺癌细胞A549和SPC-A-1购自美国模式培养物集存库(American type culture collection, ATCC),细胞培养液DMEM购自美国Gibco,DME/F12购自美国Hyclone,胎牛血清购自依科赛,DHA和GEF购自美国Selleck,MTT购自索莱宝,细胞周期试剂盒购自天津三箭生物技术有限公司,兔抗人CDK4、Cyclin D1、MMP9、MMP2多克隆抗体、鼠抗人β-actin单克隆抗体均购自美国Cell Signal Technology公司。
1.2 细胞培养及药物处理 人肺癌细胞系A549用DME/F12培养液、SPC-A-1用DMEM培养液培养,培养液内均含10%胎牛血清、100 U/ml青链霉素,于37 ℃、含5% CO2恒温孵箱培养。
DHA和GEF粉末分别用二甲基亚砜(DMSO)配成100 mM母液,-20 ℃避光保存,使用时分别用DME/F12或DMEM培养液稀释到相应浓度。
1.3 MTT增殖实验 取对数生长期的细胞,制成单细胞悬液,以3000个/孔均匀接种到96孔板中,37 ℃、5% CO2恒温培养过夜,用含0 μM、10 μM DHA、50 μM GEF、10 μM DHA+50 μM GEF的培养液,连续培养72 h,并分别于0、24、48、72 h每孔加入10 μl的MTT(浓度为5 mg/ml),并设置不含细胞的空白NC孔,继续培养4 h,移除上清液,加入100 μl二甲亚砜(DMSO),室温振荡15 min溶解甲臢,用酶标仪在490 nm处测定OD值,细胞存活率(%)=(OD实验组-OD空白NC)/(ODNC组-OD空白NC)×100%。
1.4 流式细胞术检测细胞周期 取对数生长期的细胞,制成单细胞悬液,以105个/孔均匀接种到6孔板中,37 ℃、5%CO2恒温培养过夜,移去培养液,换用无血清培养液1 ml,37 ℃、5%CO2恒温孵箱饥饿6 h,移去培养液,用含10 μM DHA和(或)50 μM GEF的培养液培养24 h,小心移去培养液,0.25%无EDTA胰酶消化,冷5%乙醇(PBS配)5 ml小心吹打形成单细胞悬液,4 ℃固定过夜。次日1500 r/min离心5 min,弃上清,冷PBS清洗2次,按试剂盒说明书加入PI染料,37 ℃孵育30 min,300目滤网过滤细胞,BD Accuri C6流式细胞仪检测,Modfit软件分析。
1.5 划痕实验检测迁移 用记号笔于6孔板背后,每隔1 cm均匀划线,横穿过孔。每孔横竖各3条线。取对数生长期的细胞,制成单细胞悬液,加入5×105个细胞,过夜培养,第2日用枪头垂直于背后的横线划痕, PBS小心清洗细胞3次,去除划下的细胞,加入含10 μM DHA和(或)50 μM GEF的培养液连续培养,分别于0、24 h取样,拍照。
1.6 蛋白印迹实验检测蛋白表达 对数生长期的细胞,制成单细胞悬液,以2×105个/孔均匀接种到6孔板中,37 ℃、5% CO2恒温培养过夜,移去培养液,用含10 μM DHA和(或)50 μM GEF的培养液培养48 h,小心移去培养液,冷PBS清洗2次,用细胞刮刀于冰上将细胞刮下,收集于适当体积离心管,4 ℃,1000 g离心5 min,弃上清,沉淀加入含PMSF的RIPA裂解液置于冰上裂解30 min,4 ℃,12000 g离心5 min,吸取上清液,BCA试剂盒测定蛋白浓度,加5×Loading Buffer煮沸,10% SDS-PAGE胶电泳后,将蛋白电转到PVDF膜,5% BSA封闭1 h,BSA稀释抗体到适当浓度,4 ℃孵育过夜,第二日TBST清洗10 min,3次,二抗37 ℃孵育1 h,TBST清洗10 min,3次,ECL显影。

2 结 果
2.1 抑制肺腺癌细胞的增殖 如图1所示,与NC组和单药组相比,联合应用DHA和GEF后,A549和SPC-A-1细胞的活力显著降低,生长速度下降,且具有时间依赖性,差异具有统计学意义(P<0.05),说明联合用药能够显著抑制肺腺癌细胞的生长。
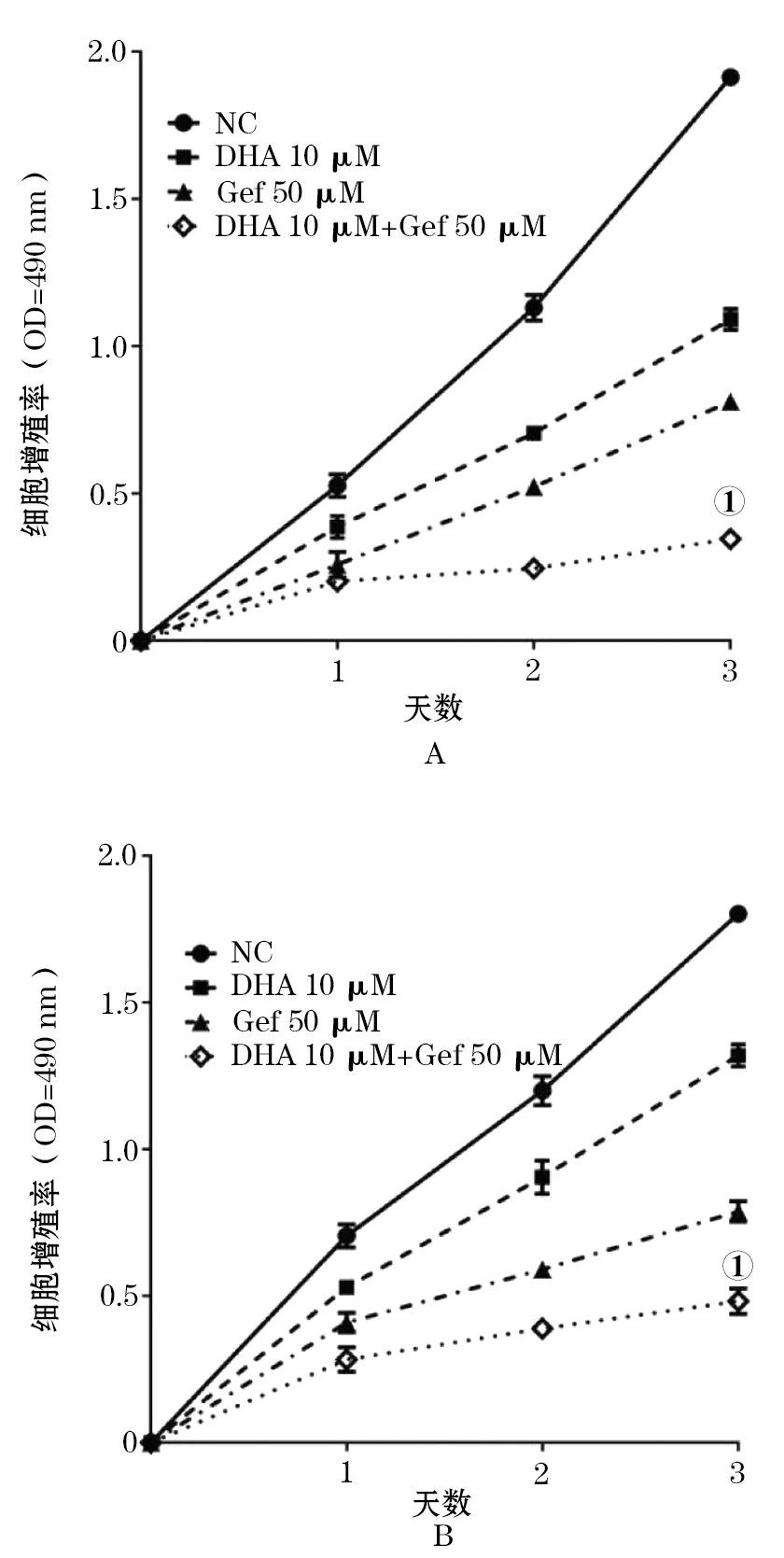
图1 DHA联合GEF对肺腺癌细胞增殖的影响
A.DHA联合GEF抑制A549增殖的MTT结果;B. DHA联合GEF抑制SPC-A-1增殖的MTT结果(①P<0.001)
2.2 DHA联合GEF对肺腺癌细胞系周期的影响 用10 μM DHA和(或)50 μM GEF处理两株肺腺癌细胞24 h后,流式细胞仪检测结果如表1所示,与NC、DHA、GEF组相比,Com组中更多的细胞阻滞于G0/G1期。而WB结果显示,与NC组和单药组相比,Com组的细胞周期相关蛋白Cyclin D1和CDK 4表达下降更为显著(图2、表2)。
表1 DHA联合GEF对肺腺癌细胞周期表达的影响
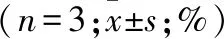

腺癌细胞NC组DHA组GEF组Com组A549 G0/G154.70±0.1862.03±2.3068.66±2.6077.00±2.50①②③ S24.10±1.9024.01±1.7019.96±2.808.72±0.70 G2/M21.21±2.1013.96±2.2011.38±0.8014.29±2.70SPC-A-1 G0/G150.82±1.1051.95±2.0063.40±1.6065.58±0.90①②③ S25.25±2.8026.96±1.6019.05±1.1018.86±0.80 G2/M23.93±2.2021.09±0.6017.55±1.7015.55±2.30
注:与NC组比较,①P<0.001;与DHA组比较,②P<0.001;与GEF组比较,③P<0.001

图2 Western blot检测DHA联合GEF对肺腺癌细胞
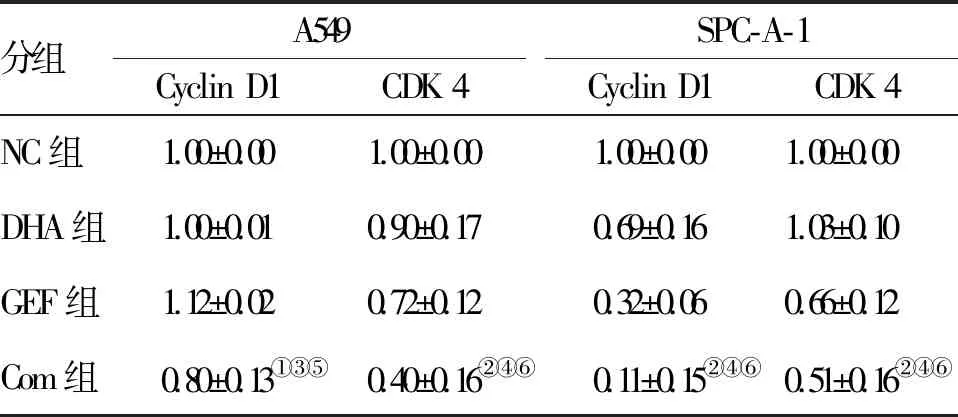
分组A549Cyclin D1CDK 4SPC-A-1Cyclin D1CDK 4NC组1.00±0.001.00±0.001.00±0.001.00±0.00 DHA组1.00±0.010.90±0.170.69±0.161.03±0.10GEF组1.12±0.020.72±0.120.32±0.060.66±0.12Com组0.80±0.13①③⑤0.40±0.16②④⑥0.11±0.15②④⑥0.51±0.16②④⑥
注:与NC组比较,①P<0.01,②P<0.001;与DHA组比较,③P<0.01,④P<0.001;与GEF组比较,⑤P<0.01,⑥P<0.001
2.3 DHA联合GEF对肺腺癌细胞系迁移能力的影响 用10 μM DHA和(或)50 μM GEF处理两株肺腺癌细胞,24 h镜下观察细胞,并利用Image Pro Plus软件计算细胞融合率,如图3A、B和表3,Com组细胞迁移率显著低于NC组和单药组。如图3C和表4,WB结果显示Com组MMP2和MMP9表达显著低于NC组和单药组。这些结果说明联合应用DHA和GEF能够抑制肺腺癌细胞迁移。
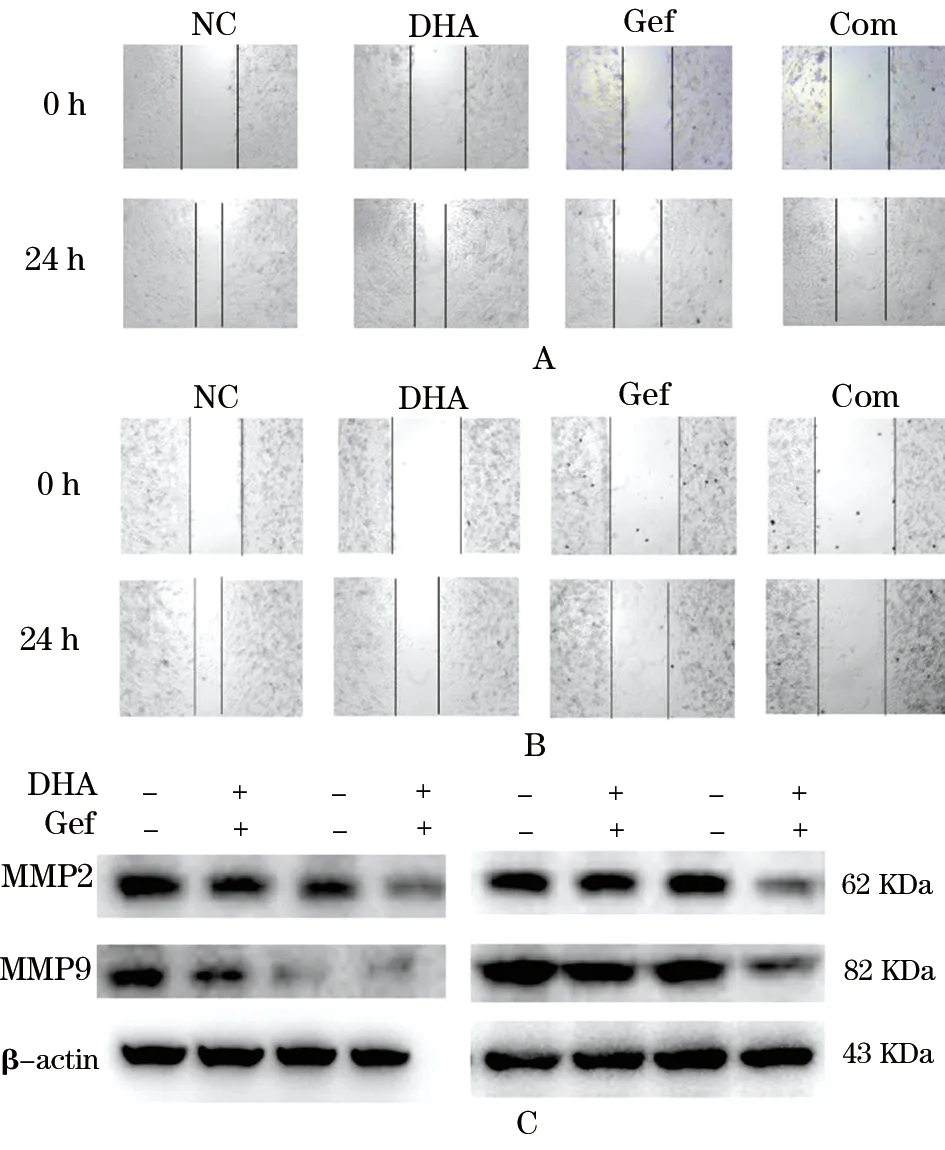
图3 DHA联合GEF对肺腺癌细胞A549迁移的影响

分组A549SPC-A-1NC组55.47±0.0456.36±0.08DHA组46.49±1.2638.09±1.22GEF组32.63±5.0524.47±1.03Com组20.81±2.87①②③8.32±0.83①②③
注:与NC组比较,①P<0.001;与DHA组比较,②P<0.001;与GEF组比较,③P<0.001
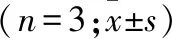
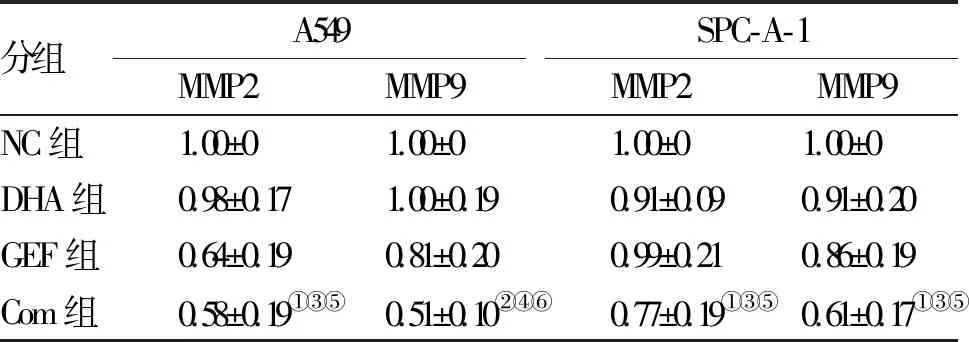
分组A549MMP2MMP9SPC-A-1MMP2MMP9NC组1.00±01.00±01.00±01.00±0 DHA组0.98±0.171.00±0.190.91±0.090.91±0.20GEF组0.64±0.190.81±0.200.99±0.210.86±0.19Com组0.58±0.19①③⑤0.51±0.10②④⑥0.77±0.19①③⑤0.61±0.17①③⑤
注:与NC组比较,①P<0.01,②P<0.001;与DHA组比较,③P<0.01,④P<0.001;与GEF组比较,⑤P<0.01,⑥P<0.001
3 讨 论
肺癌因其高发病率和高病死率而成为严重威胁人类健康的肿瘤之一,其中肺腺癌的比例逐年升高。虽然手术、放化疗、分子靶向治疗、免疫治疗,以及中医中药治疗在肺癌中得到了广泛的应用,但肺癌5年生存率低,晚期肺癌治疗效果仍然有限。
GEF是美国食品药品监督管理局于2003年批准上市的用于治疗晚期NSCLC的一种分子靶向药物,它是一类EGFR酪氨酸激酶的ATP竞争性抑制药。GEF对乳腺癌细胞系[12]、膀胱癌细胞系[13]的有效性也得到了证实。GEF主要应用于携带EGFR19号外显子缺失突变或21号外显子L858R突变的NSCLC患者。部分NSCLC患者存在EGFR T790M突变、EGFR20号外显子插入突变等耐药突变,对GEF原发或继发耐药[14,15],这限制了NSCLC的治疗效果。因此,寻找一种新的治疗策略来提高疗效,改善患者的生活质量至关重要。青蒿素作为一种广泛应用于疟疾治疗的药物,最早由屠呦呦教授团队在20世纪70年代合成,DHA是青蒿素的活性代谢产物。目前已有报道,青蒿素及DHA能够起到抑制肿瘤生长的作用[10, 11, 16-18]。但其与GEF配伍治疗肺癌的报道较少。
本研究在人肺腺癌细胞A549和SPC-A-1细胞中首先探究了DHA联合GEF对于肿瘤增殖的作用,发现其能显著抑制肺腺癌细胞的增殖,且具有时间依赖性。二者协同作用大于单药对肿瘤的生长抑制作用。细胞周期紊乱是肿瘤细胞的一项重要特征,肿瘤细胞会不断进入新的细胞周期,导致肿瘤恶性增殖。因此阻滞肿瘤细胞周期对抑制肿瘤生长尤为关键。本课题发现,使用DHA联合GEF,使肺癌细胞系出现G0/G1期阻滞,镜下细胞密度降低,生长减缓。WB显示Cyclin D1和CDK4均显著降低。Cyclin D1是一种细胞周期蛋白,普遍存在于真核细胞中,其表达与真核细胞的细胞周期同步升降;CDK4是细胞周期蛋白依赖性蛋白激酶家族成员之一。细胞周期蛋白依赖性蛋白激酶与细胞周期蛋白协同作用,通过对丝氨酸/苏氨酸蛋白的化学作用驱动细胞周期。Cyclin D1和CDK4表达降低预示细胞周期无法顺利进行,即产生周期阻滞。WB结果进一步说明DHA联合GEF协同抑制肺腺癌细胞的生长。
肺癌常通过淋巴和血液转移。Gu等[19]发现,在NSCLC患者中,无淋巴微转移的患者术后复发率为7%,而术前即存在淋巴微转移的患者复发率增至45%。血行转移常见部位为骨、脑、肝、肺、肾上腺等,因此抑制癌细胞的转移是控制肺癌进展的重要策略。MMP家族在细胞迁移中起到关键作用,共有26个成员,其中研究较多的是MMP2和MMP9。MMP2和MMP9能降解细胞外基质,使得肿瘤细胞脱离原发灶[20],随血液或淋巴液转移到新的部位生长。本研究发现联合应用DHA和GEF有效抑制了肺腺癌细胞的迁移能力,并且该过程主要是通过抑制MMP2和MMP9实现的。
综上所述,本研究发现,DHA和GEF能够协同抑制肺腺癌细胞A549和SPC-A-1的增殖,阻滞细胞周期,并通过MMP2和MMP9抑制细胞迁移,下一步我们将继续探究DHA联合GEF对肺腺癌的抑制作用,以及逆转上皮间质转化的过程及潜在机制,为进一步揭示两类药物的抗肿瘤作用和未来的临床应用提供理论依据。

