HBsAg阳性心脏死亡器官捐献供肝的选择性使用及对肝移植预后的影响
肖 桦,陈新国,朱雄伟,吴凤东,王维伟,窦古枫,牛玉坚
随着医药科技的进步,肝移植已成为公认的、治疗终末期肝病(end-stage liver disease,ESLD)的最佳选择[1,2],而供肝缺乏是影响肝移植实施的最主要障碍。供需之间的巨大缺口促使人们放宽条件而使用所谓的“边缘供体”,包括病毒感染的供体[3]。据估计,全球乙肝病毒(hepatitis B virus, HBV)慢性感染者约有3.5亿,合理使用HBV感染的供体有助于扩大供体池,缓解供体紧缺状况。抗-HBc阳性供肝用于肝移植被认为是安全的[4,5],而HBsAg阳性供肝的使用存在争议,因为缺乏足够的安全性数据。丙肝阳性供体肝移植后纤维化进展较快[6,7],而HBsAg阳性供肝肝移植后的组织病理学变化鲜有报道。鉴于此,本研究结合肝功能生化指标、病毒学变化情况以及移植受者生存情况,研究了HBsAg阳性DCD供肝手术前后的组织病理学变化,以期建立可供临床借鉴的安全性参数,为这类供肝的安全使用提供实践经验和理论指导。
1 对象与方法
1.1 对象 选择2011-03至2017-09在解放军总医院第三医学中心接受HBsAg阳性DCD供肝的移植受者53例,符合入选标准和排除标准。男45例,女8例;年龄(54±7)岁;原发疾病分别为原发性肝癌30例,慢性重型乙型肝炎16例,失代偿性肝硬化7例;术前血清HBsAg滴度>250 U/ml者28例,HBsAg滴度≤250 U/ml者25例;HBV-DNA阳性者19例;术前MELD评分为(15±5)分。53例HBsAg阳性供者中,男31例,女22例;年龄(42±11)岁;死亡原因分别为脑出血28例,脑外伤25例;血清HBsAg滴度>250 U/ml者30例,HBsAg滴度≤250 U/ml者23例;HBV-DNA阳性供者15例;供肝热缺血时间为(12±9) min,冷缺血时间为(241±43)min。
1.2 受者入选标准和排除标准
1.2.1 入选标准 (1)HBsAg阳性;(2)急性或亚急性重型肝炎急需肝移植挽救生命而短期内无法获得阴性供肝;(3)肝细胞性肝癌(Hepatocellular carcinoma, HCC)需要肝移植治疗而等待供体时间超过3个月且无法获得阴性供肝或超加利福尼亚大学旧金山分校(University of California at San Francisco, UCSF)标准但没有肝外转移;(4)失代偿性肝硬化伴有严重的进行性肝性中枢神经损伤而短期内无法获得阴性供肝。
1.2.2 排除标准 (1)合并有甲、丙、戊型肝炎病毒或HIV感染;(2)合并有严重的肺动脉高压(术前平均肺动脉压大于>35 mmHg,通过治疗仍不能下降者);(3)需进行肝肾联合移植者。
1.3 HBsAg阳性DCD供肝选用的解放军总医院第三医学中心标准 (1)供者为心脏死亡器官捐献;(2)年龄18~60岁;(3)无全身感染征象;(4)无恶性肿瘤;(5)无中毒情况;(6)实验室检查,血清HBsAg阳性,甲、丙、戊型肝炎抗体阴性,HIV抗体阴性,梅毒抗体阴性,丙氨酸氨基转移酶(Alanine aminotransferase, ALT)0~80 U/L,天冬氨酸氨基转移酶(Aspartate transaminase, AST)0~80 U/L,总胆红素0~51.2 μmol/L;(7)肝脏影像学检查无异常且弹性超声示肝脏弹性在正常范围内或有轻度异常;(8)肉眼观察:灌注良好,细腻光亮,红褐或微黄,各叶比例协调;手触检查:质地柔韧而有弹性,指压有痕而很快复原,无结节和硬化[7]。
1.4 HBsAg阳性供肝肝移植围术期抗乙肝用药的武警方案[8]受者术前开始使用高耐药基因屏障的强效抗乙肝药(恩替卡韦,0.5 mg/d;HBV-DNA>103 U/ml者用量为1 mg/d),如果发生耐药变异则联合使用恩替卡韦和阿德福韦酯(10 mg/d)。术后待血流动力学稳定即开始经胃管注入或口服给药,长期使用。
1.5 抗排斥用药 术中常规经静脉给予20 mg巴利昔单抗和甲泼尼龙(5~10 mg/kg体重)进行免疫诱导。术后常规应用钙调磷酸酶抑制药、霉酚酸酯和激素三联抗排异治疗。激素用量逐渐递减,术后1个月时停用。超米兰标准的HCC患者于术后1个月开始将他克莫司分步转换为西罗莫司。
1.6 随访管理 肝移植受者得到严密随访,中位随访时长45.7(13.6~77.8)个月。53例患者中生存期超过1年者46例,其中45例接受了术后肝穿活检,术后肝穿距手术的中位时长为39.4(12.3~65.5)个月。ELISA法测定血清HBsAg、anti-HBs、HBeAg和 anti-HBc,PCR法测定HBV-DNA。依据病情,每1~2个月行一次移植肝超声检查。如有肿瘤复发迹象,则行CT或MRI等检查。记录不良事件、死亡时间及死亡原因。
1.7 组织病理学检查 采用HE及Masson染色,肝组织常规石蜡包埋固定,进行脱蜡、染色、透明、封固后,由两位病理学专家进行盲式阅片,结果不一致时送外院专家审阅。病理学评分按照Ishak分期系统进行。每个标本给出一个炎性级别(G,0~18分)和一个纤维程度级别(F,0~6分)。
1.8 统计学处理 使用SPSS18.0软件包进行统计学分析。计量资料表示为中位数,正态分布者用t检验,非正态分布者用U检验。计数资料用χ2检验。HBsAg阳性供肝的病理学变化用配对t检验。用Kaplan-Meier法进行生存分析,用Spearman对阳性供肝的零点组织病理与术后1年时肝功能指标进行相关分析。P<0.05为差异有统计学意义。
1.9 伦理审查 本组病例的供肝来源和分配均符合中国人体器官管理条例(2007版)和中国心脏死亡器官捐献指南[9,10]要求,所有供肝均为DCD供肝。每例手术均获得解放军总医院第三医学中心医学伦理委员会审核通过。
2 结 果
2.1 HBsAg阳性DCD供肝肝移植术后生存率 本组53例术后1、3、5年生存率分别为86.8%、75.5%和62.3%。生存曲线见图1。

图1 HBsAg阳性DCD供肝肝移植受者生存率
2.2 肝移植术后病毒学变化 本组53例中,46例生存期超过1年,随访期内血清HBsAg全为阳性。但15例HBV-DNA阳性的供肝受者术后不同时间发生了转阴,具体为术后3个月9例,6个月4例,9个月和12个月各1例。
2.3 肝移植术后1年时肝功能状况 46例术后生存时间超过1年的HBsAg阳性供肝肝移植,其术后1年时的ALT、AST和TBIL中位数(四分差)分别为38(47)U/L、21(29)U/L和18.3(10.7)μmol/L,术后1年时ALB、INR、MELD评分均数分别为(45.8±3.4)g/L、(1.2±0.1)和(7.9±1.6)分。
2.4 肝组织病理学变化 本组53例供肝在术中均进行零点肝活检,其中46例术后生存时间超过1年的HBsAg阳性供肝肝移植中有45例在术后随访期接受了二次肝活检,术中零点组织病理显示轻度炎性反应(1.98±0.67)和轻度纤维化(0.83±0.58),而随访期内病理显示炎性减轻(1.65±0.79,P=0.02)、纤维化程度评分没有统计学变化(0.68±0.61,P=0.31)。见图2。

图2 供肝活检组织病理学比较
2.5 供肝零点肝组织病理状况与术后1年时移植物功能的相关分析 术后生存超过1年的46例HBsAg阳性供肝肝移植受者,术中供肝零点的炎性程度与术后肝功能指标无关,而纤维化程度与部分肝功能指标相关:与TBIL、INR和MELD评分的相关系数分别为0.56(P=0.04)、0.59(P=0.02)和0.68(P=0.01),见表1。
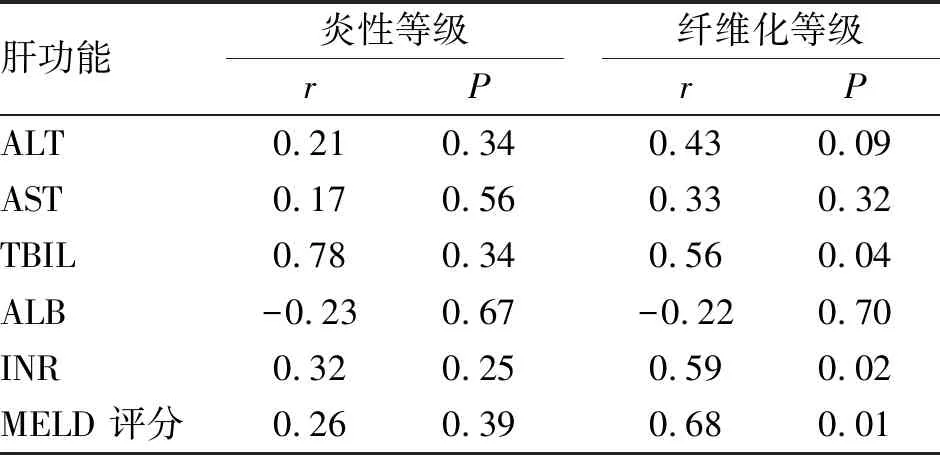
表1 HBsAg阳性DCD供肝术中零点肝活检与术后1年时肝功能指标相关分析
2.6 供肝零点肝纤维化分级与术后生存分析 按照Ishak评分系统将肝组织纤维化程度分为0~6级。F0级者9例,于术后19个月和42个月因肿瘤复发各死亡1例,7例获长期存活;F1级者29例,1例于术后3 d死于上消化道出血,1例于术后43个月死于肺部感染,7例分别于术后不同时间死于肿瘤复发,20例获长期生存;F2级者12例,其中3例分别于术后7、11 d和43个月死于肺部感染,2例于术后10 d和14 d死于原发性肝无功,2例分别于术后14个月和17个月死于肿瘤复发,5例获长期存活;F3级者3例,1例于术后7 d死于原发性肝无功,1例于术后9 d死于肺部感染,1例获长期存活;没有使用F4级及以上级别供肝。见表2。
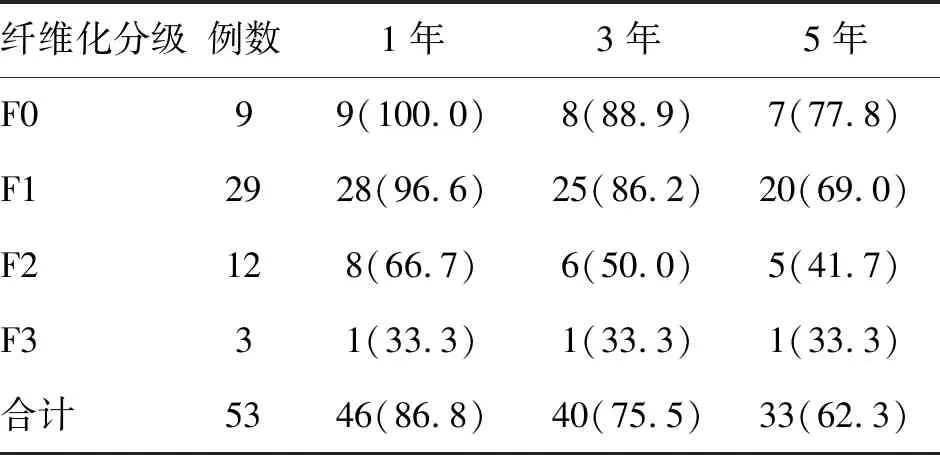
表2 HBsAg阳性DCD供肝零点肝纤维化不同分级下患者术后生存情况 (n;%)
3 讨 论
3.1 HBsAg阳性DCD供肝肝移植的抗乙肝措施 对于乙肝相关性肝病肝移植受者,如果接受的是HBsAg阴性供肝,那么标准的抗乙肝方案是联合使用NAs与HBIG[11],而对于HBsAg阳性供肝肝移植受者,术后抗乙肝方案尚未达成共识。有研究报道,联合使用HBIG与NAs能够提高移植物和移植受者生存率[12]。而另有研究报道,尽管长期联合使用HBIG与NAs,血清HBsAg也不能转阴;联合使用HBIG与NAs,并不比单用NAs有更多收益[13];即便是单用NAs,比阴性供肝肝移植的预后也不差[14]。本研究的抗乙肝方案只给予了高耐药基因屏障药物(恩替卡韦),不用HBIG,如果发生耐药变异则联合使用恩替卡韦与阿德福韦。结果显示,尽管随访期内血清HBsAg全部为阳性,但术后没有因为病毒复制而致肝功能异常者,所有病例的HBV-DNA都得到了良好控制,印证了作者前期的研究报道[8]。这不仅获得良好的抗病毒效果,还节省了一大笔医药费用。因此,建议对于HBsAg阳性DCD供肝肝移植受者,只用高耐药屏障的抗病毒药(恩替卡韦或新近上市的替诺福韦)即可,无需联合使用HBIG,但要监测肝功能和病毒学指标变化情况。
3.2 HBsAg阳性DCD供肝的选择性使用及对移植物功能和移植受者生存的影响 关于HBsAg阳性供肝的使用安全性,美国移植受体注册系统(SRTR)数据库的回顾性分析报告显示:1987—2010年,共实施了78例HBsAg阳性供肝肝移植,在术前等待紧急状态、供受体性别、年龄、MELD评分、热缺血时间等指标匹配相同的条件下,HBsAg阳性供肝与阴性供肝的5年生存率无统计学差异,提示采用HBsAg阳性供肝不会降低移植患者存活率[15]。课题组前期研究结果显示,HBsAg阳性供肝选择性用于超加利福尼亚大学旧金山分校(UCSF)标准肝癌肝移植,能在一定程度上延长患者生命、改善患者生活质量[19]。余松峰等[16]认为HBsAg阳性供肝可以作为一种安全有效的边缘供肝。
关于HBsAg阳性供肝的选择方法,在弹性超声应用之前,多依据供者的血液生化检查、供肝影像学特征及开腹后对供肝的直接视觉和触觉检查[7,17,18],而这些方法容易受主观因素影响而难以准确反映肝脏的真实功能状况。弹性超声在临床应用之后,使得评估精确度有所提高[19,20],但仍不能满足临床的精准需要。所以,有学者在术前进行肝穿病理检查以期更精确知晓供肝情况,但鲜有供肝术中零点组织病理与术后随访期肝穿病理对比的追踪观察报道。
本课题组在自己制定的供肝选用标准的基础上,对零点肝组织病理与术后移植物和移植受者生存的关系进行了分析,结果显示:与零点肝组织相比,随访期肝组织炎症显著减轻而纤维化程度没有显著变化;供肝零点炎性程度与术后肝功能指标无关,而零点纤维化程度与部分肝功能指标显著相关。本组资料的HBsAg阳性供肝是用于紧急情况下的肝移植治疗,多数是MELD评分较高或进展期肝癌患者,这可能是生存率较低的主要原因。本组病例随访期内死亡20例,其中原发性肝无功3例,F2期者2例(2/12),F3期者1例(1/3),这可能与供肝质量有关;其余死亡原因分别为肿瘤复发11例、感染5例、消化道出血1例,作者认为这些死亡与供肝质量无直接关系。故我们建议,供肝选择应在传统经典选择标准基础上增加零点肝活检,F0期和F1期者可放心使用,F2期者要选择性用于病情较轻的受者,F3期者最好不用。
综上所述,对于HBsAg阳性DCD供肝,零点肝组织病理学检查对于指导供肝的合理使用具有重要意义,F0期和F1期者可正常使用,F2期者选择性用于病情较轻的受者为宜,F3期者最好不用。通过科学选择供受体,并给予合理抗乙肝措施,能使供肝得到充分利用并获得良好预后。

