老年人胃肠道间质瘤的c-kit和PDGFRa基因突变检测
王晓红,刘 然
胃肠道间质瘤(gastrointestinal stromal tumor, GIST)是一类起源于胃肠道间叶组织的肿瘤,占消化道间叶肿瘤的大部分[1,2]。GIST占胃肠道恶性肿瘤的1%~3%,多见于老年人。GIST大部分发生于胃和小肠,其次是直肠和食管[2,3]。1998年, Hirota等[4]发现了GIST特征性表达KIT蛋白(CD117)并存在C-kit 基因的功能获得性突变。2003年,Heinrich等[5]发现部分缺失c-kit基因突 变的GIST中存在血小板源性生长因子受体α(platelet-derived growth factor receptorα,PDGFRα)的突变。突变的 KIT/PDGFRα可自动磷酸化,进而持续激活导致肿瘤发生[5-7]。目前,关于GIST致病的分子生物学机制在国外研究的比较深入。在我国,虽然发病率越来越多,但是相关的研究较少[8-10]。本研究旨在分析我国老年人GIST的分子病理学特征,为确立诊断和下一步的生物靶向治疗提供理论依据。
1 材料与方法
1.1 材料 收集我院病理科2005-01至2017-12存档的老年GIST患者标本79例。入选患者均为第1次手术,均经过病理确诊为GIST且资料完整。选择同期老年胃肠道平滑肌瘤16例,平滑肌肉瘤7例,神经鞘瘤5例,共28例患者标本作为对照组。
1.2 方法
1.2.1 标本免疫组化检测CD117、CD34、S-100、SMA和Dog-1 所有组织标本均经10%中性甲醛固定6~30 h,石蜡包埋,4 μm连续切片。均由两名高年资病理医师根据WHO软组织肿瘤分类(2013)的有关诊断标准进行诊断和分型[2]。在形态学诊断的基础上,对每例标本均进行免疫组织化学染色,所用抗体分别为兔抗人CD117单克隆抗体、兔抗人CD34单克隆抗体、鼠抗人S-100单克隆抗体、兔抗人SMA单克隆抗体和兔抗人Dog-1单克隆抗体。所用抗体均购自北京中杉金桥生物技术有限公司。所有抗体都采用SP二步法,DAB显色。
1.2.2 c-kit基因及PDGFRa基因突变检测 石蜡包埋组织的DNA提取,试剂盒由Gene公司提供。DNA纯化后,按照参考文献[9]的设计引物,PCR扩增c-kit基因第9,11,13,17号外显子和PDGFRa基因第12,18号外显子。提取石蜡切片组织DNA,并采用聚合酶链反应(PCR)扩增目的基因。PCR产物纯化后,用ABI3l0型测序仪(Applied Biosystems)测序,结果与基因库(GeneBank)序列核对。
2 结 果
2.1 一般资料 79例老年GIST患者中,女37例(46.8%),男42例(53.2%)。年龄60~92岁,其中65~75岁58例(73.4%),为GIST高发年龄。肿瘤原发于胃36例,小肠24例,结直肠8例,食管6例,肠系膜5例。
2.2 组织分型及免疫分型 GIST组织学分析,梭型细胞型62例(78.5%),见图1A; 上皮细胞型9例(11.4%),混合细胞型8例(10.1%)。图1B-D为免疫组化结果,染色显示肿瘤细胞CD117+ (76/79, 96.2%)、CD34+(66/79, 83.5%)、DOG1+(72/79, 91.1%)。对照组不表达CD117和DOG1。
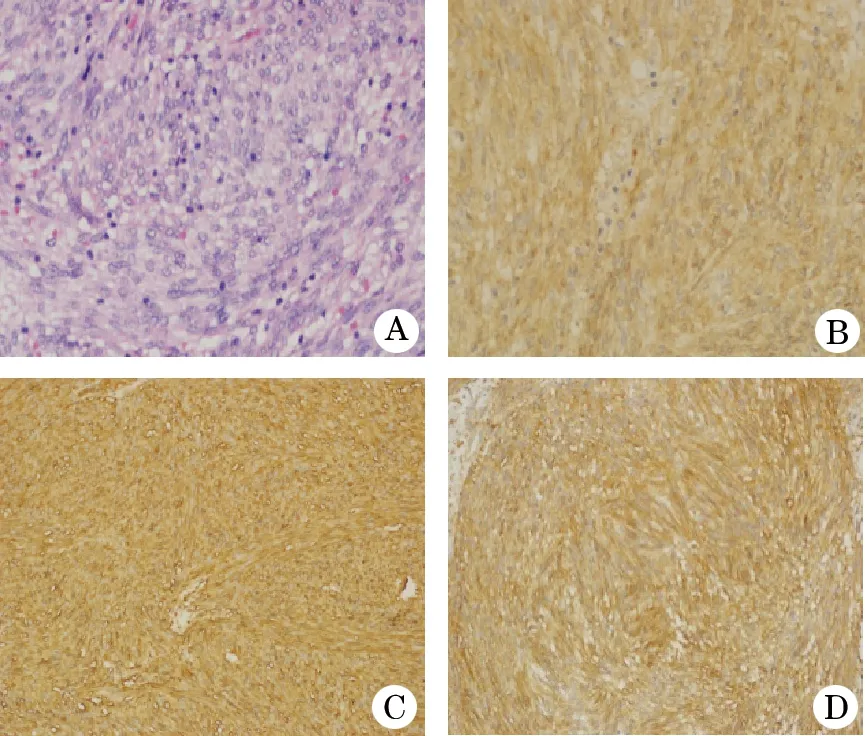
图1 GIST的组织学和免疫表型
A.梭型细胞型GIST(HE,×200);B.梭型细胞型GIST的弥漫性CD117阳性表达(SP,×200);C.梭型细胞型GIST的弥漫性CD34阳性表达(SP,×200);D.梭型细胞型GIST的弥漫性DOG1阳性表达(SP,×200)
2.3 c-kit基因突变情况 两组均进行了基因检测。79例老年GIST患者中有70例(88.6%)检测到c-kit基因突变,69例为CD117阳性表达;其中, 11号外显子突变66例(94.3%),9号外显子突变4例(5.7%),未检出17号外显子突变。突变类型分析显示:11号外显子突变中,除了5例为纯合性外,61例(92.4%)为其他杂合性突变;缺失突变6例;点突变4例;插入突变2例;点突变结合缺失突变的有1例。另外,1例78岁男性患者检测到一个位于c-kit 641号的氨基酸由异亮氨酸突变为脯氨酸的突变位点。对照组未检出c-kit基因突变。
2.4 PDGFRa基因突变情况 79例GIST中,70例发生c-kit基因突变,其余9例进行PDGFRa基因突变检测, 有7例显示为PDGFRa突变。7例中有2例无CD117表达,突变类型均为18号外显子突变,6例为最为常见的点突变(D842V);在另1例检测到一种变异性突变,即氨基酸843-846处MHD的框内缺失,接着有一个S847T点突变。2例野生型GIST,仅为CD117、DOG1和CD34阳性,无平滑肌和神经标记物表达,未检出PDGFRa基因突变。对照组亦未检出该基因突变。
3 讨 论
GIST以共同表达CD117、DOG1和CD34为特征,以c-kit和PDGFRa基因功能获得性突变为其发生的重要分子机制[11-14]。对于组织学形态符合GIST,且CD117和DOG1阳性的病例可以直接诊断,适于进一步做基因检测的病例包括以下情况:(1)部分拟进行靶向治疗的患者;(2)CD117与DOG1表达不一致者;(3)鉴别c-kit/PDGFRa基因突变以外的野生型GIST;(4)鉴别同时性和异时性、多原发性GIST;(5)复发、转移者或继发性耐药者。绝大多数GIST的诊断需结合免疫组织化学各标记检测结果。CD117阳性部位在胞膜、胞质及核旁高尔基体区,但有5%~10%的病例CD117阴性[11]。对于组织学形态符合GIST,而免疫组化CD117或DOG-1阴性的肿瘤,均应进一步检测这两种基因的突变情况以协助诊断。文献[11]报道,CD117、DOG1表达与胃肠间质瘤侵袭危险度有密切联系,本组79例病例均具有CD117/DOG1表达和c-kit/PDGFRa基因突变,最常见的为11号外显子突变,其次是9号外显子突变,未检出17号外显子突变,这些改变是该肿瘤诊断的重要指标,也为其分子靶向治疗提供了依据。
GIST中C-kit突变导致KIT结构改变,不需与其配体干细胞因子相互作用而自身形成二聚体,激活下游的信号转导通路,引起细胞异常增殖与凋亡抑制,从而形成肿瘤。由于各研究组用于提取DNA的组织、实验方法、病例构成等不同,因而其突变率临床报道差异很大,为30%~92%[10, 14]。GIST 中c-kit基因突变最常见于外显子11,突变方式可有点突变、片段的缺失和重复突变,第550~560位点即外显子11 5′端以点突变和缺失突变为主,第570~580位点即3′端以重复突变为主[7]。本研究中GIST患者c-kit基因外显子11突变最为常见,占82.3%,与文献[13]报道一致。由此可见,该外显子的单一检测就可以解决大部分GIST的诊断问题。
PDGFRa与c-kit同属于Ⅲ型酪氨酸蛋白激酶家族,两者结构极为相似[14]。在GIST中PDGFRα基因突变率虽然不高,但对于c-kit阴性GIST的检出具有重要价值。越来越多有关GIST的基因突变检测发现,有10%的肿瘤未检出c-kit/PDGFRa基因突变,对于这些野生型GIST的甄别具有重要临床意义,因为其对络氨酸激酶抑制药的靶向治疗不敏感。此外,野生型GIST可能存有分子异常,如琥铂酸脱氢酶缺陷、BRAF突变、14q缺失、TP53突变、P13K信号通路异常等分子改变[2, 6]。本研究发现的2例野生型GIST,对于临床治疗具有重要参考价值,因为这些病例对现有的靶向药物可能不敏感。另外,我们所发现的位于c-kit 641号氨基酸由异亮氨酸突变为脯氨酸的突变位点和PDGFRa的变异性突变(S847T),是否为新的突变类型?尚有待于进一步验证。
目前,关于GIST的治疗取得了显著的进展。针对c-kit、PDGFRa基因突变酪氨酸激酶的抑制药越来越多的用于临床治疗。临床各期研究发现,GIST中c-kit和PDGFRa基因突变位点与格列卫分子靶向治疗的疗效有关。c-kit基因11外显子突变的肿瘤对格列卫疗效显著,而9号外显子突变者疗效欠佳。大多数PDGFRa基因突变者(除外D842V)对格列卫治疗敏感。无c-kit和PDGFRa基因突变者基本无效[15]。因此,GIST基因突变检测对辅助诊断和指导临床治疗具有重要参考价值。

