红薯叶面膜制备及其性能研究
延永,高园,杨蓉蓉
(商洛学院 生物医药与食品工程学院,陕西商洛726000)
红薯(Ipomoea batatas),旋花科番薯属一年生草本植物,红薯在我国大多数省份普遍栽培。红薯叶是红薯生长过程中茎上的叶子,药食两用,富含糖、淀粉、蛋白质、氨基酸、VC、矿物质、黄酮、类胡萝卜素等许多活性成分[1],它的功效主要体现在提高身体免疫力[2]、减少心脑血管疾病[3]、加速肠胃蠕动治疗便秘[4]、强化视力、美容养颜[5]等方面。但令人遗憾的是,人们在秋季收获红薯块茎后,大量叶、梗中只有少量被食用,剩余大部分用作牲畜饲料,有时候还将其进行焚烧,这不仅对环境造成严重污染,而且造成资源浪费。面膜是一种深受爱美人士欢迎的护肤产品,它具有吸附皮肤污物、去除多余类脂化合物和坏死细胞的作用,通过面膜的收缩力,改善血液循环,使皮肤光洁细腻,常作为清洁、保养和营养面部肌肤的化妆品,得到越来越多人的青睐[6]。面膜最初采用人工合成的化学制品作为主要添加成分,但随着科学的发展,人们逐步认识到长期使用化学药品所存在的安全问题,开始将研究的方向逐渐转移为天然药物[7]。鉴于红薯叶在美容养颜领域的突出功效,本研究首次以红薯叶提取物为主要有效成分,通过优化工艺,开发出具有抗氧化、抑菌、保湿活性等功效的面膜,并对其性质进行研究,既能促进红薯叶资源的开发,又丰富了天然药物面膜市场的产品类别,具有重要的社会经济价值和环保价值。
1 材料与方法
1.1 试验材料
红薯(Ipomoea batatas)叶:摘于商洛学院后山。
1.2 试剂与仪器
无水乙醇、硝酸铝、氢氧化钠、硝酸钠、羧甲基纤维素钠、丙二醇、甘油、尼泊金甲酯、汉生胶、食用香精、1,1-二苯基-2-三硝基苯肼均为市售AR。芦丁标品(中国药品生物制品鉴定所),采微型粉碎机(FW80天津泰斯特仪器有限公司);超声清洗仪(KH5200E昆山禾创超声仪器有限公司);紫外-可见分光光度计(UV1800日本岛津);高速离心机(TGL-16G上海安亭科学仪器厂)。
1.3 试验方法
1.3.1 标准曲线
称取0.2 g已干燥的芦丁标准品,30%乙醇定容至100 mL容量瓶,得到2 mg·mL-1的标准液。分别移取0、0.5、1.0、1.5、2.0、2.5 mL标准液于25 mL容量瓶,依次加入5%NaNO2溶液0.7 mL,摇匀后静置6 min,加入10%Al(NO3)3溶液0.7 mL,摇匀后静置6 min,再加入1 mol·L-1的NaOH溶液10.0 mL,用30%乙醇定容,摇匀,静置15 min,在波长510 nm处测定吸光度测得该系列溶液的吸光度[8-9]。以吸光度为纵坐标,溶液浓度为横坐标,绘制标准曲线A=8.7981C+0.0276,R2=0.9979。
1.3.2 红薯叶总黄酮提取及含量测定
将干燥的红薯叶粉末(过60目筛)2.00 g倒入圆底烧瓶,加入60%乙醇溶液80 mL,加热回流1.5 h,冷却后,抽滤,60%乙醇洗涤(10 mL,3次),合并滤液,旋转蒸发仪除去大部分溶剂,将剩余物转移至100 mL容量瓶中,用蒸馏水定容,得到母液。移取1 mL于25 mL容量瓶,依次加入5%NaNO2溶液0.7 mL,摇匀后静置6 min,加入10%Al(NO3)3溶液0.7 mL,摇匀,静置6 min,再加入1 mol·L-1的NaOH溶液10 mL,用30%乙醇定容,摇匀,静置15 min,在波长510 nm处测定吸光度,利用回归方程计算红薯叶中总黄酮的提取率φ(%):

式中,C为溶液总黄酮浓度,mg·mL-1;N为稀释倍数,mL;V为提取液体积,mL;W为红薯叶的质量,mg。
1.3.3 红薯叶总黄酮提取物对DPPH自由基的清除作用
称取DPPH(1,1-二苯基-2-三硝基苯肼)标准品20.00 mg,乙醇定容至500 mL容量瓶,得质量浓度0.04 mg·mL-1的DPPH溶液。依次配制1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 mg·mL-1红薯叶提取物系列溶液,取4 mL红薯叶提取液和DPPH溶液1 mL混合后稀释至10 mL摇匀后在室温下避光反应30 min,于517 nm处测定其吸光度Ai;取4 mL稀释液和DPPH溶液1 mL混合后稀释至10 mL,摇匀后在室温下避光反应30 min,于517 nm处测定其吸光度Aj;取4 mL去离子水和DPPH溶液1 mL混合后稀释至10 mL,摇匀后在室温下避光反应30 min,于517 nm处测定其吸光度A0[10]。DPPH自由基清除率δ(%)计算公式:
1.3.4 红薯叶面膜的制备
1)面膜制备方法
A相:准确称取对应量的羧甲基纤维素钠、丙二醇和甘油置于100 mL烧杯中,在80℃水浴下搅拌至完全溶解,备用。
B相:准确称取对应量尼泊金甲酯、红薯叶提取液(1.3.2所得)、汉生胶、香精放置于100 mL烧杯中,在80℃水浴下搅拌至完全溶解,备用。
搅拌下,将A相缓慢倒入B相中,加适量蒸馏水至面膜液重50 g,继续搅拌20 min,至各相均匀分布得到面膜液。
2)单因素试验优化
在面膜制作过程中,加入丙二醇1.5 g、羧甲基纤维素钠0.75 g、尼泊金甲酯0.025 g,依次调整甘油加入量为2.5、5.0、7.5、10.0、12.5 g,考察甘油对面膜保湿性的影响;加入甘油7.5 g、羧甲基纤维素钠0.75 g、尼泊金甲酯0.025 g条件下,依次调整丙二醇加入量为0.5、1.0、1.5、2.0、2.5 g,考察丙二醇对面膜保湿性的影响;加入甘油7.5 g、丙二醇1.5 g、尼泊金甲酯0.025 g条件下,依次调整羧甲基纤维素钠加入量为0.25、0.5、0.75、1.0、1.25 g,考察羧甲基纤维素钠对面膜保湿性的影响;加入甘油7.5 g、丙二醇1.5 g、羧甲基纤维素钠0.75 g条件下,依次调整尼泊金甲酯加入量为0.015、0.02、0.025、0.03、0.035 g,考察尼泊金甲酯对面膜保湿性的影响。
1.3.5 正交试验优化
根据单因素试验结果,采用正交试验L9(34)筛选出红薯叶面膜优质配方(以所得面膜的保湿性为评价标准)。因素与水平表如表1所示。

表1 红薯叶面膜优化的正交试验的因素与水平
1.3.6 体外保湿试验
选用小型玻璃板贴一层医用透气胶带模拟人体皮肤涂抹护肤品的过程[11]。试验温度保持在25℃,先称取胶带的重量(M0),然后称取适量红薯叶面膜均匀涂布于模拟装置表面,记录涂抹的面膜质量(M1)。将制成的模拟装置置于含有CaCl2饱和溶液的干燥器内。室温条件下放置30 h后称取含有面膜胶带的重量(M2)。保湿率W(%)计算公式:
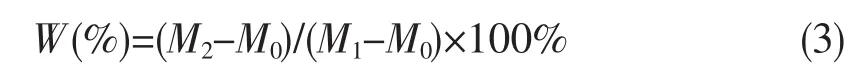
1.3.7 面膜的抑菌试验
1)液体培养基的制备
称取牛肉膏2.51 g、蛋白胨5.00 g、氯化钠2.50 g,放入烧杯中。牛肉膏转移至烧杯后加热溶化,加入500 mL水,搅至完全溶解,调节pH在7.1~7.5,然后用烘箱在120℃下灭菌2 h。
2)菌液的培养及TTC溶液的配制
菌液的培养:在无菌条件下,取5 mL的液体培养基放入试管中,接种大肠杆菌和金黄色葡萄球菌,放入36℃的摇床,72 h后,测定其吸光度A≥0.5,然后将每种菌的浓度进行稀释,直至吸光度A为0.1。
TTC溶液的配制:取50 mg红四氮唑溶解于200 mL已灭菌的培养基中。
3)面膜的抑菌性检测
试验采用96孔板进行显色观察。用移液枪将TTC溶液(100 μL)分别注入第一行、第二行、第八行及第十二行的八个孔内。在各行第一个孔中注入面膜液100 μL,搅拌均匀后吸回100 μL注入同一行的第二个孔内,搅拌均匀后吸入100 μL注入同一行的第三个孔,依次进行到最后一个孔,并从最后一个孔内吸回的100 μL面膜连同枪头弃掉[12]。将其放入生化培养箱,温度调制36℃,12 h后观察试验结果。肉眼无细菌生长的药物最低浓度为最低抑菌浓度(MIC)。
1.3.8 红薯叶面膜的性能评价
1)性状与细腻度
取红薯叶面膜液5.0 g,置于50 mL的烧杯中,观察其外观性状。将其涂布于皮肤上,用眼睛、鼻子、手感等感官指标评价其细腻度[11]。
2)酸碱度
取红薯叶面膜液5.0 g,溶解于100 mL蒸馏水中,加热至微沸后,冷却至室温,用pH计测定pH值。
3)稳定性
耐热、耐寒试验:取红薯叶面膜5.0 g装入10 mL的试管中,将试管口用保鲜膜封住,分别置于高温和低温的环境中,放置24 h,取出,室温放置20 min后,观察与试验前是否有明显差异。
离心试验:在常温状态下,取红薯叶面膜8.0 g均分为两组,分别装入4 mL的离心管中,每个管中含面膜4.0 g,置于离心机中以1 000、2 000、3 000、4 000、5 000 r·min-1的转速离心10 min,取出,观察样品是否分层。
4)皮肤刺激性测试
选取30名皮肤健康的志愿者,年龄20~25岁10名,年龄26~35岁10名,年龄36~45岁10名,各年龄阶段男女各半。在受试人员的左手背上涂敷0.8 g面膜样品,面积大约为16 cm2,与右手背进行对比,12 h后观察左手背涂敷面膜部位的皮肤现象,连续测试两周,进行评价。
2 结果与分析
2.1 红薯叶提取物中总黄酮含量
在517 nm处测定红薯叶中总黄酮吸光度为2.144,经求得母液中红薯叶总黄酮浓度为5.8 mg·mL-1。由式(1)得红薯叶中总黄酮的提取率为7.25%。
2.2 红薯叶总黄酮对DPPH自由基的清除
如图1所示,随着浓度的不断上升,红薯叶总黄酮化合物对DPPH自由基的清除率不断升高;当溶液浓度升至4.5 mg·mL-1时,红薯叶总黄酮类化合物对DPPH自由基的清除率逐步达到峰值,为62.66%。由此可见,面膜中红薯叶总黄酮的浓度保持在4.5 mg·mL-1时抑菌活性最佳。红薯叶黄酮类化合物为优良的供氢体,与自由基作用后形成新的自由基可通过共振杂化与其它自由基结合成稳定的二聚体,切断链式反应,发挥抗氧化作用[10]。
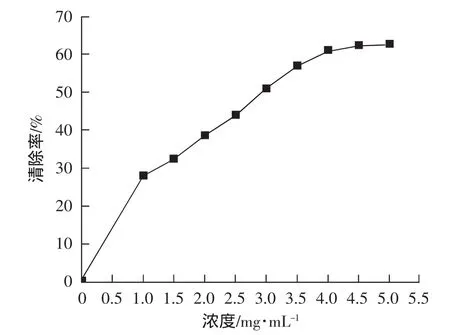
图1 红薯叶总黄酮对DPPH自由基的清除
2.3 单因素优化
2.3.1 甘油对面膜保湿性的影响
结果见图2,随着甘油量的增加,面膜保湿性明显增加,当甘油量增加至7.5 g时,面膜保湿性达到最大值62.16%,继续增加甘油量,面膜液性状过于黏稠,不符合国家规定的面膜标准QB/T 2872-2017中关于外观的要求,可能是甘油自身性质导致面膜液过于黏稠。根据面膜保湿率的高低,甘油加入量选用2.5、5.0、7.5 g3个水平进行正交试验。
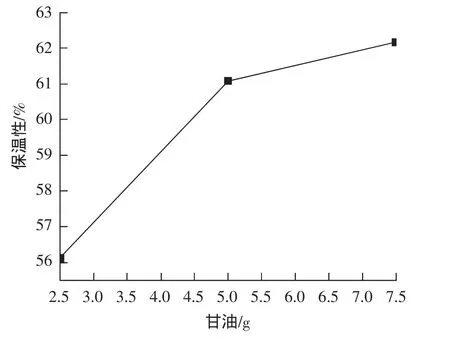
图2 甘油对面膜保湿性的影响
2.3.2 丙二醇对面膜保湿性的影响
结果见图3,当丙二醇量为1.0 g时,面膜保湿性达到最大值63.12%,继续增加丙二醇,保湿率出现下降趋势。根据面膜保湿率的高低,甘油加入量选用0.5 g、1.0 g、1.5 g 3个水平进行正交试验。
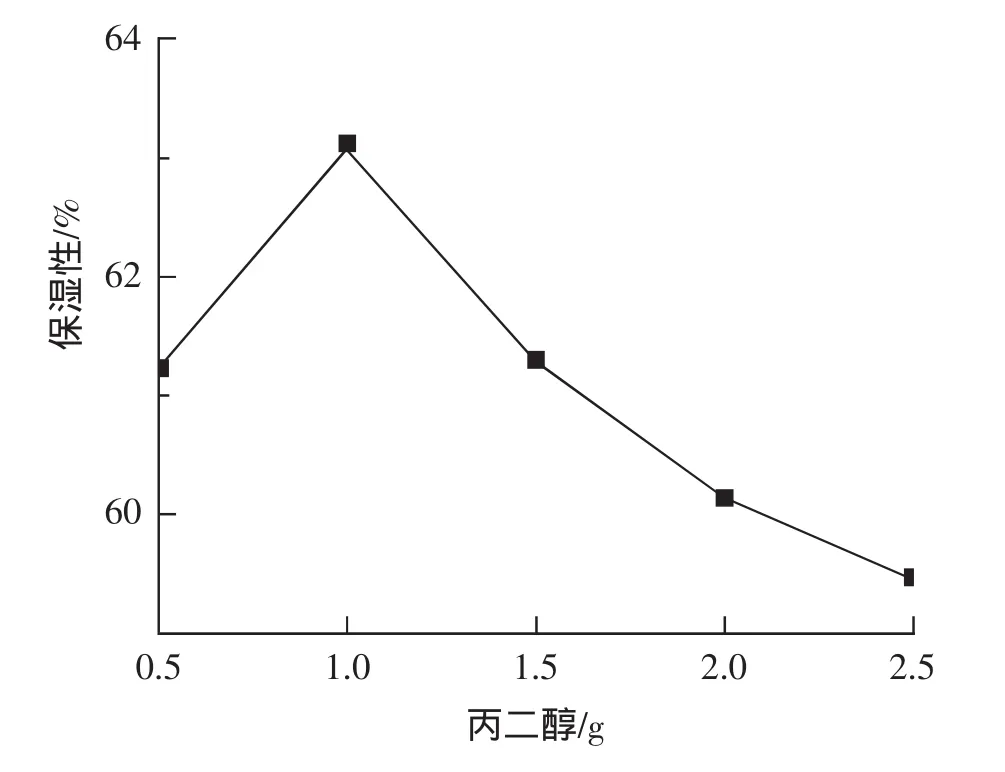
图3 丙二醇对面膜保湿性的影响
2.3.3 羧甲基纤维素钠对面膜保湿性的影响
结果见图4,随着羧甲基纤维素钠量的增加,面膜保湿性增加,当羧甲基纤维素钠增加至0.75 g时,面膜保湿性达到最大值60.13%,继续增加羧甲基纤维素钠,面膜液性状呈现黏稠状,同时,保湿性降低。根据面膜保湿率的高低,羧甲基纤维素钠加入量选用0.5、0.75、1.0 g 3个水平进行正交试验。
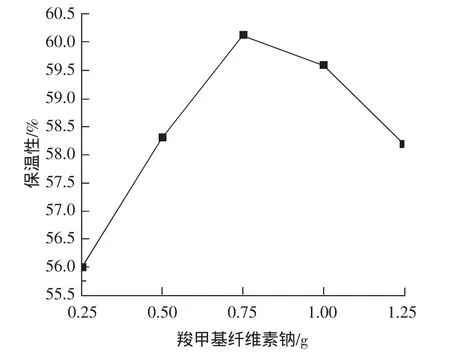
图4 羧甲基纤维素钠对面膜保湿性的影响
2.3.4 尼泊金甲酯对面膜保湿性的影响
结果见图5,当尼泊金甲酯增加至0.025 g时,面膜保湿性达到最大值60.12%,继续增加尼泊金甲酯量,面膜液保湿性降低。根据面膜保湿率的高低,尼泊金甲酯加入量选用0.020、0.025、0.030 g 3个水平进行正交试验。
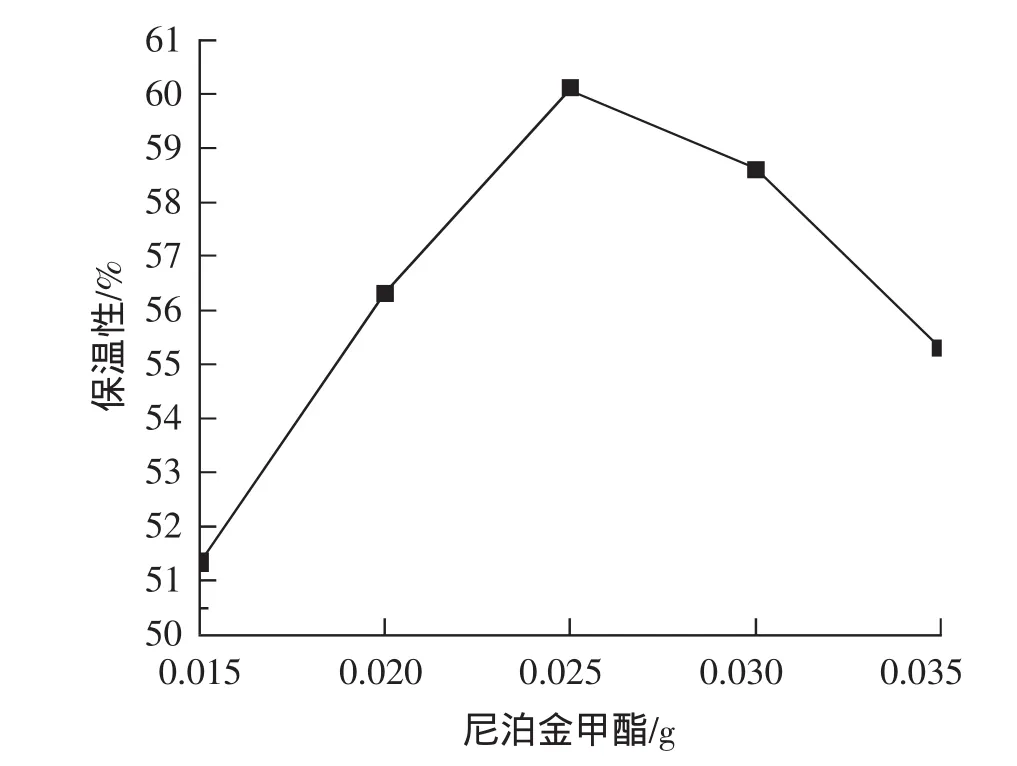
图5 尼泊金甲酯对面膜保湿性的影响
2.4 红薯叶面膜制备工艺优化
根据单因素试验结果,试验所得红薯叶面膜的正交试验结果见表2。极差分析(见表3)发现,甘油是影响面膜保湿效果的主要因素,其次为丙二醇,羧甲基纤维素钠对面膜保湿性影响最低。红薯叶面膜制备的最佳工艺水平组合为A3B3C3D1,即配方中需加入甘油7.5 g、丙二醇1.5 g、羧甲基纤维素钠1.0 g、尼泊金甲酯0.02 g。为了保证面膜的抑菌活性,面膜中红薯叶总黄酮含量应保持在4.5 mg·mL-1。经调试,红薯叶面膜的最佳配方为5.8 mg·mL-1红薯叶总黄酮提取物水溶液(35 mL)、甘油(7.5 g)、丙二醇(1.5 g)、羧甲基纤维素钠(0.75 g)、尼泊金甲酯(0.02 g)、汉生胶(0.05 g),加适量蒸馏水至面膜液重50 g。经验证,面膜的保湿率为68.65%,对DPPH自由基的清除率达到63.41%。
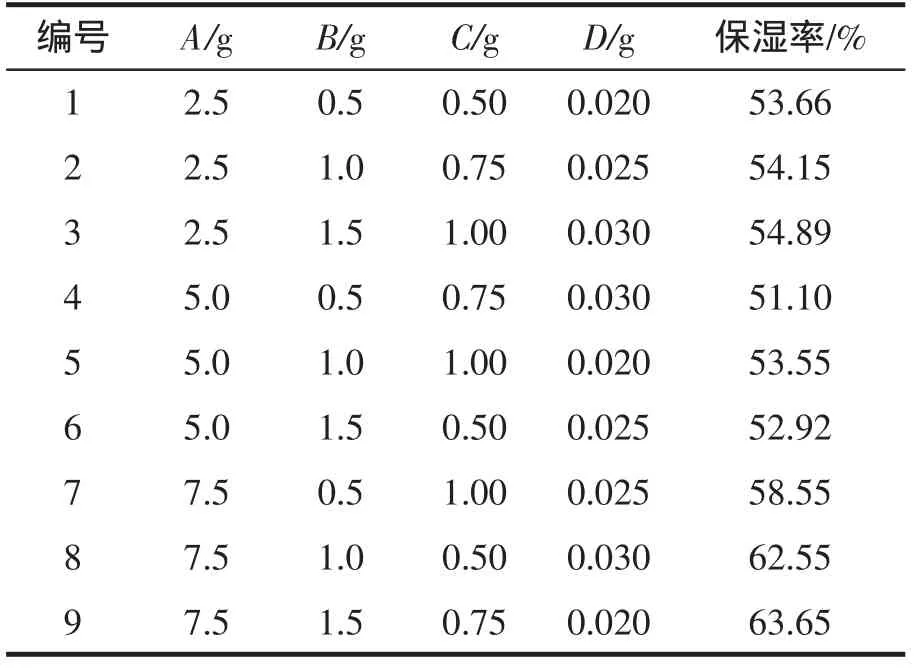
表2 红薯叶面膜制备工艺L9(34)正交试验结果
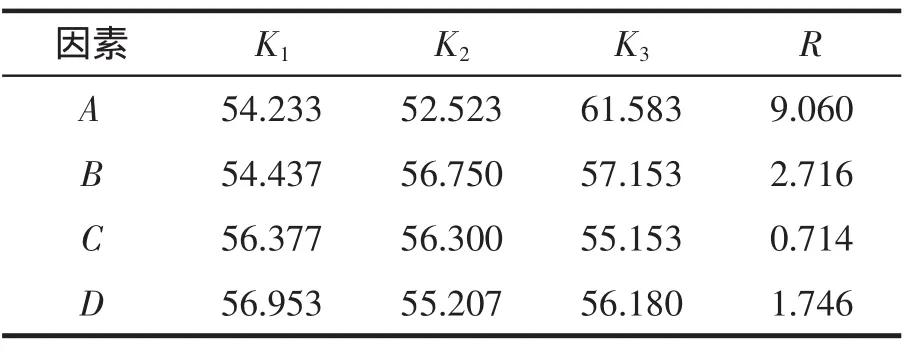
表3 红薯叶面膜制备工艺极差分析
2.5 红薯叶面膜的抑菌效果
如表4所示,面膜展现出较好的抗菌活性,红薯叶面膜对大肠杆菌和金黄色葡萄球菌的MIC值均是2.25 mg·mL-1(以面膜中红薯叶总黄酮含量为标准)。

表4 红薯叶面膜对供试菌种总黄酮含量
2.6 红薯叶面膜的性能评价
红薯叶面膜为淡绿色、具玫瑰花香气、分散均一、无污迹油状液体,涂抹手背后皮肤细腻、透亮、光滑、无颗粒感。测定得到红薯叶面膜的各项指标见表5,面膜的pH值7.09±0.05<8.5,符合国家规定的面膜标准QB/T 2872-2017中关于面膜pH值3.5~8.5的规定;面膜耐热耐寒性质稳定,在高温(40±1)℃及低温(-8±2)℃状态下保持24 h,恢复至室温后与试验前无明显差异;离心试验未发生分层,以均相形式存在。

表5 感官及理化指标测试
2.7 皮肤刺激性测试
随机选取的30名皮肤健康的志愿者,在其左手小臂处经涂抹两周面膜,皮肤光滑、细腻、水嫩、有光泽,未见发红、发痒、起疹等不良反应。
3 结论与讨论
本文优化出功能性红薯叶面膜的最优配方为5.8 mg·mL-1红薯叶总黄酮提取物水溶液(35 mL)、甘油(7.5 g)、丙二醇(1.5 g)、羧甲基纤维素钠(0.75 g)、尼泊金甲酯(0.02 g)、汉生胶(0.05 g),加适量蒸馏水至面膜液重50 g。其中,面膜中红薯叶总黄酮浓度为4.5 mg·mL-1。所制备的面膜液为淡绿色溶液,具玫瑰花香气、质地均匀、无刺激性,pH=7.09±0.05<8.5,耐热、耐寒、性质稳定,符合国家规定的面膜标准QB/T 2872-2017的要求。经测试,所得面膜的保湿率为68.65%,对DPPH自由基的清除率达到63.41%,对大肠杆菌、金黄色葡萄球菌具有明显的抑菌效果,MIC值均为2.25 mg·mL-1。
本研究成功开发出了一款绿色多功能红薯叶面膜,为红薯叶的资源利用和深加工提供了思路和方法。结果表明红薯叶面膜具有抗氧化活性和抑菌活性,与延永等[13]研究的红薯叶总黄酮提取物的性质一致,对比发现,把红薯叶制备成面膜后,抑菌活性显著增强,可能是面膜中其他成分同时具备有一定的抑菌活性。另外,该面膜制备方法具有一定的普遍适用性,具有一定的实际推广价值。

