严谨实验结果现真知
——中国学者成功解开基因编辑脱靶疑团
何东明
上海科技大学 生命科学学院,上海 201210
“你的数据(data)能支持你的结论吗?”这是自然科学研究里最核心的、也是很多科研工作者时常会听到的问题。碱基编辑器(base editor,BE)这一重要的基因编辑技术,就遇上了这样的难题——脱靶是否严重?脱靶可能带来致癌等严重的副作用,因此在真正走上临床应用之前,本着对人类与科学负责任的应有态度,一直有研究者提问,这些技术真的安全吗,现在数据支持它不会脱靶吗?遗憾的是,此前的数据无法给出答案。
2019年3月1日,中国两个科研团队在国际顶尖学术杂志《Science》同时发表论文,报告了在基因编辑研究中取得重大突破,一致阐明了碱基编辑器脱靶的奥秘。一篇论文是中国科学院神经科学研究所杨辉教授团队的《胞嘧啶碱基编辑器对小鼠胚胎进行编辑会出现大量单核苷酸突变的脱靶效应》(Cytosine base editor generates substantial off-target single nucleotide variants in mouse embryos)[1];另一篇是中国科学院遗传与发育研究所高彩霞教授团队的《胞嘧啶碱基编辑器,而不是腺嘌呤编辑器对水稻进行编辑会产生全基因组范围的脱靶效应》(Cytosine, but not adenine, base editors induce genomewide off-target mutations in rice)[2]。这两项分别在动植物系统开展的研究得出一致的结论:胞嘧啶碱基编辑器(cytosine base editor,CBE,包括BE3、高保真版BE3,即HF-BE3),包括先前认为高精确度的BE3,都会导致严重的全基因组范围内的单核苷酸突变(single nucleotide variants,SNVs);同时,设计良好的经典CRISPR/Cas9技术不存在显著脱靶效应。由此结束了关于基因编辑脱靶是否严重的持久争议。这些成果对构建严格精准的脱靶检测系统,从而研发更精准安全的基因编辑技术有重要意义,将显著推动基础研究到精准疾病治疗或种质改良等方面的技术转化应用。
1 基因编辑脱靶疑团
碱基编辑器是CRISPR/Cas9基因编辑技术的一种重要衍生技术,由于能实现精确度很高的单碱基定点突变,已显著改变基础研究与临床研究,被视为突破许多疾病治疗等难题的希望。该技术现主要包括胞嘧啶编辑器、腺嘌呤编辑器(adenine base editor,ABE),其中CBE还发展出了BE3。此前研究发现BE3脱靶效应不显著,但由于无法得出严谨有效的科学实验结论,该问题一直处于争议之中。
实际上,自CRISPR-Cas9技术出现以来,科学家对其脱靶风险高低的争议就从没有停息过。考虑到人类有许多疾病是单碱基突变,后续就开发了可实现单个位点突变的CRISPR/Cas9技术。但存在的一个问题是,该编辑技术会使DNA双链断裂(DNA double strand breaks,DSBs),通过包括了非同源末端连接修复(non-homologous end joining,NHEJ)的机制来引入定点突变。然而,NHEJ是一种高效但精确度很低的修复方式,因此存在着很大的隐患。许多研究发现,该技术可能会存在显著的脱靶效应、大量的插入/缺失突变(insertions/deletions,indels)或点突变,其中不乏具有致癌风险的突变[3]。
碱基编辑器这一重要CRISPR衍生技术,可实现不依赖于DSB的单碱基定点突变。2016年10月,《Nature Biotech》发表了第一个碱基编辑器胞嘧啶编辑器研发的重大成果[4]。领导该开创性研究的科学家是华人学者、哈佛大学教授刘如谦。他们将大鼠的胞嘧啶脱氨酶(rAPOBEC1)与全失活的Cas9(dead Cas9,dCas9)融合,发现其可以将特定位点C转变为 U,通过后续DNA 复制或以高精确性的同源重组修复(homology-directed repair,HDR)机制来介导C : G碱基对到 T : A 的转变(图1)。其中通过添加UGI研发成的第三代CBE系统——BE3,能实现15 %~75 %的编辑效率,在相同精确度下,比CBE之前的技术提高了一个数量级(CBE之前为0.1 %~5 %)。值得一提的是,其研究发现BE3脱靶效应很低,与未处理的对照组一样,仅约0.02 %(表1)。此后许多其他学者的研究也得出类似的结果。
2017年10月,刘如谦教授在《Nature》上发表了另一项重大突破:通过改造大肠杆菌的tRNA腺苷脱氨酶(TadA),研发出第 7 代腺嘌呤碱基编辑器,能高效实现A : T碱基对到 G : C 的转变[5]。ABE具有高达50 %的编辑效率,脱靶率也更低。至此,C 到 T 以及 G 到A 碱基之间的自由编辑技术已经出现,在人类各种细胞系和疾病基因修复方面也显示出很好的编辑效果,这显著加快了该技术往临床的应用转化。
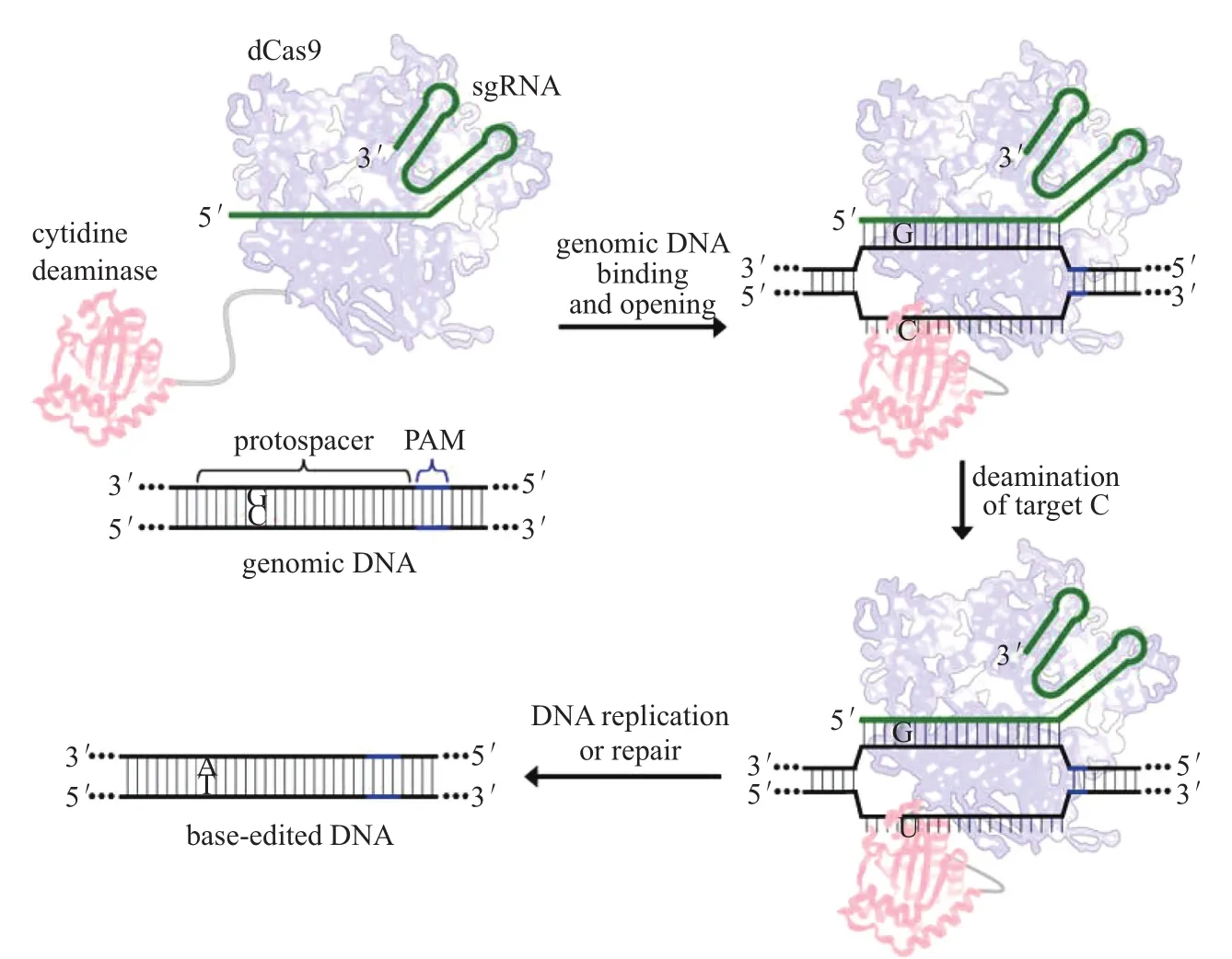
图1 胞嘧啶编辑器BE1的设计原理[4]。向导RNA通过靶位点胞嘧啶(红色)所处的基因座上的特异识别位点,来介导dCas9(蓝色)与靶基因结合,使局部DNA链发生分离。通过编辑器上连接着的APOBEC1酶(红色)使单链上的目标胞嘧啶脱氨基转化为尿嘧啶。其后经过DNA复制或DNA修复过程,所生成的G:U异源双链体就可永久转化为碱基对A:T
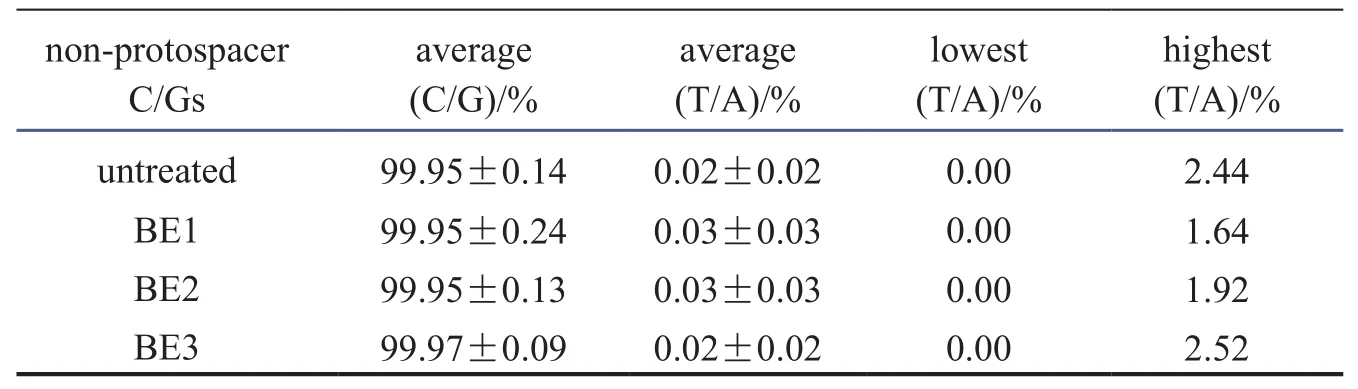
表1 BE3对人类细胞进行编辑的实验,发现其脱靶产生的C/G突变效应与未处理对照组一样[4]
在利益的驱动下,一系列的基因编辑技术临床试验竞相涌现并获审批通过,但学术界内并没有给出最终的定论,因为这些检测方法都显得不够严谨。现有脱靶检测手段,主要有软件预测、高通量测序检测DSB产生。这些方法都存在较大局限性,不能高灵敏度地检测脱靶突变,尤其是单核苷酸突变。再就是,这些研究采用的所谓单细胞测序,实际上并不是实验组的一个细胞与对照组的一个细胞的基因组的直接测序比对,而是单个细胞基因组经过大量扩增后得出来的平均效应。在扩增过程中会产生大量的背景信号,这是目前技术上的硬伤。
2017年5月,《Nature》发表的一项关于CRISPR脱靶的研究报告引起了轰动。Bassuk等数位科学家基于同一品系的小鼠遗传背景一致的假设,研究了基因编辑技术的脱靶问题。他们通过CRISPR/Cas9技术编辑小鼠的受精卵,待其发育成小鼠出生后,将它们与同一品系的其他小鼠的基因组测序结果作对比,结果居然发现了1 000多处此前未预料到的突变。研究发表后,很快就遭到科学家的各种质疑。除了实验样本相当不足,另一个很重要的原因就是作者也许忽略了,即使在实验室严格培育的同一品系,个体之间也有很大的遗传差异。个体间的遗传差异,可能远远高于脱靶效应信号本身,又如何区分差异是不是属于脱靶效应呢?所以这些对照并非合格的对照。随后,该论文在媒体喧闹与学界质疑声中被撤稿了。因此,脱靶疑团不解开,该技术发展就很难推进。
2 中国科学家巧妙试验终攻破难题
在大量背景信号的显著干扰下,脱靶效应犹如茫茫大海里一根特别的细针,该如何找出呢?也许,只有等整个大海都干了,就是背景噪音都完全消除了,这根针才能显露出来。杨辉团队巧妙研发的GOTI (genome-wide offtarget analysis by two-cell embryo injection,GOTI)检测体系,完美地解决了上述的实验对照设计与技术上的问题。
杨辉是基因编辑领域的专家,曾发表通过CRISPR/Cas9技术一步法构建多基因突变小鼠的重要成果[6],也是转基因动物胚胎构建实验专家,在博士阶段就发表了人造精子的重大突破成果。此次他带领团队巧妙地借助了胚胎发育的规律。一个小鼠受精卵发育过程中经过多次增殖分裂,在发育至二细胞卵裂球时,这两个细胞理论上遗传背景是完全一样的。如图2所示,对其中一个卵裂球进行基因编辑并使之带上红色荧光蛋白标记,另一个就成了最佳对照。等胚胎继续发育至14.5天,将整个胚胎消化,通过流式细胞仪分选出编辑与未编辑的两组细胞。再通过全基因组深度测序直接比较两组细胞基因组的差异,基本上就可以认为是基因编辑造成的。
高彩霞在基因编辑系统构建方面有着丰富的经验,曾研发出高效植物碱基编辑器系统(CBE系统BE3,rAPOBEC1-nCas9-D10AUGI)[7],在学术界产生重大影响。此次在水稻开展的研究中,利用其研发的植物BE3编辑系统,通过设计严格的对照组,有效消除了背景噪音信号,结合高精度的全基因组深度测序,也得到了足够高的信噪比数据,实现了精密的脱靶检测,发现以前未曾发现的大量突变。
在确保靶位点编辑效率的情况下,通过全基因组深度测序分析,两篇论文都得出一致结论,将脱靶原因的矛头指向胞嘧啶编辑器。研究者同时发现:插入/缺失突变率都很低且各组之间差异不大,但SNVs在不同系统间差异显著。如图3所示,ABE系统没有显著SNVs,但CBE,包括早前认为高精确性的BE3系统,都会产生全基因组范围的大量SNVs。在小鼠中进行的研究发现,ABE组每个胚胎平均约出现10个SNVs,这属于发育所产生的随机突变范围[8],而BE3系统产生的SNVs数量则是ABE组的20倍以上。并且,在小鼠中进行的研究发现,脱靶造成的许多SNVs出现在原癌基因与抑癌基因上。
杨辉团队还对经典 CRISPR/Cas9与碱基编辑器进行了比较,发现CRISPR/Cas9组单个胚胎平均只出现12个SNVs。这表明设计良好的CRISPR/Cas9并没有明显的脱靶效应,由此可结束长久以来关于CRISPR/Cas9真实脱靶率的争议。
在GOTI的研发道路上,杨辉团队面前有很多的险阻。在研究进展很缓慢的情况下,经过与所长蒲慕明院士商议,团队决定继续攻坚。确实,由于有着体细胞克隆猴的辉煌成就,并攻克了国外一流科学家都认为极难实现的剩下部分,中国这群科学家有了足够的底气和信心,而且,只有解开这个疑团,才能为该技术的前进指明正确方向。

图2 脱靶检测实验方案设计:(a)小鼠GOTI技术[1];(b)在水稻中的研究[2]

图3 研究发现CBE系统会出现严重SNVs脱靶效应:(a)(b)在水稻中进行的研究[2];(c)(d)在小鼠中进行的研究[1]
值得一提的是,杨辉的博士生导师是取得人造精子重大突破的科学家、中国科学院生物化学与细胞生物学研究所李劲松,以及体细胞克隆科学家孙强。这两位都是中国农业大学陈大元的博士生,而陈大元正是我国著名实验胚胎学家与中国克隆学之父童第周先生的弟子,真可谓是一门派独步天下。当年童老留学欧洲,徒手剥离蛙卵细胞膜,震惊整个欧洲学术界,学成归国后培育出双尾金鱼——童鱼,证明了细胞质中mRNA同样具有遗传功能。现在,杨辉教授他们这几个后辈传承了童老等老一辈的优良传统,苦战攻坚,战胜一个个难题,做到了外国科学家认为不可能的事,取得举世瞩目的重大成就。杨辉教授表示,利用GOTI成果,有望由此开发出精度更高、安全性更大的新一代基因编辑工具,建立行业的新标准。
3 尺度衡量严格精准指明发展方向
蒲慕明表示:“这能让我们重新审视基因编辑技术的安全性,但不是说这项技术不能再开展基因治疗了。正是因为已经建立新的检测技术,我们才知道如何去修正、改善BE3,从而开发安全性更高的新一代基因编辑工具,造福患者。”[9]
研究者巧妙构建的精密脱靶检测技术,正如一把尺子,可严格精准地衡量出编辑技术的质量。看到结果,更重要的是要寻找出导致这些结果的原因,才能为后续研究发展指明方向。
小鼠脱靶检测发现,BE3组出现大部分SNV是G到A突变与C到T突变,水稻研究也发现绝大部分是C到T突变,反映出SNV是由BE3编辑系统组分脱氨酶rAPOBEC1(大鼠胞嘧啶脱氨酶)所引起。与之前研究发现rAPOBEC1发挥功能需要单链DNA结合活性一致[10]。此次发现脱靶位点也主要出现在基因编码区,尤其是高表达的基因(图4)。
图4 小鼠研究中,对BE3导致的SNVs脱靶的归类分析。(a)SNVs主要发生在基因编码区;(b)在4细胞胚胎时,含SNVs的基因有更高的表达;(c)不同胚胎鉴定出来的SNV没有重叠性;(d)GOTI检测发现的SNVs与CRISPROR/Cas-OFFinder预测出来的SNVs的重叠性分析[1]
此次小鼠编辑实验发现,随着BE3表达的下降,靶位点的编辑效率也随之显著降低。同时有研究发现,BE3编辑器特有的另一组分尿嘧啶糖基化酶抑制剂(uracil glycosylase inhibitor,UGI)也会显著增加C到T的突变率[11]。因此,有望通过对BE3的脱氨酶与UGI组分的优化,来解决碱基编辑的脱靶问题。的确,ABE编辑器所采用的是工程化的脱氨酶,缺乏单链DNA结合活性,而且没加入UGI,因此不会造成显著SNVs的脱靶。
GOTI技术实现了非常严格的对照组设计来确定基因突变的位点,因此跳出了传统脱靶位点预测方法的限制。反过来,两项研究都表明,现有脱靶检测技术都有显著的局限。
水稻与小鼠的实验结果分析都发现,脱靶位点都不能通过现有软件来进行预测。研究发现,脱靶出现的突变位点的连接序列与靶序列并无相似性,脱靶序列与靶序列之间也没有相似性,这些都与经典预测方法不一致。小鼠研究表明,即使是BE3组内的不同个体,脱靶位点也没有序列相似性。这些研究成果都明确提示出,对基因编辑技术的安全性评估值得重新审视,采用现有软件(如Cas-OFFinder、CRIPOR)来进行脱靶位点的预测方法也需要修正。
4 破解疑云促人反思
中国学者的这些成果破解了久悬不决的疑云。在此之前,基因编辑临床试验却风风火火地铺展开来,接连的试验被批准。据2018年7月发表在《Nature Biotechnology》上的一篇论文显示,在NIH上首批6项CRISPR技术编辑的细胞治疗的临床试验都是中国学者登记的[12],其中四川大学卢铀领导的项目成为全球首个启动的该类临床试验。但其安全性究竟如何?
世界首例基因编辑双胞胎在中国出生,使基因编辑一度成为公众街头巷尾热议的话题,所引起的风波至今仍未平息。中国众多学者对其严厉谴责,一是因为其严重触犯人类伦理道德底线,再就是其所使用的CRISPR基因编辑技术的安全性与精确性仍然没有被严格验证,很可能由于脱靶而导致许多意想不到的后果。科学必须严谨,在没有真正确定技术的风险之前就贸然进行人体试验,对人类、对科学都是极不负责的。例如,当年某些科学家贸然进行的基因治疗试验,致使患者无辜死亡,研究者锒铛入狱,已成为科研史上难以抹去的污点。
为了避免类似悲剧重演,人类在进行这些活动时必须要慎之又慎。值得注意的是,对于人类种系细胞基因编辑,技术上通过结合体外受精(IVF)、胚胎植入前遗传诊断(preimplantation genetic diagnosis)等方法可筛选出健康胚胎。但是,种系细胞基因编辑的严重危害,特别是基因编辑所带来的很多无法预料的后果,干扰人类基因组的一致性和同质性,强烈亵渎生命的神圣性,这一切对人类可能就是灭顶之灾。从人类长远的核心利益来看,应该坚决禁止人类种系细胞基因编辑。必须牢记,人类的长远利益远远高于个别学者提出的所谓商业市场价值。为此,我国开展高风险生物医学新技术临床研究应用管理条例公开征求意见,正是出于对全人类长远核心利益的重大关切而做出的明智之举。

