陈列平:开启“免疫正常化”肿瘤免疫治疗新纪元
孙静玮,王俊
耶鲁大学 医学院免疫学系,美国 纽黑文市,CT 06520
2018年诺贝尔生理学或医学奖授予肿瘤免疫治疗领域,主要由于PD-1、PD-L1以及CTLA-4抗体在肿瘤治疗,尤其是在晚期肿瘤中的突出效果,是人类抗癌历史上的巨大突破,开启了肿瘤治疗的新篇章。两位获奖者James Allison和Tasuku Honjo,分别由于将CTLA-4抗体首次应用于癌症治疗和对PD-1通路的研究而摘得桂冠[1]。
一个领域成功的背后必定有诸多科学家的共同努力和推动,而华人科学家陈列平教授正是肿瘤免疫治疗领域不可不提的一位奠基者和领军人物。他首次将共信号分子引入肿瘤免疫领域(CTLA-4和PD-1同属调节T细胞反应的共信号分子),发现B7-H1(即PD-L1,PD-1配体)并阐明这一通路在癌症免疫中的关键作用,且身体力行推动其在癌症临床中的应用[2]。本文着重回顾癌症免疫治疗领域的发展进程以及陈列平教授在该领域的重要贡献。
1 肿瘤免疫治疗的起源
癌症免疫治疗的成功基于我们对于癌症生物学和免疫学不断深入的理解和认识。癌症起源于基因突变的自体细胞,具有很强的遗传不稳定性和异质性。因此,直接杀伤肿瘤的传统治疗方法,如放疗、化疗及分子靶向治疗,绝大多数情况下不能完全控制肿瘤生长,尤其是晚期肿瘤,且容易导致耐药性和更加难以治疗的肿瘤复发,以及严重的副作用。然而,人体自身的免疫系统,尤其是杀伤性T细胞,可以特异性地识别肿瘤抗原和杀伤肿瘤细胞,且可以与肿瘤细胞共同进化,持续性地控制肿瘤生长。但是,在肿瘤病人体内,免疫系统并不能完全控制肿瘤生长,主要是因为有很多肿瘤免疫逃逸机制存在,从而抑制了免疫系统杀伤肿瘤的功能。因此,找到肿瘤中关键的免疫逃逸机制,重新激活免疫系统,是癌症免疫治疗成功的关键。
肿瘤免疫治疗的起源可追溯到120多年前William Coley等医生将活菌等感染性物质引入肿瘤的大胆尝试。直到20世纪中后期,随着决定T细胞活化的抗原特异性以及提供活化初始信号(又叫“第一信号”)的TCR/MHC基因的发现,免疫反应在控制肿瘤生长中的重要作用才逐渐被揭示。肿瘤免疫领域基础研究的热情也长盛不衰,包括肿瘤特异性抗原的发现、杀伤性T细胞对于肿瘤的杀伤作用,以及肿瘤浸润淋巴细胞在肿瘤免疫中的作用等。这些研究都表明了免疫系统在肿瘤生长中的重要作用,然而各种向临床治疗转化的尝试基本上以失败告终。
2 T细胞反应的双信号模型
癌症免疫疗法的成功建立在对于免疫系统基本研究和认识不断进步的基础上。大家逐渐认识到,仅由T细胞受体(TCR)和MHC-抗原复合物相互作用而产生的信号并不足以激活T细胞反应。“双信号模型”于20世纪70年代被提出[3],也即该领域获诺贝尔奖的理论基础:T细胞的激活需要两个信号——TCR信号和共刺激(co-stimulation)信号。TCR识别抗原呈递细胞表面的MHC-抗原复合物产生第一信号,启动T细胞活化反应,同时确保T细胞反应的抗原特异性;但是,只有同时有共刺激信号,也就是“第二信号”的参与,才能够让T细胞完全激活(图1)。
CD28是首个被发现的共刺激分子,结合抗原呈递细胞表面的B7分子而促进T细胞活化,后来被证明是T细胞激活过程中最关键的共刺激分子[4]。之后,一系列的共刺激分子被陆续发现。同时,共抑制分子,比如CTLA-4和PD-1/B7-H1(PD-L1)的发现,也让我们逐渐认识到T细胞反应中负调控信号的重要性,以及免疫调节的复杂性[5]。
笔者需要补充说明的是,共刺激分子在很长一段时间内是“共刺激” 和“共抑制”分子的统称。现在普遍认为,共刺激分子正向调节T细胞功能,为T细胞激活提供关键第二信号,例如CD28;共抑制分子则负向调节T细胞功能,例如CTLA-4和PD-1。这一概念上的细化来自陈列平2004年发表于《Nature Reviews Immunology》的文章,首次提出用“共抑制(co-inhibition)”来命名具有免疫抑制功能的分子,并将其与共刺激分子合称为“共信号(co-signaling)分子”[5]。而后Allison在2006年提出的 “免疫检查点(immune checkpoint)”的概念[6],实质上就是共抑制分子的另一种表达。此外,细胞因子,比如白细胞介素-2 (IL-2)、干扰素(IFN)和转化生长因子-β(TGF-β)等,也在T细胞反应和分化中发挥重要作用,被认为是T细胞反应的“第三信号”。
3 陈列平与B7-H1通路的发现、研究和应用
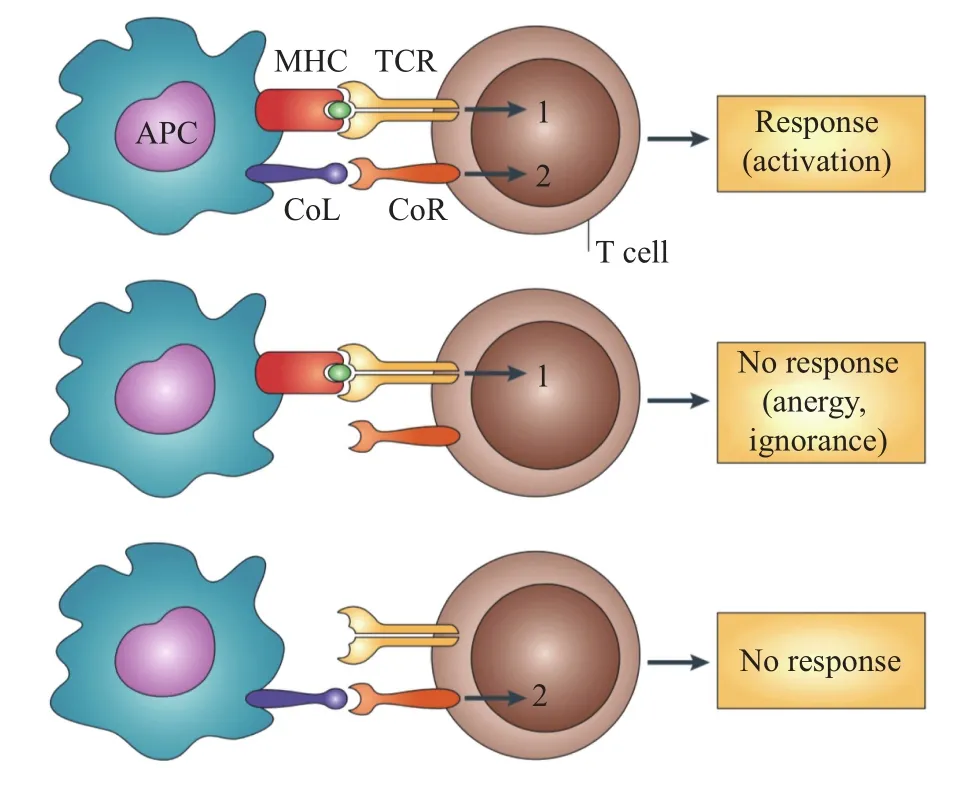
图1 T细胞反应的双信号模型[5]。CoL:共刺激配体;CoR:共刺激受体
基于上述免疫系统调控的理论基础的发展和进步,陈列平相信,在肿瘤微环境里存在一些特别的分子通路介导了肿瘤免疫逃逸,而这些机制可以被用于肿瘤治疗。他在北京协和医科大学肿瘤研究所拿到医学研究生学位后,深刻认识到只有通过基础研究才能找到治愈癌症的方法。于是,他于1986年来到美国,分别于Dexel和Washington大学在免疫学领域进行了博士学习和博士后深造,之后加入百时美施贵宝公司(BMS)继续从事基础研究。
1992年,陈列平在BMS以第一作者兼通信作者的身份在《Cell》杂志上发表文章,第一次揭示了共刺激分子在肿瘤免疫中的作用[7](图2)。这项工作开启了癌症免疫治疗领域之先河,因为肿瘤免疫治疗可以分很多种,比如常见的细胞因子治疗(IL-2和IFN)、细胞治疗等等,但利用共刺激分子提高T细胞免疫活性来治疗癌症的理念在这篇文章中被首次提出和验证(注:当时还没有共抑制或者免疫检查点的概念)。这项研究第一次证明了CTLA-4和CD28的配体B7 分子具有促进肿瘤免疫、抑制肿瘤生长的功能(图3),为后来B7-CD28 家族,包括CTLA-4和PD-1/B7-H1,作为靶点应用于肿瘤治疗奠定了理论基础。
然而,B 7配体和C D 2 8/CTLA-4受体在维持免疫平衡中起着至关重要的作用,同时它们的表达又缺乏肿瘤特异性,所以调控这个通路进行肿瘤治疗可能会产生较高的自身免疫毒性。这一点在后来也被CD28激动性抗体TGN1412以及CTLA-4的阻断性抗体ipilimumab的临床结果所验证。于是,陈列平想要寻找具有肿瘤特异性的免疫逃逸机制,然后进行阻断以提高肿瘤免疫反应。

图2 陈列平1992年《Cell》文章首次揭示了共刺激分子在肿瘤免疫中的作用
图3 陈列平1992年 《Cell》文章中B7阴性(左)或阳性(右)肿瘤生长[7]
在BMS的7年之中 (1990—1997年),陈列平研究了很多T细胞表面分子的免疫调控作用以及应用于肿瘤治疗的可能性,尤其是4-1BB(CD137)——一个T细胞激活后特异性上调的分子。陈列平发现4-1BB激动性抗体在动物模型中有很好的抗肿瘤作用,使得4-1BB成为一个肿瘤免疫治疗的靶点[8]。4-1BB具有一定的肿瘤特异性,因为它会表达在识别肿瘤抗原而活化的T细胞上,但其激动性抗体仍然会产生一定的肝毒性。陈列平坚信会有更具肿瘤特异性的免疫调控分子,于是他回到学术界,加入梅奥医学中心进行进一步的探索。
适逢人类基因组计划开展的契机,陈列平结合生物信息学分析从表达序列标签(EST)库中寻找与B7家族具有相似性的分子,从而发现和表征了一系列新的B7家族分子,包括B7-H1[9]、B7-H2[10]、B7-H3[11]、B7-H4[12]、B7-H5[13],PD-1H(VISTA)[14],等等。在这些新通路中,陈列平带领课题组发表了一系列重要文章,对于B7-H1的表达、生物学功能和阻断PD-1/B7-H1通路而产生的抗肿瘤作用进行了详细研究和分析。之后他于2004年加入约翰·霍普金斯大学,与临床合作者一起发起和推动了第一个PD-1/B7-H1通路阻断抗体在肿瘤病人中的临床试验,从而打开了该通路应用于肿瘤治疗的大门,显著提高了多种晚期/转移肿瘤的反应率,成为漫长人类癌症治疗史中的重大突破。接下来,让我们聚焦于PD-1/B7-H1通路的发现和研究历程,看看这一通路如何最终成功应用于癌症免疫治疗。
1992年,Honjo独立从凋亡的免疫细胞系中克隆了PD-1基因[15](PD-1的全称是programmed cell death protein 1,即细胞凋亡蛋白1)。1999年,陈列平独立克隆了B7-H1,并发现B7-H1可以促进T细胞产生抑制性细胞因子IL-10,首次揭示了B7-H1可能具有免疫负调控作用[9]。1999年,Honjo也通过基因敲除小鼠揭示了PD-1的免疫负调控作用[16]。次年,Honjo和Freeman及Wood合作发现了PD-1/B7-H1的结合[17],并将B7-H1改名为PD-L1。
首次揭示B7-H1在肿瘤免疫中作用的是陈列平在2002年发表于《Nature Medicine》的文章[18](图4)。这项工作证明:B7-H1在绝大部分人的正常组织低表达,而在多种人类肿瘤组织上有高表达;并且B7-H1可以抑制T细胞反应而促进肿瘤生长,是一种潜在的肿瘤免疫逃逸机制。1个月后,东京大学的Minato组在《PNAS》上发表了类似的文章,印证了B7-H1在肿瘤免疫中的作用[19]。

图4 陈列平 2002年《Nature Med》文章首次揭示B7-H1在肿瘤免疫中的作用
这里值得指出的是,这篇文章首次证明了B7-H1抗体可以在体内阻断B7-H1的肿瘤免疫抑制作用,比PD-1抗体更早证明有抗肿瘤作用,而且目前已成药的三个B7-H1抗体,在临床上与PD-1抗体有类似的肿瘤治疗效果。其实,B7-H1在肿瘤微环境内的特异性高表达才是决定PD抗体抗肿瘤效果好且副作用小的主要原因[20]。这也是为什么CTLA-4与PD通路相比,抗体效果弱而毒性高,且其配体不能作为治疗靶点的一个重要原因。
接下来,陈列平在2004年又通过B7-H1的基因敲除小鼠进一步证明了B7-H1的免疫抑制作用。基因敲除小鼠只会出现轻微的自身免疫倾向,预示了阻断B7-H1应用于人体的安全性[21]。这一现象也被Arlene Sharpe和Gordon Freeman的独立研究证明[22]。
2005年,陈列平首次证明用抗体阻断PD-1可以在动物模型中促进抗肿瘤免疫反应,并提出肿瘤表面的B7-H1就像“分子盾牌”(molecular shield)一般抑制杀伤性T细胞对于肿瘤的杀伤作用[23]。Honjo[24]和陈列平的文章于2005年2月几乎同时发表,事实上陈列平的文章投稿比Honjo还要早半年(图5)。
如果仔细对比这两篇文章,我们可以看到在Honjo的文章中,他们在皮下实体瘤模型中并没有观察到明显的PD-1抗体的抗肿瘤作用,采用的是静脉注射肿瘤细胞后向组织转移的模型来证明(图6(a))。这样的肿瘤转移模型在肿瘤免疫研究中并不常用,因为难以区分药物到底是针对肿瘤细胞转移还是对调节免疫反应起作用;而陈列平文章中用的是更有说服力的实体瘤模型,能够更好地反映PD通路在肿瘤微环境内的作用(图6(b))。值得一提的是,《Science Translational Medicine》在关于2018诺贝尔生理或医学奖的评论“A Nobel for immuno-oncology”[1]中展示的就是陈列平的这一数据。
此外,陈列平于2004年加入约翰·霍普金斯大学之后,大力推进首个PD-1抗体在多种晚期癌症中的临床试验[25-26]。同时,他还开发了B7-H1在人类肿瘤组织中有效的染色方法,并倡导以B7-H1作为标记分子预测临床反应[27]。
PD-1抗体临床试验的结果于2010年首次被报道[25];2012年,两个大型PD-1[26]和B7-H1[28]抗体临床试验结果在 《New England Journal of Medicine 》杂志上被报道。2013年,癌症免疫治疗被《Science》杂志评选为 “年度突破 ”(the breakthrough of the year)[29]。2014年和2016年,PD-1抗体和B7-H1抗体先后被美国药监局批准,时至今日已被批准应用于黑色素瘤、肺癌、头颈癌等十余种肿瘤[30]。其在多种肿瘤中突破性的反应率和治愈率(图7),尤其是在晚期/转移肿瘤中的疗效(图8),改写了肿瘤治疗的历史。

图5 Honjo 2005年《Int Immunol》文章和陈列平 2005年《Cancer Res》文章对比

图6 (a)B16 肿瘤的肝转移[24];(b)P815-B7-H1 肿瘤皮下生长曲线,G4: anti-PD-1抗体[23]
综合以上分析,我们可以看出,陈列平最早奠定了将共信号分子应用于癌症治疗的理论基础,首次克隆B7-H1并阐明其在癌症免疫中的作用,首次证明B7-H1抗体, 又与Honjo同时独立证明PD-1抗体的癌症治疗作用,并身体力行推进PD-1抗体的临床试验,他对于癌症免疫治疗领域的贡献不言而喻 (图9)。
4 “免疫正常化”概念的提出
近期,陈列平于《Cell》杂志发表综述文章[31],分析了PD-1/B7-H1通路之所以能够在临床取得突破性治疗效果且毒性较低的原因,并提出“免疫正常化”概念,总结了PD-1、B7-H1抗体区别于其他免疫治疗方法的几个特点 (图10):
(1)B7-H1是一个肿瘤诱导产生的免疫逃逸机制。因为B7-H1在很大程度上是被肿瘤浸润T细胞识别肿瘤抗原而激活后所释放的IFN-γ所诱导上调的,B7-H1通过结合T细胞上的PD-1而抑制T细胞的反应,从而导致肿瘤免疫逃逸的发生,因此可以被认为是一个肿瘤中的“获得性免疫抵抗”(adaptive immune resistance)机制[27]。
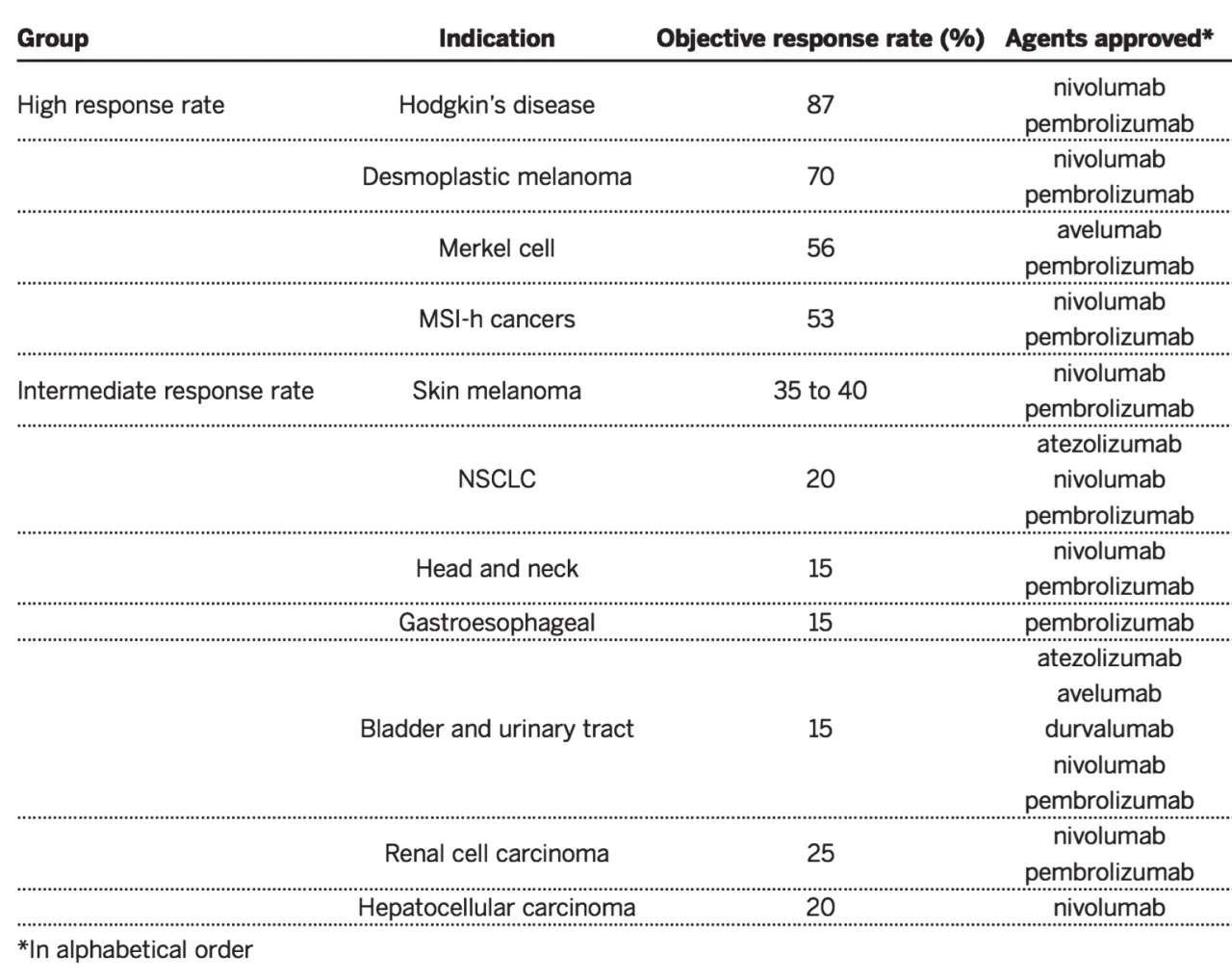
图7 PD-1和B7-H1抗体在获批的主要肿瘤类型中的反应率[30]
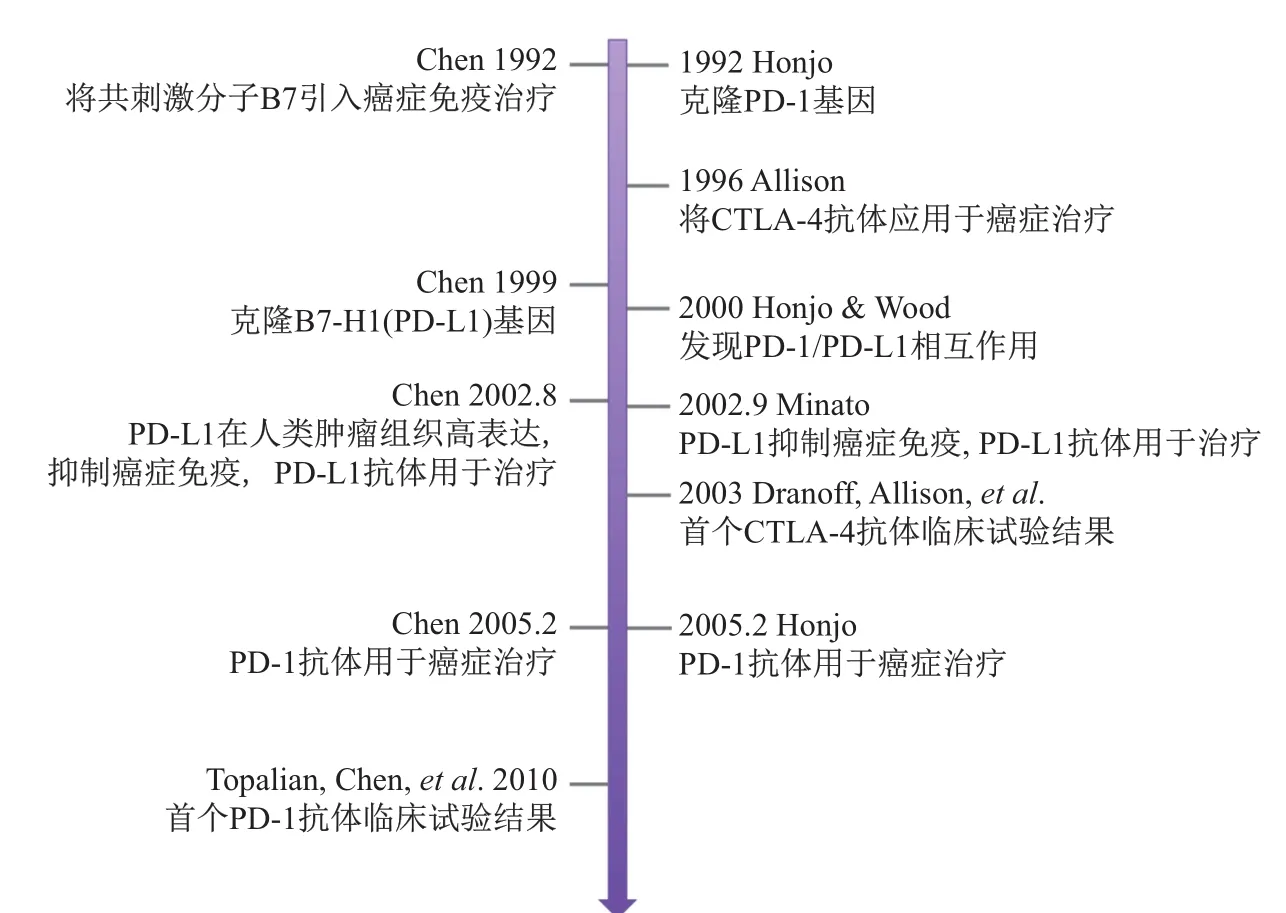
图9 两位获奖者和陈列平主要贡献时间节点
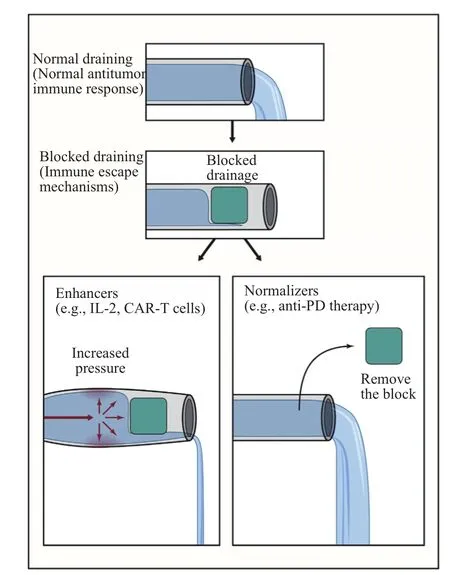
图10 PD抗体区别于其他免疫治疗方法的一个重要特点在于“免疫正常化”而非“提高化”[31]
(2)阻断PD-1/B7-H1通路可以选择性地调节肿瘤微环境中的免疫反应。这主要是由于B7-H1表达只肿瘤特异性,在大多数正常人类组织中表达很低,而主要由IFN-ɣ诱导而局部性地表达在肿瘤组织当中。这一特点也使其区别于其他的免疫治疗方法,因为它们的表达或作用位点大多缺乏肿瘤特异性,不仅无法产生理想的治疗效果,而且会导致免疫系统的整体性激活,而产生较强的免疫毒性。
(3)阻断PD-1/B7-H1通路可以恢复肿瘤微环境中的免疫反应。在一部分病人中,PD-1/B7-H1通路就像一个“总开关”(master switch)一般,决定着肿瘤微环境中免疫反应的整体走向。因而,通过抗体阻断该通路可以修复肿瘤中被抑制的免疫反应,使得肿瘤“免疫正常化”。所以,在一些病人中,只需要注射一次抗体就可以激活肿瘤微环境中的免疫反应,从而使得肿瘤缩小。
PD抗体疗法的成功和“免疫正常化”原则指引着新一代癌症免疫治疗方法的研究和开发方向。怀着对于肿瘤免疫治疗坚定的信念,陈列平教授带领课题组仍在不断探索和发现新的“免疫正常化”分子,将其作为新的靶点应用于癌症治疗中,并结合其他手段多方面调控和激活肿瘤的免疫反应,来进一步提高癌症的反应率和治愈率。值得一提的是,陈列平教授在耶鲁大学的实验室最近发现了Siglec-15,一个全新的、与PD-1/B7-H1通路机制截然不同的“免疫正常化”分子靶点[32],并开发了相应的治疗抗体用于多种晚期肿瘤的临床试验。
我们相信,肿瘤免疫领域在陈列平等科学家们孜孜不倦的努力下,今后会有更多更好的发现和突破;同时也深信,在科研界、产业界以及全社会的共同努力下,癌症在不远的将来,将不再是人类生命和健康的巨大威胁。

