隐匿性听力损失的临床特征、诱发因素和致病机制
庞功采 孙毓晗 柳柯
1牡丹江医学院附属红旗医院耳鼻咽喉头颈外科(牡丹江157011)
2首都医科大学附属北京友谊医院耳鼻咽喉头颈外科(北京100050)
3北京市临床医学研究所耳鼻咽喉头颈外科研究室(北京100050)
1 隐匿性听力损失的发现与命名
隐匿性听力损失的临床症状早在1989年英国的一项国内调查报告中即有描述,报道显示:26%的成年人(17到80岁)在相对嘈杂的环境中对于语言的辨别能力有较大困难(标准纯音听力测试0.5-4kHz,平均听阈值≦25dB HL),但该报告并未对此发现命名[1]。1948年,Kopetzky等注意到类似的临床现象并为其命名为“辨听能力损失”(Loss of Capacity for Discriminative Listening)[2]。1954年,King等同样注意到此类临床症状,在其文献中将其命名为“心因性聋”(psychogenic deafness)[3]。1992年,Saunders等将其命名为“听觉功能障碍”(obscure auditory dysfunction,OAD),即在噪声存在情况下,患者的听阈正常,且无其他明显原因报告,却表现为难以理解言语的一种临床表现;是一种由多因素(听觉、心理、语言和人格等相关因素)共同作用所致的综合征,不应当被视为单纯的神经性症状[4,5]。1992年,Hinchcliffe 提出King-Kopetzky 综合征 (King-Kopetzky syndrome,KKS)的概念,用以描述患者纯音听阈正常却在噪音环境中聆听困难的听觉异常现象[6],其中躯体焦虑和嘈杂环境下语句测试的表现是SHHI(social hearing handicap index)评分的显著预测因子,这两个变量是Kopetzky综合征言语听力障碍的主要决定因素[7]。在后续报道中研究人员多将KKS等同于OAD,相较于隐匿性听力损失,KKS或OAD概念涵盖了外周听觉损害(耳蜗为主)以外更多心理学和中枢功能方面的内容,有学者则直接将KKS和OAD等同于听觉处理障碍(Auditory Processing Disorder,APD)[8]。2009-2013年,研究人员发现特定噪声条件暴露后动物出现短暂的听阈升高,之后听阈逐渐恢复,到暴露后第14天听阈基本恢复至暴露前水平,表现为暂时性阈移(Temporary Threshold Shifts,TTS)。但是动物ABR的I波或CAP幅值均有降低且不能完全恢复,表明即使阈值恢复以后动物仍处于一种隐匿性听觉异常状态[9,10,11]。较为明确的隐匿性听力损失的人体研究出现在2011年,在这项研究中,Schaette和M cAIpine采用模型展示了无听阈变化下听觉中枢神经元对听觉信号输入减少的增益效应,以及进而引起耳鸣的病理机制,并由此提出了基于听功能异常病人的HHL(Hidden Hearing Loss)概念[12]。
目前临床上对听力的检测仍较多采用纯音测听法。纯音测听法依据在一定频率范围测得的最小值绘制听力变化曲线,由此生成的听力图对外毛细胞功能障碍较为敏感,然而这种听力图对内毛细胞(IHC)损害或缺失的敏感性要低得多,有报道甚至认为80%的IHC缺失仍未显著影响听阈[13]。Kujawa和liberman对动物的研究表明:噪声暴露及老化可导致IHCs和听神经纤维末梢之间突触的永久损害,然而这种损害并不会影响安静状态下对声音的敏感性[14],听神经的退行性改变则延后出现,这种听觉损害难以被纯音测听法检测到,而声诱发的听神经动作电位AP阈上幅值降低,以及由毛细胞产生的总和电位SP与AP之间的比值会发生改变。这种现象在临床上存在多种描述方法,例如听神经病变,耳蜗突触病以及隐匿性听力损失(HHL)等[12,15,16]。目前临床上对HHL患者行纯音听阈测定时很难发现明显的听觉变化,但近期Barbee等人研究发现,对于部分噪声暴露损伤了毛细胞但常规纯音测听难以发现异常的患者,进行超高频测听检查或可对诊断有所帮助[17]。
2 隐匿性听力损失的临床表现
隐匿性听力损失的临床表现:患者主诉聆听困难,尤其在噪音环境中对语言的辨听能力下降,但其纯音听阈基本处于正常范围之内,主观检查上并不存在听力障碍的情况[12]。近些年的研究发现,这种听力的隐匿性损害可以在耳蜗中积累,并与衰老等其它听力损害因素叠加,导致诸如老年聋症状提前出现,且程度加重。
3 隐匿性听力损失的发病机制
已有研究表明,当出现言语理解障碍时,病变部位多发生在听觉传导通路上的一个或多个部位[18]。隐性耳蜗损伤并不会导致明显的听力损失,但可能会增加耳蜗对进一步创伤性刺激的易感性[19]。隐匿性听力损失的发病机制研究是当前研究领域的一个热点课题。多数研究显示,HHL的发病机制与耳蜗带状突触损伤、耳蜗传入神经纤维损伤以及听神经纤维暂时性脱髓鞘有关。目前认为HHL发病相关的危险因素包括噪音环境、衰老以及耳毒性药物等。
3.1 耳蜗带状突触损伤
耳蜗IHC与I型神经纤维末梢间形成的传入神经突触结构主要负责听觉信号向中枢的高效传输,其在神经信号传导通路中发挥着关键作用,人们称这种突触结构为带状突触。迄今为止大量研究表明,耳蜗带状突触病变可能是导致隐匿性听力损失的重要原因。研究发现,每个I型神经纤维(Fiber)通过其单个且未分支的末梢与单个IHC形成突触连接,共同构成一个独立工作的突触结构,而每个IHC则可与多个I型纤维形成功能连接[20]。在超微结构上,IHC突触前膜活化区域上嵌有纺锤形电子致密体(Ribbon小体)。生理条件下,Ribbon小体外周附着一圈突触囊泡,对应的突触后膜(听神经末梢区域)有大量受体结构(图1)。外界声音刺激时,信号经过机-电转化使IHC产生去极化,引发突触前膜上CaV1.3L型钙离子通道开放,发生钙离子内流,激发突触囊泡向突触间隙释放兴奋性神经递质(谷氨酸),激活表达于I型ANFs末端(突触后膜)的谷氨酸受体,引起突触后膜去极化并产生神经兴奋,实现声音信号的第一级编码和传导[21,22]。当噪声暴露、衰老以及应用耳毒性药物时,突触结构受到破坏,上述编码和传导功能将会被破坏,如果这种损伤不能得到纠正,突触后听神经将会受到损害,但是这个损害过程一般十分缓慢[23]。
3.2 耳蜗传入神经纤维损伤
正常人的耳蜗大约有12000个外毛细胞(outer hair cell,OHC)以及约3500个内毛细胞(inner hair cell,IHC),超过95%的螺旋神经节是与IHC相联系的I型螺旋神经节,而少于5%的螺旋神经节是与OHC相联系的II型螺旋神经节。OHC通过主动非线性放大机制对IHC产生驱动作用[8]。IHC与I型传入听神经元形成突触连接,负责听觉信号向中枢系统的传递。I型传入听神经纤维(auditory nerve fibers,ANFs)根据阈值及自发放电速率(spontaneous discharge rate,SR)又分为两类:约60%的I型传入听神经纤维分布靠近柱细胞一侧,直径粗大,表现为高阈值、低自发放电率(SR≦17.5spikes/s,Low-SR);而另外约40%的神经纤维分布靠近蜗轴一侧,直径较纤细,表现为低阈值、高自发放电率(SR>17.5spikes/s,High-SR)[8,24]。这其中低SR神经纤维具有较大声强响应动态范围和随信号幅度快速变换的能力,决定了其对嘈杂环境中听觉感受处理能力具有重要意义;而高SR神经纤维在接近其行为阈值时的声强响应动态范围较小,其对较低声强信号刺激相对敏感[24,25]。Bharadwaj等人的研究显示,高阈值、低SR神经纤维的损伤可能会降低阈上刺激信号的编码精度[26]。另外有研究证明,无阈值改变的听神经反应性下降可能是由于高阈值、低SR神经纤维损害所导致的[24,27],因此研究人员推测,高阈值、低SR神经纤维的损伤可能是隐匿性听力损失发生的病理机制之一,这种高阈值、低SR神经纤维的损害本质上也属于耳蜗带状突触后损伤的一部分。
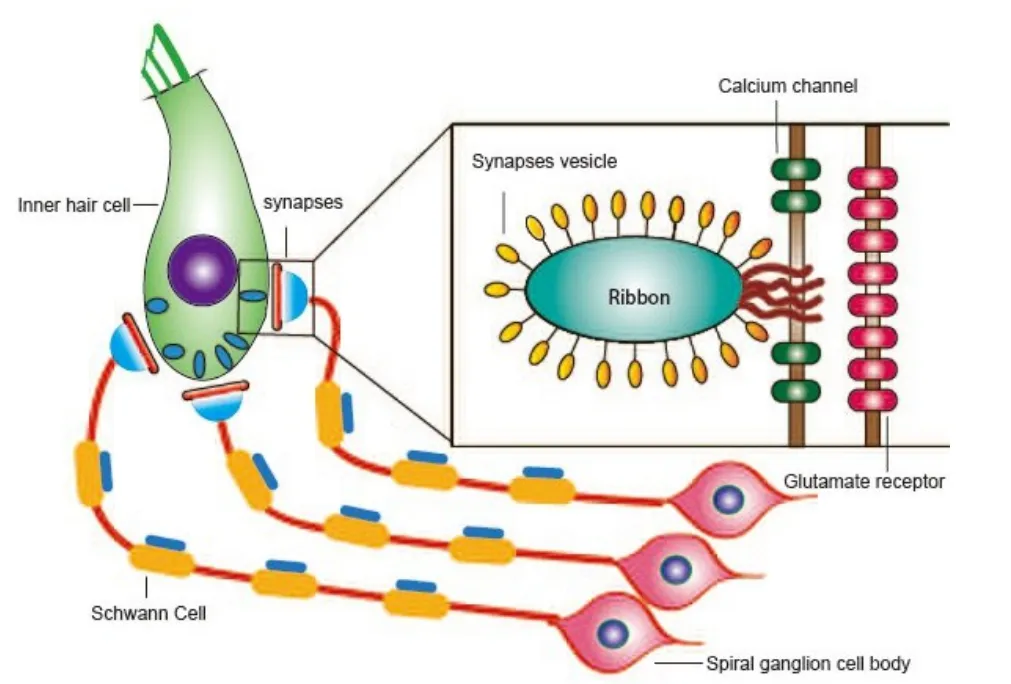
图1 耳蜗带状突触及听神经示意图。左图显示了内毛细胞、相连的听神经纤维(I型)及其神经纤维上的髓鞘。突触结构形成于内毛细胞底部,听神经由螺旋神经元发出,其表面髓鞘结构主要由施旺细胞组成。右图为带状突触结构,突触前膜可见纺锤形ribbon小体(电子致密体)外周附着一圈突触囊泡。突触前膜具有离子通道结构,突触后膜富含受体结构。Fig.1 Diagram of cochlear ribbon synapses and auditory nerves.The left image shows the inner hair cells,the adjoining auditory nerve fibers(type I),and the myelin sheath on the nerve fibers.The synaptic structure is formed at the bottom of the inner hair cell,the auditory nerve is emitted by spiral neurons,and the surface myelin sheath structure is mainly composed of schwann cells.At right is a ribbon of synaptic structure,In the presynaptic membrane,there is a ring of synaptic vesicles surrounding the spindle ribbon corpuscles(electron dense bodies).The presynaptic membrane has the structure of ion channel and the presynaptic membrane is rich in receptor structure.
3.3 听神经脱髓鞘
临床上传导性阻滞是获得性脱髓鞘神经系统疾病的主要机制,由此人们推测听神经纤维的脱髓鞘也可能是隐匿性听力损失产生的重要原因。Wan及Gabriel Corfa等发现,急性螺旋神经元损害可导致听神经快速脱髓鞘,尽管之后神经元和轴突髓鞘再生恢复,然而这种暂时性脱髓鞘可导致HHL的发生[28]。当然髓鞘损伤与HHL的关系还需要今后更多的研究来确认,目前相关的研究数量过少,确切的结论尚无法得出。
4 隐匿性听力损失的诱发因素
目前研究证据表明隐匿性听力损失的诱发因素主要包括环境或职业噪声、衰老以及耳毒性药物等。相对而言,噪声暴露导致的隐匿性听力损失及相关机制研究占据更大比例。
4.1 噪声暴露与隐匿性听力损失
Kujiawa和Liberman等在2009年发表的一项研究中发现,小鼠经过100dB SPL窄带噪声持续2小时暴露后,ABR阈值会产生一过性升高,当脱离噪声环境2周以后,这些动物ABR阈值可恢复到暴露前水平而表现出暂时性阈移(TTS)[9]。长期以来,学术界倾向认为如果听觉阈值在短暂升高后又得到完全恢复,那么这种变化一般不会对听觉系统造成永久性损害。而最新研究则显示,TTS未必不会永久性损伤听觉系统及其功能[9,10]。上世纪90年代,李兴启等对噪声暴露后的豚鼠耳蜗电位及毛细胞形态进行观察,发现经过暴露的动物CM幅度不成比例下降,CAP反应提高,提示了脉冲噪声除了对豚鼠外毛细胞损伤外,还可能显著损害耳蜗内传入神经突触[29]。近年研究发现,噪声对IHC与SGN之间带状体突触有明显损伤作用,仅引起TTS的噪声暴露即可引起耳蜗带状突触的永久性损伤[9,10],突触损伤的持久存在会导致SGNs及其神经支配作用的退行性病变,该研究结论已得到了诸多实验结果的验证[9,24,25]。来自人类和动物模型最新数据表明,在嘈杂环境中,传递声音信息的内毛细胞或I型神经元受到损伤,可能会导致听力缺陷[30]。Edward Lobarinas等研究发现:IHC丢失或功能障碍对安静状态下听觉阈值的影响相对较小,但其改变了噪声背景下的听觉阈值,使其在背景噪声中对声音信号的处理能力降低[31]。仅就目前得到的研究证据而言,噪声引起隐匿性听力损失的病理机制主要涉及耳蜗带状突触损害以及继发的突触后听神经的退化,残存或功能异常的突触和听神经纤维对声音的响应能力下降,最终导致了耳蜗听觉系统强度编码能力缺陷[32]。目前研究认为过度噪声暴露引起自由基或活性氧(ROS)的形成以及谷氨酸的过度释放,过量的谷氨酸发挥兴奋性毒性作用,致大量钙离子内流[33],继而引发突触后听神经纤维末梢(特别是柱细胞一侧高阈值、低SR神经纤维)的损害,最终导致在嘈杂环境下言语识别能力下降的现象Bakay WMH等人通过测量小鼠中脑听觉神经元在安静及噪声环境下的声音适应能力,从而研究噪声诱导的HHL对听功能的影响,结果显示噪声暴露后小鼠的神经元对噪声的适应能力较差,且在嘈杂而非安静的环境中的适应能力出现特定的缺陷。这表明即使没有明显的听力损失,听功能也会出现缺陷,这项研究证实噪声诱导的HHL可以影响中脑的听觉编码自适应能力,这可能解释了隐匿性听力损失导致言语识别率下降的相关机制[34]。
4.2 年龄和耳毒性药物因素与隐匿性听力损失
尽管听力障碍存在诸多病因,但年龄相关听力损失的患病人群数量最多,其影响范围涉及年龄超过70岁人口的80%甚至更多[35],即便听觉阈值无显著提高,噪声背景下言语识别能力也会随年龄增长而下降,一般称为“中枢性老年性听力损失”[36]。Merchant等研究发现在衰老过程中,外毛细胞缺失主要发生在负责编码高频听觉信息的基底膜底回区域,并形成了年龄相关性耳聋以高频听力损失为主的基本模式[37]。Makary等在人颞骨组织标本的相关性研究中发现,随着年龄的增长人的耳蜗亦存在广泛SGNs退行性改变[38]。有诸多研究表明衰老与内毛细胞突触损失以及ABR的I波幅值降低密切相关,这种耳蜗带状突触的损伤往往比毛细胞损伤和听敏度下降较早出现[9,20,38],证明了年龄因素对于隐匿性听力损失的产生具有独立的作用。
既往研究发现耳毒性药物导致耳聋的机制主要是损害耳蜗毛细胞。柳柯等人的研究发现连续使用一定剂量的庆大霉素以后,小鼠耳蜗毛细胞和听神经在形态学上并未发生显著变化,但小鼠耳蜗带状突触的改变则非常明显,证明了耳蜗带状突触对于耳毒性药物刺激十分敏感[39,40]。上述研究中对使用药物后的小鼠进行了听力检测,发现了一定程度的ABR阈值提高(10-15dB HL),不足之处是在上述研究的观察区间没有发现ABR阈值完全恢复的情况。因此上述听觉损失不能算作TTS范畴,且这种表现尚不能等同于隐匿性听力损失。
5 隐匿性听力损失的临床检测和干预
目前我国老龄化和城市化进程加快,环境噪声影响日益严重,导致潜在的隐匿性听力损失人群数量急剧增加,HHL事实上已成为当今社会重大的公共卫生健康问题。HHL由于具有隐匿和不典型的临床听力学表现,一般在临床上难以早期发现。总体上,目前认为与患者HHL相关的听力学特征可能包括以下几方面:1)HHL患者听敏度变化不大,常规频率纯音检测听阈正常,听觉障碍往往表现为噪声环境下言语识别或时域分辨能力的下降[25,27,41];2)ABR检测可能提供更多的线索,比如I波幅值以及潜伏期的变化;3)无听阈变化的神经性耳鸣可能是隐匿性听力损失的一种表现形式,需要进一步进行ABR波(I,III,V)幅值、波间期以及I/V比值的检测和分析,综合考虑听觉外周传导阻滞和听觉中枢超兴奋性的因素。目前为止,对于各种因素所致的HHL机制之间的关系尚无结论,且在HHL诊断中也需要考虑精神心理因素和遗传缺陷等因素。而另一方面,目前的研究多倾向于对耳蜗传入神经系统的研究,听觉传出系统是否也参与HHL的发病机制还需要进一步研究。总体而言,当前对于HHL的诊断需要综合采用多种检测方法,包括纯音测听、耳蜗电图、噪声下言语测听及处理后言语测听、DPOAE、ABR检测、频率跟随反应(frequency-following response,FFR)检测等[42]。
目前对于隐匿性听力损失的治疗和干预的研究甚少,因此对于其防护主要聚焦于增加减噪设计、减少噪声源,以及增加噪声防护和更加审慎使用耳毒性药物等方面。动物实验显示,使用神经营养因子圆窗给药可以减缓或修复耳蜗带状突触损伤;使用多巴胺通过耳蜗灌流可减轻突触复合体损伤[43];5-羟色胺受体拮抗剂可增加耳蜗内多巴胺含量,研究表明似乎有改善老年性聋的作用[44];采用药物对抗耳蜗炎性反应可以减轻HHL[45]。尽管如此,由于对隐匿性听力损失的研究还不够深入,因此不论是致病机制还是临床干预均需进一步探索。

