豚鼠圆窗EABR、EMLR与ELLR特征分析
梁文琦 宋新雨 刘攀 王伟 王林娥
首都医科大学附属北京友谊医院耳鼻咽喉头颈外科
电诱发听性脑干反应(electrically evoked auditory brainstem response,EABR)、电诱发中潜伏期反应(electrically evoked middle latency response,EMLR)与电诱发长潜伏期反应(electrically evoked late latency response,ELLR)均属于电刺激听觉诱发电位,它是人工耳蜗植入患者,尤其是儿童患者的一种重要客观评估手段。它能反应听觉神经传导通路的完整性及功能,从而为人工耳蜗植入侧别的选择提供一种客观依据,并可以用来预测人工耳蜗植入术后患者的听觉言语康复效果。目前,患者电刺激听觉诱发电位的引出率及其测试的稳定性尚待进一步摸索与探讨,因此,研究和分析豚鼠全麻下各种圆窗电刺激听觉诱发电位测试的刺激及相关记录参数,可以有效保证电刺激听觉诱发电位波形的引出率和稳定性。
1 材料与方法
1.1 实验动物
选取健康豚鼠6只,雌雄不限,体重400-500g,耳廓反射灵敏,无强噪声暴露及耳毒性药物使用史,电耳镜检查鼓膜正常。
1.2 实验环境及设备
1.2.1 实验环境:EABR、EMLR、ELLR测试均在电磁屏蔽室进行,屏蔽室墙壁铜网接地,操作者禁止携带电子设备,如手机等。
1.2.2 实验设备:本实验采用Neuro-Audio听觉诱发电位仪(Neurosoft Ltd.,Ivanov,俄罗斯),刺激设备选择该公司外置电刺激器。实验软件使用Neuro-Audio1.0.103.2版本。诱发电位仪及电刺激器之间使用USB线缆连接于同一笔记本电脑。EABR、EMLR、ELLR的检测均由刺激系统与记录系统两部分组成。其中刺激系统向耳蜗发放电刺激信号,记录系统在头部相应位点记录产生的诱发电位。
1.2.3 实验电极:刺激电极为直径约0.1mm银球电极,电极一端呈圆球状,圆球直径约0.5mm,电极除球形端及尾端连接处裸露外,其余电极均由绝缘橡胶套包裹。记录电极(正极)、参考电极(负极)及接地电极使用不锈钢针状电极。
1.3 实验方法
采用10%水合氯醛(0.5 ml/100g)于豚鼠腹腔注射麻醉。麻醉满意后先测试双耳ABR,确认听力正常后,将豚鼠置于解剖台,取侧卧位,检测耳朝上。去除豚鼠耳后毛发,牵拉耳廓向前,行耳后切口,逐层分离肌肉至骨面,1ml注射器针头穿刺确认听泡位置。在显微镜下沿穿刺孔扩大打开听泡,暴露圆窗龛(见图1)。将刺激电极正极(银球电极)置于圆窗龛并贴附于圆窗膜表面,刺激电极负极置于同侧乳突皮下,记录电极置于两外耳道口连线与颅正中线交叉处皮下,参考电极置于对侧乳突皮下,地极置于鼻尖皮下(见图2),保证单个电极阻抗<5kΩ,极间阻抗小于3kΩ。实验同时观察豚鼠触须及面部肌肉抽动情况。

图1 示显微镜下打开听泡,暴露圆窗龛。Fig.1 The otocyst were opened and the round window niche was exposed under the microscope.
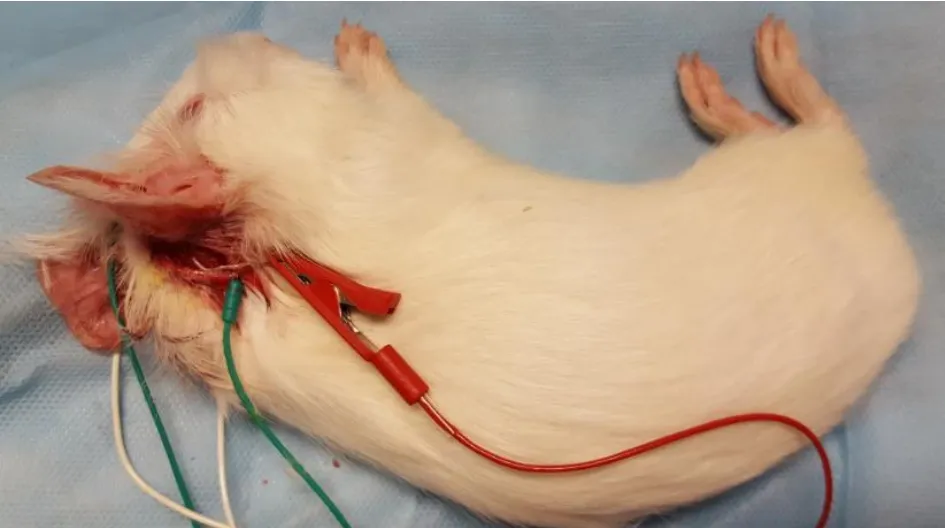
图2 示测试中各电极位置,包括刺激电极正极(a)、刺激电极负极(b)、记录电极(c)、参考电极(d)、地极(e)。Fig.2 The position of each electrode in the test,includes the positive stimulating electrode(a),the negative stimulating electrode(b),the recording electrode(c),the reference electrode(d)and the ground electrode(e).
1.3.1 EABR测试
在Neuro-Audio1.0.103.2中选择eABR(electrical stimulator)模式,刺激频率 21Hz,分析时限10ms,叠加1024次,拒绝水平±10μV,信号输入范围 500μV,低 频 100Hz,高 频 1500Hz,采 样 率160000Hz,交替极性单向脉冲电流,波宽100μs,采用同步触发模式记录结果。监测时程40ms,监测灵敏度20μV,采集时程2ms,采集灵敏度100μV,叠加时程1ms,叠加灵敏度5μV。
1.3.2 EMLR测试
在Neuro-Audio1.0.103.2中选择MLR(基础)模式,刺激频率7Hz,分析时限100ms,叠加512次,拒绝水平±75μV,信号输入范围500μV,低频30Hz,高频300Hz,采样率5000Hz,交替极性单向脉冲电流,波宽200μs,采用同步触发模式记录结果。监测时程40ms,监测灵敏度75μV,采集时程2ms,采集灵敏度1.5μV,叠加时程10ms,叠加灵敏度5μV。
1.3.3 ELLR测试
在Neuro-Audio1.0.103.2中选择LLR(基础)模式,刺激频率1.8Hz,分析时限500ms,叠加1024次,拒绝水平±80μV,信号输入范围 500μV,低频0.1Hz,高频35Hz,采样率5000Hz,交替极性单向脉冲电流,波宽200μs,采用同步触发模式记录结果。监测时程40ms,监测灵敏度100μV,采集时程100ms,采集灵敏度20μV,叠加时程50ms,叠加灵敏度5μV。
2 结果
潜伏期指从刺激开始到各波波峰出现的时间,阈值指能够诱发产生明显可识别波形的最小刺激强度,其中豚鼠EABR阈值以能够诱发产生明显可识别III波的最小刺激强度来判定,豚鼠EMLR阈值以能够诱发产生明显可识别Pa波的最小刺激强度来判定,豚鼠ELLR阈值以能够诱发产生明显可识别P2波的最小刺激强度来判定.
本实验全麻下听力正常豚鼠6只(12耳)在实验过程中耐受良好,未出现触须及面部肌肉抽动,未发生死亡。其中12耳均记录到分化良好且稳定的EABR波形,以III波最显著(见图3);7耳记录到分化良好且稳定的EMLR波形(见图4),7耳记录到分化良好且稳定的ELLR波形(见图5)。豚鼠圆窗EABR(12耳)、EMLR(7耳)、ELLR(7耳)测试的阈值与潜伏期均值见表1-3。

图3 示听力正常豚鼠圆窗EABR波形。可引出较明显的Ⅲ波,随着刺激量的增加波幅增大。Fig.3 EABR waves of healthy guinea pig.The obvious III wave can be induced,and the amplitude increases with the increase of stimulation.

图4 示听力正常豚鼠圆窗EMLR波形。可引出规律Na、Pa、Nb、Pb波,随着刺激量的增加波幅增大。Fig.4 EMLR waves of healthy guinea pig.The regular Na,Pa,Nb and Pb waves can be induced,and the amplitude increases with the increase of stimulation.
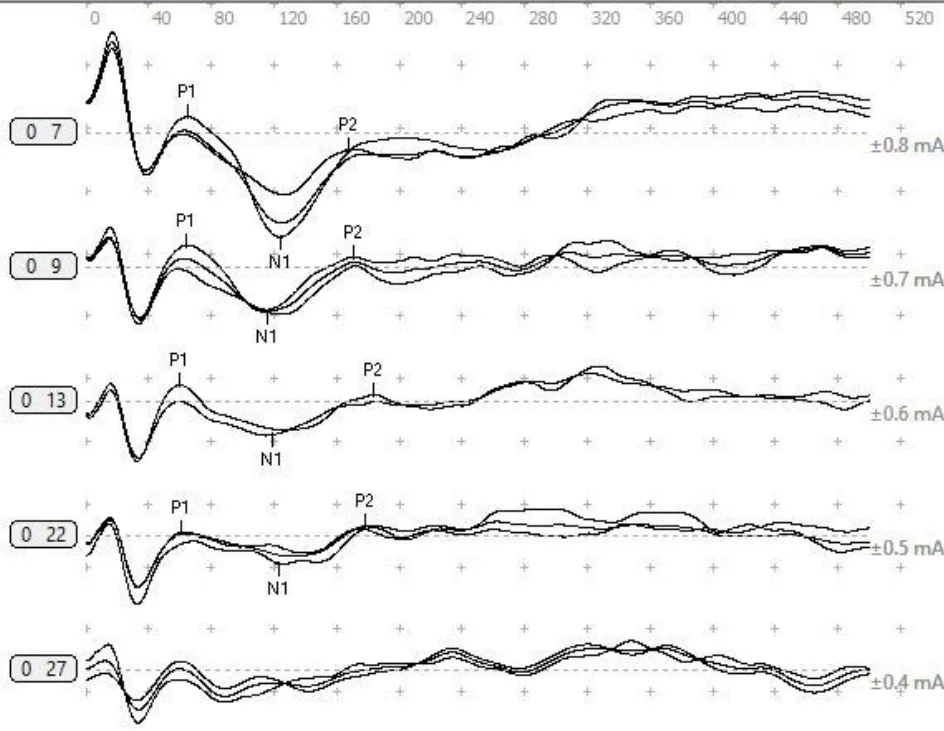
图5 示听力正常豚鼠圆窗ELLR波形。可引出规律的P1、N1、P2波,随着刺激量的增加波幅增大。Fig.5 ELLR waves of healthy guinea pig.The regular P1,N1 and P2 waves can be induced,and the amplitude increases with the increase of stimulation.
3 讨论
听力障碍严重影响人们的日常生活及社会活动,尤其是先天性听力障碍的患儿,如果不能尽早恢复听力,将导致其听觉和言语发育发生难以逆转的停滞。人工耳蜗植入(cochlear implant,CI)不仅可以帮助听力障碍患者恢复听力,更能够促进其言语的发育。人工耳蜗植入技术逐渐发展与成熟,但目前仍无可靠方法评价内耳畸形、术前无残余听力、听神经病等患者的听觉通路状态与功能,因此无法预测这些患者CI术后听觉言语康复效果。
近年来的多项研究认为以电刺激为诱发形式的听觉诱发电位,主要包括EABR、EMLR与ELLR等,能客观反映听觉通路的状态和功能。1979年Starr和Brackmann首次报道了对多导人工耳蜗植入患者进行EABR测试[1]。EABR通过刺激螺旋神经节细胞,诱发听神经和脑干产生相关电位活动,在潜伏期1-10ms范围内产生一系列反应波形。EABR各波的起源和形态与听性脑干反应(auditory brainstem responses,ABR)各波基本相同:波Ⅰ来源于听神经,波Ⅱ主要来源于耳蜗核,波Ⅲ来源于上橄榄核,波Ⅳ来源于外侧丘系核,波Ⅴ来源于下丘脑,波Ⅵ可能来源于内侧膝状体,波Ⅶ可能来源于丘脑皮质听放射区域[2]。其中波Ⅰ、波Ⅱ和波Ⅳ不常出现在反应波中,波Ⅲ和波Ⅴ较易被记录到,而豚鼠最易分辨波形为III波,本研究中12耳均记录到III波。EABR记录了听觉系统诱发反应的短潜伏期成分,故判读易受电刺激伪迹的干扰。相关研究发现,EABR与听神经病[3]、内听道狭窄[4]、蜗神经管狭窄[5]、蜗轴缺如[6]及 Mondini畸形[7]等特殊病例的术后言语功能的发展有关,是一项准确反映脑干以下听觉传导通路完整性、功能性和可塑性的客观电生理检查手段,已在临床广泛应用。Nicolas-Puel[8]等研究发现,全麻豚鼠圆窗EABR阈值为47.1±4.1μA,其潜伏期约2.56±0.08ms,在本研究中,全麻豚鼠圆窗EABR阈值为0.27±0.05mA,其潜伏期约1.95±0.29ms。

表1 豚鼠EABR III波潜伏期及阈值(n=12)Table 1 Latency and thresholds of EABR III wave in guinea pigs
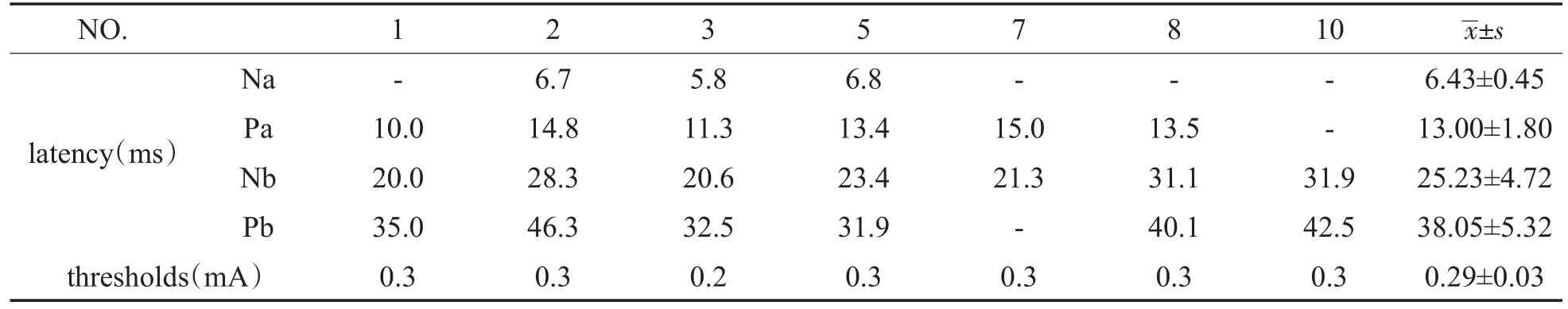
表2 豚鼠EMLR各波潜伏期及阈值(n=7)Table 2 Latency and thresholds of EMLR waves in guinea pigs

表3 豚鼠ELLR各波潜伏期及阈值(n=7)Table 3 Latency and thresholds of ELLR waves in guinea pigs
与EABR相比,EMLR潜伏期较长,故其受电刺激伪迹的影响较小。中潜伏期反应(middle latency response,MLR)是指听觉诱发电位在刺激开始后8-100ms出现的反应,它反映了听觉通路中丘脑以至听皮层等高级中枢的情况,其主要成分包括一系列规律变化的负波(Na)、正波(Pa)、负波(Nb)以及正波(Pb),其中以Pa波最显著。1958年Geisler首次报道了对人进行听觉诱发电位中潜伏期反应测试(auditory evoked middle latency response,AMLR)[9]。EMLR与AMLR的起源相似,其中Na波起源于下丘脑,Pa波起源于颞叶的初始听觉皮层[10],其余波形的起源尚未明确。EMLR波形受刺激位置、刺激参数、刺激电极、患者年龄、麻醉与睡眠等多种因素的影响[11]。本研究12耳中7耳引出易分辨的EMLR波形,分析未引出的原因可能与测试时豚鼠的麻醉状态不同有关。后续研究中,可以在监测豚鼠麻醉状态下进行EMLR测试。目前有研究报道豚鼠致聋后EMLR波形变化,但并未提及正常豚鼠EMLR波形的潜伏期和阈值[12]。本研究豚鼠(7耳)圆窗EMLR的阈值为0.29±0.03 mA,Na波的潜伏期为6.40±0.44 ms,Pa波的潜伏期为13.00±1.80 ms,Nb波的潜伏期为25.23±4.72 ms,Pb波的潜伏期为38.05±5.32 ms。
ELLR反映了更高级别听觉传导通路的功能。ELLR的主要成分包括P1、N1、P2、N2,其中以P2波最显著。其中P2起源于初级听觉皮层[13]。长潜伏期反应(late latency responses,LLR)受年龄及受试者状况的影响[14],且植入时间越长,振幅越大[15]。目前,关于ELLR各波的起源及影响因素等尚待进一步研究。本研究12耳中7耳引出可分辨的ELLR波形,未引出的原因可能与测试时豚鼠处于麻醉状态,对听觉皮层产生抑制等有关。在后续研究中,建议于豚鼠清醒状态下进行ELLR测试。关于豚鼠ELLR检测的研究尚未见报道。本研究豚鼠(7耳)圆窗ELLR的阈值为0.34±0.10 mA,P1波的潜伏期为82.96±17.61 ms,N1波的潜伏期为142.86±21.81 ms,P2波的潜伏期为202.71±20.83 ms,N2波的潜伏期为293.75±21.43 ms。Maurer发现,EABR和言语识别率的统计学相关度高于LLR[16]。
CI术后患者言语康复效果的提高不仅取决于螺旋神经节细胞的数量和功能,还取决于听觉通路的状态和功能。因此,我们需要采用EABR、EMLR及ELLR检测来客观评估听觉通路的状态和功能,从而在术前给患者一个心理预期,减少医患矛盾的产生,并可以继续用于术后各个阶段测试,客观评估听觉传导通路功能的变化和可塑性。本研究采用蜗外电刺激的方式,记录到全麻豚鼠分化重复性良好且稳定性较好的圆窗EABR、EMLR、ELLR波形,为EABR、EMLR、ELLR的临床应用提供了参考,有待进一步探讨和研究。后续我们将为致聋豚鼠分别行圆窗EABR、EMLR、ELLR测试,为临床上耳聋患者人工耳蜗植入术后听觉言语康复效果的预测提供基础。

