巨噬细胞在内耳急性损伤中的作用
陈林军 韩维举
中国人民解放军总医院耳鼻咽喉头颈外科
聋病教育部重点实验室
聋病防治北京市重点实验室
军事声损伤防护实验室(北京100853)
耳蜗Corti器的上皮细胞对于很多急慢性刺激很敏感,当受到急性刺激如声损伤和耳毒性药物时,可引起耳蜗Corti器的毛细胞和与其相连的螺旋神经元损伤从而引起听力下降[1]。目前有研究表明,加剧声损伤及耳毒性药物造成的毛细胞和神经元进一步损伤的免疫应答中有免疫细胞产生的活性氧(ROS)和细胞因子的参与[2],很多针对炎症的干预治疗能有效的减轻炎症相关的神经性耳聋的损伤水平[3,4]。30年前Fredelius和Rask-Andersen[5]第一次报道了噪声性耳聋存在耳蜗免疫细胞的浸润,近10年间,免疫系统与先前被认为“免疫豁免”的耳蜗之间的相互关系作为一个新兴的研究领域,其研究不断深入。本文重点介绍巨噬细胞浸润与声损伤和耳毒性药物等急性损伤后引起听力损失间的关系。
1 巨噬细胞在内耳的分布
基于内耳血迷路屏障阻挡免疫细胞和大分子免疫蛋白侵入作用的认识,既往认为内耳是“免疫豁免”器官,但近来对内耳免疫应答的研究发现免疫系统能够在内耳中起反应[6-8],不过研究发现耳毒性药物或声损伤引起的耳蜗炎症不是针对病原体产生的,该免疫反应称为无菌炎症[9]。内耳的巨噬细胞包括驻留巨噬细胞和浸润巨噬细胞(标记CD163+、IBA1+和CD68+),其主要分布于耳蜗外侧壁、骨螺旋板、螺旋神经元和感觉上皮等部位[1,10-14](图1)。目前认为这些细胞属于先天性免疫系统和适应性免疫系统[15]。内耳巨噬细胞在耳蜗生理和病理方面起着重要作用,常驻巨噬细胞通过监视、清除有害物质和修复受损细胞来保护内耳,但适应性免疫系统会继发释放破坏性炎性因子导致细胞破坏、死亡。内耳免疫细胞受声损伤、耳毒性药物等急性刺激,诱导血液中的单核细胞募集到受损的内耳螺旋神经节、基底膜和外侧壁[13,16-19]。
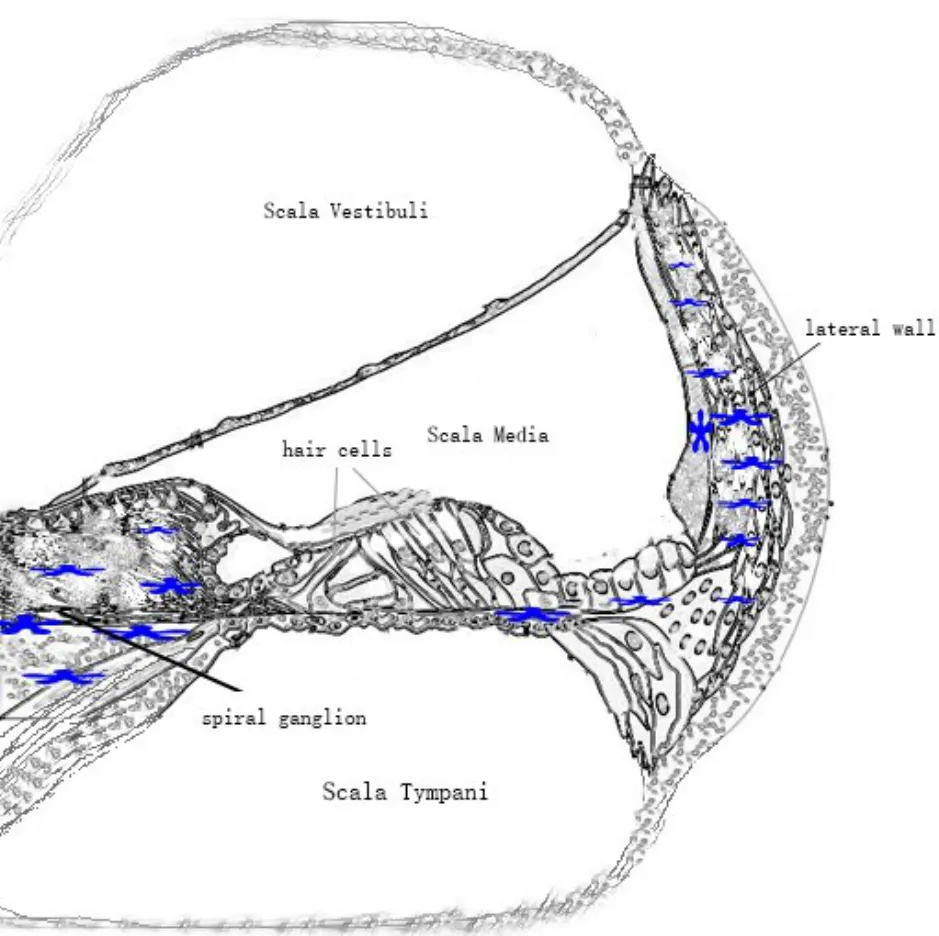
图1 内耳巨噬细胞的分布:蜗螺旋管的分区,包括鼓阶、前庭阶及中阶。蓝色的符号表示内耳巨噬细胞,其分布于螺旋神经元、外侧壁及感觉上皮等部位。Fig.1 Distribution of cochlear macrophages.The division of the cochlear which includes scala vestibuli,scala media and scala tympani.Cochlear macrophages are marked by blue star,which distributes in spiral ganglion,lateral wall and sensory epithelium.
2 浸润巨噬细胞的类型
CD45最先用于识别声损伤后浸润耳蜗的巨噬细胞的标记物[20],Hirose[17]结合CD45的表达和形态学特点将大多数浸润巨噬细胞鉴定为单核细胞或巨噬细胞,随后发现声损伤后浸润免疫细胞还包括CD45+、F4/80+、IBA1+、CD11b+和CX3CR1+巨噬细胞[13,14,20-23]。这些标记物对于识别巨噬细胞群很重要,但并非所有浸润巨噬细胞和常驻巨噬细胞都具有相同特征。通过细胞分选仪和流式细胞仪灵敏度的提高将进一步了解这些巨噬细胞的分子特征。目前渗透到耳蜗的特定细胞类型的鉴定仍在进行,但已了解这些细胞在声损伤或耳毒性药物等急性刺激后到达耳蜗的时间。
由于声损伤与耳毒性药物影响内耳免疫系统不尽相同,因此需要了解每种损伤产生免疫应答的情况,而通过检测内耳的细胞因子、Icam-1的表达和巨噬细胞的浸润,很难得出内耳产生整体免疫应答的结论。目前研究发现在声损伤后6h TNF-α、IL-1β、IL-6及CCL2、CCL4、CXCL12即刻表达[4,8,12,20,22,24,25]。损伤后3-4天,耳蜗中CX3CR1+和CD45+细胞的数量达到峰值[17,19]。细胞因子在声损伤6h后开始表达,这可能是损伤即刻CX3CR1+巨噬细胞和纤维细胞活化的结果[12,19,21,26]。这些细胞因子的总体作用是诱导耳蜗螺旋神经元和外侧壁纤维细胞和巨噬细胞的激活,从而分泌更多的细胞因子加重炎症。
3 常驻巨噬细胞的作用
Shi[27]发现在内耳存在血管周围常驻巨噬细胞,它具有免疫防御、组织修复及免疫监视功能,产生超氧化物阴离子和炎性因子,并清除入侵的病原体、衰老坏死的细胞。杨[6]等发现给噪声后CD45+免疫细胞主要出现在毛细胞损伤严重的部位,推测巨噬细胞在噪声性耳蜗引起毛细胞的损伤后发挥免疫防御及修复功能。Okano[21]用γ射线照射杀死小鼠内耳的骨髓造血细胞和巨噬细胞,然后用内源性荧光标记的骨髓细胞移植,可见内耳的巨噬细胞重新构建,通过巨噬细胞形态与F4/80、IBA-1、CD11b和CD68标记染色的巨噬细胞约占80%[21,28],说明其是骨髓细胞来源的,而剩下的20%为常驻巨噬细胞,且CX3CR1标记呈阳性。Sato[23]用GFP敲入破坏CX3CR1信号传导的CX3CR1gfp/gfp小鼠模型,观察卡那霉素治疗组的耳蜗毛细胞损失随浸润的CD45+细胞数量增加而增加。此外将CX3CR1gfp/gfp骨髓移植到野生型小鼠中也出现同样的情况,表明CX3CR1信号中断不利于氨基糖苷类药物暴露后的毛细胞存活。Kaur[19]发现用白喉毒素特异性造成毛细胞丢失的小鼠中,若没有CX3CR1的表达则螺旋神经元的死亡增加。总之,这些结果表明在使用氨基糖苷类药物后,常驻巨噬细胞的CX3CR1可能在减少巨噬细胞浸润和毛细胞死亡方面发挥重要作用。因此,进一步研究CX3CR1+巨噬细胞对耳蜗损伤的保护作用,对于了解巨噬细胞在调节耳蜗损伤后炎症反应中的积极作用具有重要意义。
4 Toll样受体的激活及免疫调节
一些研究表明Toll样受体4(TLR4)激活是声损伤、耳毒性药物刺激后导致耳蜗无菌炎症的一种途径[26]。TLR4是一种识别多种配体的模式识别受体(PRR),可在无菌炎症过程中激活,其下游效应是产生ROS和活化NF-κB[29,30]。尽管在这些研究中激活TLR4的确切配体尚不清楚,但受这些因素影响内耳均出现TLR4表达的增加[18,26,31]。反过来,TLR4激活又导致 NF-κB 活化和 TNF-α、IL-1β、IL-6的增加[26]。而用脂多糖处理的声损伤、氨基糖苷类和顺铂药物的三组小鼠,发现内耳炎症增加的同时伴听力损失的加重,而TLR4缺乏的小鼠内耳却表现出较轻的炎症及较少的听力损失[18,26,31]。
目前研究用小鼠模型和药物来识别内耳损伤引起的特定细胞因子和信号传导通路。Wakabayashi[4]用IL-6R的中和抗体阻断声损伤后释放的IL-6,发现在声损伤3天后CD45+和IBA1+双阳性细胞的浸润显著减少,同时螺旋神经元细胞死亡减少。此外全身给药的抗体在声损伤后可穿过血迷路屏障,这为生物制剂在内耳损伤中的应用提供了可能。Sun[28]用米诺环素减少巨噬细胞的活化,从而降低浸润巨噬细胞对毛细胞的损伤。当米诺环素与新霉素一起给药时,发现耳蜗巨噬细胞浸润减少的同时毛细胞死亡减少,听力损失也减少,这说明阻断巨噬细胞诱导的炎症有利于减轻新霉素引起的听力损失。这些结果表明通过调节免疫系统可保护耳蜗免受声损伤及耳毒性药物损害,说明TLR4受体和炎性细胞因子的早期刺激在受损后的毛细胞死亡中起作用,说明存在全身性炎症影响内耳炎症免疫反应的可能。
5 声损伤后内耳的免疫反应
当组织因非病原体刺激如声损伤、耳毒性药物使用,产生的细胞产物称为损伤相关分子模式(DAMP)和模式识别受体(PRR)[32]。这种PRR激活迅速引起常驻巨噬细胞的激活,释放促炎细胞因子和活性氧,诱导受损细胞凋亡和巨噬细胞的浸润[29-33]。DAMP-PRR信号转导引起的早期炎症是控制病原体或坏死组织传播的进化保守机制。首先对炎症反应的是先天性免疫系统的细胞,即骨髓来源的巨噬细胞和中性粒细胞,其试图通过释放ROS、吞噬死亡细胞来消灭死亡的细胞。其次是适应性免疫系统的T细胞,其在无菌炎症部位可识别细胞损伤产生的自身抗原从而清除受损细胞[34]。Herranen[35]研究受噪声刺激的小鼠,发现其耳蜗外侧壁的应激相关通路如JNK/c-Jun、ERK和NF-κB被激活,造成外毛细胞的损伤。可见受噪声或耳毒性药物刺激后产生的炎症信号在毛细胞死亡中起作用。目前大多数研究主要集中在预防炎症的早期阶段,而忽视了免疫系统在炎症中后期发挥的调节炎症和促进伤口愈合的作用[36-39]。
6 声损伤后的内耳基因表达
目前研究已从声损伤后的病理生理变化深入到基因调控水平,而通过RNA转录组测序可了解耳蜗整体如何应对声损伤[40]。Gratton较早比较噪声对易受声损伤和抗声损伤的小鼠耳蜗外侧壁和Corti器的影响[41],发现在噪声后易受声损伤组表达的免疫相关的基因比抗声损伤组表达的更多。另外Yang[11]利用RNA测序来比较噪声后1天的小鼠和大鼠感觉神经上皮的基因表达,发现声损伤后两者均表现出免疫应答基因的上调,表明这种基因表达在哺乳动物物种中是保守的。Tan[12]进一步研究声损伤后多个时间点的免疫应答基因和蛋白表达,发现早在损伤后6h,编码TNF-a、IL-1β和Icam-1的基因表达增加,且Icam-1蛋白在声损伤后14天仍高表达。此外尽管这些研究使用了不同的鼠,但几种参与炎症反应的免疫基因在声损伤后均有表达[11,12,41],如 Fos、Socs3、Gpb2、Icam-1 和 CCR2。Socs3可表达降解信号分子来抑制JAK/STAT依赖性细胞因子信号传导[42],调节浸润巨噬细胞的吸附和常驻巨噬细胞的活化。Icam-1在TNF-α引起NF-κB活化后表达,通过与淋巴细胞功能相关抗原的相互作用促进血液中的细胞外渗,使巨噬细胞进入耳蜗[43]。Fos和Gbp2在声损伤后由干扰素诱导激活STAT通路[44-45]。CCR2缺乏的小鼠表现出极大的声损伤易感性,声损伤后伴毛细胞的大量死亡[46]。尽管声损伤后在耳蜗中可检测到相关免疫基因的大量表达,但可能只是一部分细胞类型上调了这些基因。因此识别这些细胞类型将能够特异性地了解它们对毛细胞的损伤机理。
7 巨噬细胞在内耳研究中的现状和展望
现在已认识到耳蜗内存在着免疫细胞,但对其在维持耳蜗内稳态和参与炎症调控中的作用机制的认知仍不足。当前对内耳免疫系统的研究主要集中于声损伤、耳毒性药物刺激后内耳TLR4激活、促炎细胞因子和趋化因子的释放以及浸润巨噬细胞的聚集,也已经发现通过调节免疫系统可减轻内耳炎症产生的损伤。因此目前应通过以下几方面更多地了解声损伤和耳毒性药物损伤后内耳的免疫应答的机理。首先,识别所有进入耳蜗的免疫细胞类型。其次,探索其特定功能,以了解其分泌产物和细胞间的相互作用是如何引起内耳的炎症反应。最后,研究每个PRR家族以更好地明确哪些DAMP在损伤后引起内耳炎症反应。这些研究结果能加深对耳蜗“无菌炎症”免疫应答的认识,同时指出耳毒性药物和噪声引起的听力损失的预防性治疗位点。

