结肠癌不同转移潜能细胞株SW620及SW480的代谢组学研究
牛燕,周怡,郑宏,赵良才,李晨,高红昌
(温州医科大学 药学院,浙江 温州 325035)
结直肠癌是临床常见的恶性肿瘤之一,在世界范围内发病率位居第三,致死率位居第四[1]。在我国,结直肠癌的发病率和病死率呈逐年上升的趋势,严重威胁着人类的生命健康[2]。转移是恶性肿瘤的重要生物学表型,是结直肠癌患者病死的主要原因之一。而异常的代谢模式是恶性肿瘤的另一重要特征[3],多项研究[4-6]表明代谢方式的改变参与肿瘤转移。基于核磁共振氢谱(1H nuclear magnetic resonance spectroscopy,1H NMR)的代谢组学方法,能定性、定量分析代谢物水平,已广泛用于筛选疾病发生相关的生物标志物,探讨发病机制和药物动力学研究等[7-8]。本研究基于1H NMR的代谢组学技术,探索SW480、SW620两种不同转移潜能的结肠癌细胞的代谢模式,为进一步筛选结直肠癌转移相关标志物和寻找新靶点提供依据。
1 材料和方法
1.1 细胞和主要试剂 人结肠癌高转移性细胞株SW620和低转移性细胞株SW480购自美国菌种保藏中心。PMI Modified Medium培养基购自美国Hyclone公司,磷酸盐缓冲液购自北京Solarbio公司,0.25%Trypsin购自上海吉凯基因科技有限公司,三甲硅烷基丙磺酸钠(TSP)购自美国Sigma公司,D2O(99.9%氘代)购自美国剑桥同位素实验室,谷氨酰胺LGlutamine、葡萄糖D-(+)-Glucose Solution购自美国Sigma公司,NaOH购自美国Acros Organics公司,XF Base Medium Minimal基础培养液、XF Calibrant校准液、Seahorse XF细胞线粒体压力测试试剂盒、Seahorse XF糖酵解压力测试试剂盒购自美国Seahorse Bioscience公司,胎牛血清购自美国GEMINI公司。
1.2 主要仪器 Bruker AVANCE III 600 MHz NMR波谱仪购自德国Bruker公司,Seahorse XF96细胞能量代谢分析仪购自美国Seahorse Bioscience公司,无CO2培养箱、CO2培养箱、超低温冰箱购自美国Thermo公司,低温高速离心机购自德国Eppendorf公司,超净台购自北京东联哈尔仪器制造公司,倒置显微镜购自日本Nikon公司,冷冻干燥机购自德国Christ公司。
1.3 方法
1.3.1 细胞株及细胞培养:采用来自同一亲本、遗传背景一致的人结肠癌高转移性细胞株SW620和低转移性细胞株SW480。用含10%胎牛血清和1%双抗的RPMI Modified Medium培养基,在37 ℃、5% CO2的条件下传代培养。
1.3.2 细胞样本收集及胞内代谢物提取:处于对数生长期的SW480和SW620细胞用15 mL冰0.9%氯化钠溶液快速洗2遍,终止代谢;加15 mL Hank’s平衡液洗1遍;加2.5 mL胰酶消化,终止消化,转移至15 mL离心管中;2 000 r/min,4 ℃,离心5 min,收集细胞沉淀;加5 mL Hank’s平衡液再2 000 r/min,4 ℃,离心5 min,弃上清;加冰甲醇∶氯仿=2∶1(300 μL+150 μL),超声冰上破碎30 min;加冰氯仿∶水=1∶1(225 μL+225 μL),涡旋1 min,置于冰上15 min;12 000 r/min,4 ℃,离心20 min;取上清液,冻干48 h。
1.3.31H NMR样本的制备和图谱采集:SW480和SW620细胞代谢物提取冻干粉末中加500 μL含TSP浓度为0.05 mmol/L的D2O,震荡15 s至完全溶解,置于4 ℃,12 000×g条件下离心10 min,取上清490 μL,移入直径为5 mm的NMR样品管。使用Bruker AVANCE III 600 MHz NMR谱仪进行检测。采用单脉冲序列,预饱和法压制残余水峰。为了能够对代谢物的1H NMR进行定量分析,试验中脉冲翻转角为90°,采样点数32 K,累加次数1 024次,弛豫延迟为4 s,实验温度为298.0 K。基于多维NMR技术,结合本课题组以前发表的工作[9-12],以及NMR Suite软件(加拿大Chenomx公司)和网络数据库(Human Metabo-lome Database,www.hmdb.ca)对采集的谱图中的代谢物进行详细确认。
1.3.4 谱图处理:为了得到更多的代谢相关信息并且更直观也更客观地发现组间差异代谢物,采用Bruker Topspin 2.1软件将所有样本的谱图导成数据,然后应用MATLAB R2013b软件(美国Mathworks公司)对所有样本1H NMR谱图积分数据进行位置校正,为了消除饱和水峰时引起的谱线扭曲,除去预饱和压水峰后的残留水峰区。之后将积分数据导入SIMCA-P+12.0软件包(瑞典Umetrics公司)进行多元统计分析。PLS-DA的第一主成分(principal component 1,PC1)和第二主成分(principal component 2,PC2)可以代表矩阵中最大的信息变量,Q2代表模型的预测能力。其构建的得分图上的每一个点代表一个样本的代谢模式,相应的载荷图反映积分区间对分组的贡献[13-14]。
1.3.5 Seahorse XF96细胞能量代谢分析:使用Seahorse XF96细胞能量代谢分析仪测量线粒体耗氧率(oxygen consumption rate,OCR)和细胞外酸化率(extracellular acidification rate,ECAR)来实时监测基础呼吸、线粒体呼吸、糖酵解。在XF96细胞培养板上接种SW480和SW620细胞,4×104个/孔,于37 ℃ 5% CO2培养箱中培养24 h。在测定前1 h,在37 ℃无CO2培养箱中,更换培养基为含有11 mmol/L葡萄糖和2.05 mmol/L谷氨酰胺的无碳酸氢盐的XF Base Medium Minimal 1640。Seahorse测量板A孔中加入寡霉素(Oligomycin,1.0 μmol/L),B孔中加入羰基-氰-对-三氟甲氧基苯腙(FCCP,1.0 μmol/L),C孔加入抗霉素A和鱼藤酮的组合抑制剂(Rot/AA,0.5 μmol/L),测定细胞OCR水平[15-16]。对于ECAR的检测,需首先测定含葡萄糖(11 mmol/L)时的基础糖酵解速率和线粒体呼吸产生的酸化速率;板内加入Rot/AA(0.5 μmol/L)记录细胞的最大代偿性糖酵解能力;再加入2-脱氧-D-葡萄糖(2-DG,50 mmol/L),记录糖酵解储备能力,计算细胞ECAR水平[17]。
1.4 统计学处理方法 应用SPSS18.0软件进行统计学分析。数据以表示,2组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 细胞裂解物1H NMR谱归属结果 通过1H NMR谱可以同时获得结直肠癌细胞SW480和SW620的多种水溶性小分子代谢物信息,包括:异亮氨酸/亮氨酸(δ0.95)、缬氨酸(δ1.02)、乳酸(δ1.33,δ4.10)、丙氨酸(δ1.47)、乙酸(δ1.91)、谷氨酸(δ2.36)、琥珀酸(δ2.40)、谷氨酰胺(δ2.46)、谷胱甘肽(δ2.52)、肌酸(δ3.03,δ3.90)、氧化磷酸胆碱(δ3.19)、牛磺酸(δ3.25,δ3.40)、甘氨酸(δ3.55)、葡萄糖(δ4.65,δ5.24)、肌苷(δ6.08)、延胡索酸(δ6.50)、ATP(δ6.14)、酪氨酸(δ6.89,δ7.20)、苯丙氨酸(δ7.39)。见图1。

图1 SW480细胞(A)和SW620细胞(B)典型的1H NMR谱
2.2 PLS-DA分析结果 原发性结直肠癌细胞SW480和高转移潜能SW620细胞的代谢模式能够在第一主成分上明显分开(R2X=0.736,R2Y=0.985,Q2=0.97,见图2A),对应的模式置换图也显示所建立的PLSDA模型是可行的(见图2B)。从第一主成分相应的载荷图中可以看出支链氨基酸(branched chain amino acid,BCAA,即亮氨酸、异亮氨酸、缬氨酸)、乳酸、丙氨酸、乙酸、葡萄糖、肌苷、延胡索酸等代谢物对2组细胞代谢模式的区分有较大的贡献,对应的颜色越红表示其贡献越大(见图2C)。
2.3 代谢物定量分析 与原发性结直肠癌细胞SW480相比,具有高转移潜能的SW620细胞中葡萄糖代谢相关的代谢物乳酸显著升高;氨基酸代谢中,异亮氨酸、丙氨酸、甘氨酸水平升高,乙酸、牛磺酸水平显著降低(P<0.05);能量代谢相关的代谢物氧化磷酸胆碱、ATP、肌苷显著下降,琥珀酸显著升高(P<0.05),见图3。
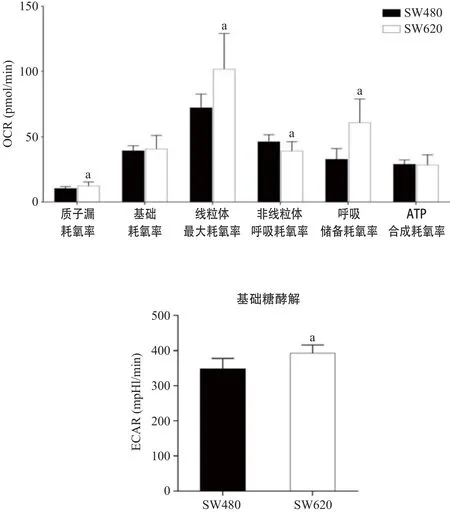
2.4 Seahorse XF96细胞能量代谢分析 根据Seahorse中Mito-Stress结果,具有高转移潜能的SW620细胞OCR水平较高(见图4)。具体变化为:基础呼吸(即细胞在加寡霉素刺激之前的OCR值)和偶联ATP产生的呼吸(即基础呼吸OCR值和加入FCCP刺激之前的OCR值之差)。SW480和SW620细胞之间这2种呼吸并没有显著差异,而具有高转移潜能的SW620细胞最大呼吸能力显著升高(P<0.01),即加入FCCP之后至加Rot/AA之前OCR最大值与加入寡霉素之后OCR最低值之差。同时,SW620细胞呼吸储备能力也显著升高(P<0.01),质子漏耗氧率升高,即细胞呼吸过程转化为热量的氧消耗量非线粒体呼吸耗氧量降低,说明高转移潜能的SW620细胞更倾向于线粒体呼吸方式。总而言之,SW620细胞呼吸异常升高同时释放出更多的热量。
葡萄糖是细胞糖酵解的能量来源,能促进细胞的糖酵解,其终产物是乳酸,从而提高细胞ECAR,XF Glycolytic Rate Assay明确SW620的ECAR水平较高。具体变化为:我们定义基础糖酵解为加入Rot/AA之前的ECAR值,它代表细胞对葡萄糖的吸收能力和细胞代谢的活力;当加入Rot/AA后,细胞有氧呼吸被抑制,所得的ECAR值代表细胞最大糖酵解代偿能力,当再加入2-DG后,糖酵解途径被抑制,ECAR值下降,证明所得的ECAR值是由细胞糖酵解所引起的,它代表细胞的糖酵解能量代谢水平和能力(见图5)。这一结果与1H NMR谱图结果中检测到SW620细胞内乳酸水平升高一致,均表明SW620细胞糖酵解能力显著升高。
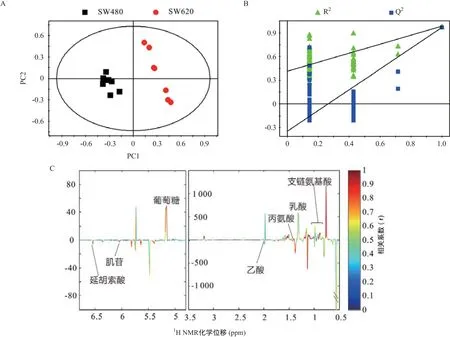
图2 2种细胞1H NMR谱的PLS-DA分析结果
3 讨论
结直肠癌的发生及转移是一个多因素、多步骤的复杂过程,研究表明,代谢模式的异常与结直肠癌的发生发展及转移密切相关[4-6]。研究结直肠癌转移进程的代谢模式,进一步了解结直肠癌转移机制,可为其提供诊断标志物和治疗靶点。
在本研究中,我们以不同转移潜能的结直肠癌细胞株作为研究对象,应用1H NMR技术,结果发现SW480、SW620细胞的代谢模式存在明显不同,多种代谢物的水平在2种细胞株中有显著差异。
肿瘤的侵袭及转移需要大量能量,与SW480相比,高转移潜能的SW620细胞中乳酸等水平显著升高。多项研究表明肿瘤细胞有较高含量的乳酸,其诱导的酸性环境能够抵抗细胞凋亡并促进肿瘤细胞转移[18-19]。琥珀酸水平在SW620细胞中也显著升高,LU等[20]发现TCA循环中间体在不同转移潜能肿瘤细胞中有显著差异,其含量随转移潜能增加而增加。为了进一步探讨不同转移潜能细胞株的能量代谢,本研究通过使用Seahorse细胞代谢能量分析仪测定ECAR水平,结果发现SW620细胞的基础糖酵解水平较高,该结果与NMR检测到乳酸水平升高相对应,也与SIMES等[19]在乳腺癌中的研究结果相一致。此外,OCR的活性也被证明与多种肿瘤的侵袭能力相关[21-22],我们的结果也显示高转移能力的SW620具有较高水平的OCR。
氨基酸参与多种生化反应,CHEN等[23]指出,与健康人相比,结直肠癌患者的多种氨基酸如丙氨酸、谷氨酸、色氨酸、甘氨酸等水平显著升高。MONTROSE等[24]指出结直肠癌的发展进程中氨基酸水平都有阶段性改变。我们发现丙氨酸水平在SW620中较高,这与高转移潜能的4T1细胞相一致[19]。此外,高转移潜能的SW620细胞中谷氨酰胺水平显著升高。谷氨酰胺是合成核苷酸、氨基酸和ATP的必要底物,也是TCA循环的主要前体,谷氨酰胺成瘾在肿瘤细胞中较常见[25]。SINGH等[26]指出侵袭性高的细胞株中谷氨酰胺成瘾与细胞转移能力相关。

图3 SW480细胞和SW620细胞的代谢通路图

图4 2种细胞OCR水平测定结果
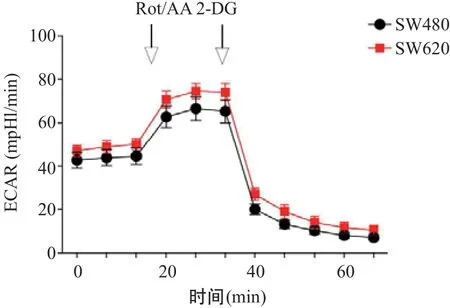
图5 2种细胞ECAR水平测定结果
综上所述,本研究运用1H NMR技术并结合Seahorse XF96分析不同转移潜能结肠癌细胞株的代谢模式,两者代谢模式存在显著差异,与SW480细胞相比,转移潜能高的SW620细胞具有更高的糖酵解水平、TCA循环活性、氨基酸水平、ECAR和OCR水平。SW620中较高的代谢基础潜能,提示其高转移能力的能量需要,也能更快适应其所在微环境。

