miR-17-5p在大鼠垂体泌乳素腺瘤MMQ细胞耐药中的作用
管佳清,许家栋,王春勇,苏志鹏,蔡霖,陈贤斌,郑伟明
(温州医科大学附属第一医院 神经外科,浙江 温州 325015)
垂体泌乳素腺瘤是临床上最常见的垂体腺瘤类型,占垂体腺瘤的40%~66%,年发病率达6~10/10万[1-2]。卡麦角林(cabergoline,CAB)和溴隐亭作为多巴胺受体激动剂(dopamine agonist,DAs),是目前临床上治疗垂体泌乳素腺瘤的首选药物。而相比于溴隐亭,CAB具有临床疗效更好,不良反应更少且药物的半衰期更长等特点,能够有效地减小肿瘤体积和抑制泌乳素分泌[3-5]。然而,临床上仍还有大约11%的泌乳素瘤患者对CAB治疗耐药[6],这部分患者常因药物治疗无效而出现高泌乳素血症和显著的肿瘤占位性症状。垂体泌乳素腺瘤的耐药是一个在临床上亟待解决的问题。
微小RNA(microRNAs)家族由一系列长16~29 nt的非编码单链RNA组成[7],该类RNA能特异性结合靶基因mRNA的3'UTR位点,从而调节靶基因的表达[8]。研究证实,包括乳腺癌[9]、骨肉瘤[10]、胰腺癌[11]、骨髓瘤[12]在内多种恶性肿瘤的耐药性都与miRNAs有关[13]。有研究表明miR-17-5p能促进结肠癌的发生和耐药,从而降低癌症患者的生存率[14]。我们前期的研究发现,miR-17-5p在耐受多巴胺受体激动剂治疗的垂体泌乳素腺瘤中呈高表达[15],但其在垂体泌乳素腺瘤耐药中的作用仍不清楚。本研究通过体外建立miR-17-5p过表达和敲减的MMQ细胞模型,探讨miR-17-5p在MMQ细胞耐药性中的作用及机制。
1 材料和方法
1.1 材料 大鼠垂体泌乳素腺瘤细胞MMQ购自美国ATCC细胞库(细胞证书:ATCC-CRL-10609)。CAB购自英国Tocris Bioscience公司(货号:2664/10),CCK-8试剂盒购自日本同仁化学研究所,PTEN(phosphatase and tensin homolog deleted on chromosome ten)单克隆抗体购自美国Cell Signal Technology公司(货号:9188S),GAPDH单克隆抗体购自美国Proteintech公司(货号:10494-1-AP),RevertAid First Strand cDNA Synthesis Kit购自美国Thermo Fisher Scientific公司(货号:K1622),SYBR Premix Ex Taq II购自日本TAKARA公司(货号:RR820A),RNAiso for small RNA购自日本TAKARA公司(货号:9753A),Mir-XTM miRNA First Strand Synthesis Kit购自日本TAKARA公司(货号:638315),miRNA-17 mimic、miRNA-17 inhibitor及阴性对照购自上海吉玛基因公司,PTEN慢病毒载体购自上海吉凯基因技术有限公司。转染试剂Lipofectamine2000购自美国Thermo Fisher Scientific公司,miR-17-5p、U6、PTEN及GAPDH引物购自上海生工生物工程有限公司。
1.2 方法
1.2.1 大鼠垂体泌乳素腺瘤MMQ细胞的培养:使用含有2.5%的胎牛血清、15%的马血清和1%青链霉素混合液的F-12K培养基培养,将MMQ细胞接种于培养瓶后置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。
1.2.2 CCK-8法检测细胞增殖率:调整MMQ细胞密度为6×104/mL,接种于96孔培养板,每孔终体积为100 μL,培养过夜,按照说明书分别加入miR-17-5p mimics、miR-17-5p inhibitor以及阴性对照,作用至不同计划时间点后,加入10 μL CCK-8试剂溶液,在37 ℃、5% CO2、饱和湿度细胞培养箱中孵育2 h后,在酶标仪450 nm波长处检测OD值。细胞增殖率=[(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。
1.2.3 CCK-8法检测细胞对CAB治疗的反应:将转染miR-17-5p mimics、miR-17-5p inhibitor及阴性对照24 h后的细胞株接种于96孔培养板中,细胞浓度为每孔6×103个,按50 μmol/L终浓度加入CAB药物处理,以PBS作为阴性对照,置入细胞培养箱,作用至不同计划时间点后,加入10 μL CCK-8,37 ℃、5% CO2、饱和湿度细胞培养箱孵育2 h后,在酶标仪450 nm波长处检测OD值。
1.2.4 生物信息学分析和荧光素酶报告检测:通过在线预测网站获取miR-17-5p与潜在靶标PTEN的互补结合位点,随后设计相应引物。以人基因组DNA为模板经PCR反应扩增人PTEN基因3’UTR序列,将反应产物与pGEMT载体经连接反应转化扩增后构建野生型pGEMT-PTEN 3’UTR载体(命名为pGEMTPTEN 3’UTR-WT)。随后按照点突变试剂盒说明书进行点突变PCR反应构建突变型pGEMT-PTEN 3’UTR载体(命名为pGEMT-PTEN 3’UTR-MUT)。将pGEMT-PTEN 3’UTR-WT或pGEMT-PTEN 3’UTR-MUT载体和pmirGLO载体分别用限制性核酸内切酶Pme I和Sal I双酶切过夜,随后将得到的纯化的pmirGLO载体和pGEMTPTEN 3’UTR-WT/MUT片段连接转化扩增得到野生型和突变型重组pmirGLO载体。将MMQ细胞接种于24孔细胞培养板,用Lipofectamine 2000试剂将100 nmol/L miR-17-5p mimics或miR-17-5p NC,分别与重组pmirGLO载体共转染MMQ细胞,48 h后采用Dual-Luciferase Reporter Assay System(Promega)检测荧光素酶活性。
1.2.5 Western blot检测:收集细胞后用1 mL PBS洗涤2次后,加入细胞裂解液冰上裂解后吸取上清。总蛋白量采用BCA试剂盒进行检测定量后,取30 μg总蛋白10%聚丙烯酰胺凝胶电泳分离,电转膜至PVDF膜,5%脱脂牛奶封闭1 h后加入PTEN一抗(1∶1 000)4 ℃孵育过夜。次日用TBST缓冲液洗涤PVDF膜,加入二抗室温孵育。最后用ECL试剂发光、显影,并用Image Lab软件进行分析。
1.2.6 RT-qPCR检测:用Trizol法提取细胞总RNA,反转录合成相应cDNA,用RNAiso for small RNA试剂盒和Mir-XTM miRNA First Strand Synthesis Ki试剂盒提取miRNA并反转录合成相应cDNA,随后进行荧光定量PCR,反应体系为20 μL,用GAPDH作为参考,引物序列见表1。

表1 定量PCR相关引物序列
1.3 统计学处理方法 采用SPSS22.0软件进行处理,计量资料用表示,2组间比较用独立样本t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 miR-17-5p促进MMQ细胞增殖 通过转染miR-17-5p mimics提高MMQ细胞中的miR-17-5p表达水平,RT-qPCR结果显示经过转染后的MMQ细胞中miR-17-5p相对表达量提高到原先的6.24倍(1.37±0.12 vs.8.54±0.58,P<0.05),MMQ细胞的增殖率明显高于对照。转染后24 h,实验组细胞较对照组细胞增殖率增加39.39%(174.8%±12.4% vs. 125.4%±13.1%,P<0.05)。通过转染miRNA-17 inhibitor降低MMQ细胞中的miR-17-5p水平,miR-17-5p相对表达量降低62.38%(1.01±0.13 vs. 0.38±0.09,P<0.05)RT-qPCR结果提示MMQ细胞中miR-17-5p表达量显著下降,MMQ细胞的增殖率明显低于对照,转染后24 h,实验组较对照组减少35.09%(112.50±15.25 vs.173.33±14.75,P<0.05)。见图1。这些结果表明miR-17-5p促进MMQ细胞增殖。
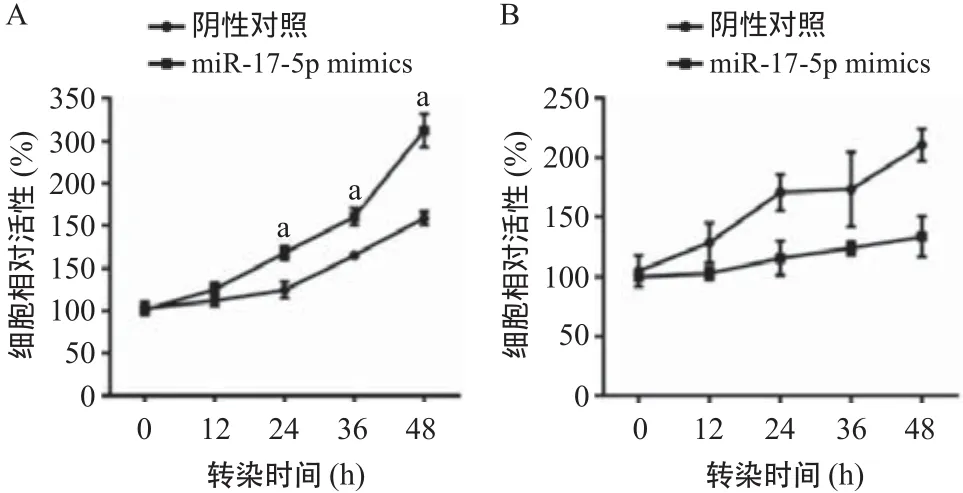
图1 miR-17-5p对MMQ细胞增殖的影响
2.2 miR-17-5p对CAB治疗反应的影响 将转染后的细胞应用CAB药物处理,采用CCK-8法检测细胞存活率。结果发现单纯CAB处理组细胞相对活性为(47.50±1.23)%,miR-17-5p过表达后CAB处理组细胞相对活性为(68.67±3.85)%,其细胞活性较前者提高了44.57%(P<0.05)。miR-17-5p敲减后CAB处理组相对活性为(37.36±1.98)%,单纯CAB处理组细胞相对活性为(48.0±3.7)%,下降了22.17%(P<0.05)。见图2。这些结果表明miR-17-5p能提高MMQ细胞对CAB的耐受性。

图2 miR-17-5p对MMQ细胞CAB耐药性的影响
2.3 miR-17-5p对MMQ细胞PTEN表达的影响 通过生物信息学数据库预测miR-17-5p的靶标基因,发现PTEN基因的3’UTR第276~第282位碱基存在miR-17-5p潜在结合位点(见图3A)。荧光素酶报告提示,相较于阴性对照,PTEN野生型MMQ细胞的荧光素酶活性明显降低,而PTEN突变型MMQ细胞的荧光素酶活性无明显变化(见图3B)。采用Western blot与RT-qPCR检测miR-17-5p转染前后MMQ细胞中PETN的表达,结果显示,与阴性对照相比,miR-17-5p高表达的MMQ细胞中PTEN蛋白和mRNA表达量均明显降低(P<0.05),而miR-17-5p下调后的MMQ细胞中PTEN蛋白和mRNA表达量均明显上升(P<0.05)。见图3C-D。这些结果表明miR-17-5p能抑制MMQ细胞PTEN的表达。

图3 miR-17-5p对PTEN表达的影响
2.4 PTEN表达上调对miR-17-5p过表达的MMQ细胞对CAB治疗反应的影响 用miR-17-5p mimic和PTEN慢病毒载体共转染MMQ细胞。采用Western blot法检测转染效率,结果提示,慢病毒转染后PTEN基因蛋白表达量较对照组升高了249.6%。用CAB处理各组细胞,CCK-8法检测细胞存活率,结果提示CAB+miR-17-5p mimic转染组细胞相对活性为(74.8±1.9)%,CAB+miR-17-5p mimic+PTEN慢病毒载体共转染组相对细胞活性为(57.0±1.8)%,较前降低23.8%,差异均有统计学意义(P<0.05)。见图4。这些结果表明PTEN表达上调能部分逆转miR-17-5p过表达引起的MMQ细胞对CAB的耐药性。
3 讨论
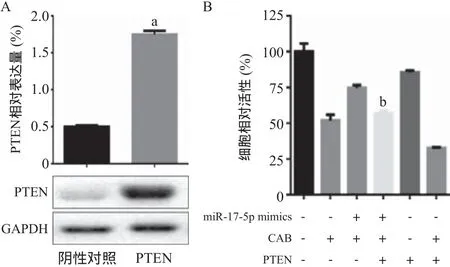
图4 PTEN表达上调对miR-17-5p过表达MMQ细胞CAB耐药性的影响
垂体泌乳素腺瘤是最常见功能性垂体腺瘤,常引起患者性腺机能减退和不育[1-2]。在治疗垂体泌乳素腺瘤的一线药物中,CAB能有效地减小肿瘤体积,抑制泌乳素分泌并能恢复性腺功能[3]。然而有一部分患者在治疗过程中仍然表现出了对CAB的耐药[1,5],如何有效逆转耐药性是临床治疗上面临的一个挑战。miRNA是近年来发现的一类小分子非编码单链RNA,在肿瘤发生发展进程中调控肿瘤相关基因的表达[16],miRNA对多种肿瘤的发生发展都有影响,另有研究证实,miR-17-5p可以通过调控PTEN的表达影响胃癌的化疗敏感性[17]。而我们既往的研究发现miR-17-5p在耐药泌乳素瘤组织中表达显著上升,但其具体作用及调控机制仍不明确[15]。有研究表明miR-17-5p能诱发结肠癌并促进其耐药[14],该过程主要通过抑制PTEN表达,激活PI3K/AKT信号通路来完成[18]。本项研究表明在垂体泌乳素腺瘤细胞中,miR-17-5p可能会通过下调PTEN的表达来促进肿瘤细胞的增殖并提高耐药性。
PTEN基因定位于染色体10q23.3,由9个外显子组成,编码的蛋白质包含403个氨基酸,与肿瘤的发生发展具有密切关系[19]。PTEN蛋白可通过拮抗磷酸化酶的活性抑制肿瘤的生长[20-21],对肿瘤细胞的生长、侵袭、迁移等方面有重要的作用[22]。近年来有关PTEN的研究逐渐增多,有研究表明骨肉瘤中的PTEN基因表达率明显低于正常软骨组织,提示骨肉瘤中的PTEN蛋白表达减少,从而失去了细胞周期的负调节,导致细胞异常增殖,最终引起肿瘤发生。由PTEN编码的蛋白可以抑制骨肉瘤中的PI3K/AKT通路,抑制肿瘤的病理过程[23]。还有研究表明,miR-23a可以抑制骨肉瘤细胞中PTEN的表达从而促进其生长侵袭[24]。另外有研究表明,PTEN的表达异常对胃癌的发生发展起到重要的作用[25]。而我们的研究证实PTEN可能是miR-17-5p的直接作用靶标,在泌乳素瘤中,PTEN的上调可能会促进肿瘤对CAB的药物敏感性。
综上所述,本研究证实miR-17-5p能通过靶向调控PTEN基因的表达,从而促进MMQ细胞增殖,增强其对CAB的耐药性,这为解决泌乳素腺瘤耐药性提供了新的治疗思路。相信随着基因技术的发展,miR-17-5p可以作为评估泌乳素腺瘤耐药性的重要分子生物标志物,并能将针对miR-17-5p的靶向治疗应用于临床。然而本研究尚有一些局限性。首先,miR-17-5p的效果及机制仅在大鼠细胞中进行了研究,在人类泌乳素瘤细胞尚未验证。其次,除了提高MMQ细胞对CAB的耐药性,miR-17-5p可能直接影响到细胞的增殖,因此,这些机制应该进行进一步的研究。

