胆管细胞癌来源的外泌体通过内质网应激破坏血管内皮细胞紧密连接实现转移
郦铮铮,孙洪伟,张楠,苏华芳
(温州医科大学附属第一医院,浙江 温州 325015,1.神经内科;2.肝胆外科;3.放化疗科)
外泌体是一类由多种类型活细胞分泌的,直径为30~100 nm的囊泡小体,含有许多生物活性物质,如蛋白质、mRNA、miRNA、DNA片段等[1-3]。这些生物活性物质可在细胞间相互传递,进而调节细胞的功能。近年来,外泌体在肿瘤微环境中的调控作用受到越来越多的关注。研究发现肿瘤细胞来源的外泌体能够通过促进肿瘤血管新生[4]、诱导肿瘤相关成纤维细胞的分化[5]、参与肿瘤微环境中的免疫调控促进肿瘤的免疫逃逸[6]、塑造未来转移靶器官的微环境以实现自身转移[7]等多种方式,调控肿瘤微环境,进而促进肿瘤的进展。
肿瘤血管生成是肿瘤微环境的重要特征之一,在肿瘤的进展中发挥着关键作用。目前已有很多研究证实,外泌体能通过不同的途径参与肿瘤血管的生成。如来源于人类白血病肿瘤细胞的外泌体传递的miRNA被脐静脉内皮细胞摄取后,可导致肿瘤细胞迁移的增多和血管管腔的形成[8]。另外恶性黑色素瘤细胞来源的外泌体内含有miR-9,其被内皮细胞摄取后可以通过激活JAK-STAT通路来促进血管生成[9]。但有研究提示肿瘤在发展过程中在促进血管新生的同时,也伴随着原有及新生血管的破坏。STRILIC等[10]发现肿瘤细胞通过激活内皮细胞表面的死亡受体6(death receptor 6,DR6)导致血管内皮细胞的凋亡从而发生远处转移,使用RIPK1抑制剂necrostatin-1,或特异性敲除小鼠内皮RIPK3明显抑制肿瘤细胞的这种作用并使转移发生率明显下降。另外具有转移能力的乳腺癌肿瘤外泌体中的miR-105特异性抑制血管内皮细胞间紧密连接蛋白ZO-1表达,进而摧毁血管内皮屏障来促进转移前微环境的形成[11]。肿瘤外泌体是否通过其他的机制破坏血管完整性目前仍不得而知。本研究观察胆管细胞癌来源外泌体对内皮细胞紧密连接蛋白,以及对体内血管通透性的影响,并进一步探讨其可能的机制,为临床防治肿瘤转移提供新的依据。
1 材料和方法
1.1 主要试剂 RPMI 1640培养基及高糖DMEM培养基购自美国Corning公司,ECM培养基购自美国ScienCell公司,胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司,血清替代物购自美国Stembo公司;PKH26、70 kDa FITC标记的右旋糖酐购自美国Sigma公司;ZO-1(21773-1-AP,1∶1 000稀释)、ATF6(66563-1-Ig,1∶1 000稀释)抗体购自美国Proteintech公司,CD9(1∶1 000稀释)、CLDN5(ab15106,1∶1 000稀释)、eIF2α(ab169528,1∶1 000稀释)、磷酸化eIF2α(ab32157,1∶1 000稀释)抗体购自美国Abcam公司,PERK(5683,1∶1 000稀释)、IRE-1α(3294,1∶1 000稀释)购自美国CST公司,Alix(sc-49268,1∶1 000稀释)、CD81(sc-7637,1∶1 000稀释)、β-actin(sc-69879,1∶4 000稀释)购自美国Santa Cruz公司;5×PrimerScript RT Master Mix,SYBR Green PCR试剂盒购自日本Takara公司。
1.2 外泌体分离和鉴定 人胆管细胞癌细胞系CCLP和人胆管上皮细胞系HIBEC接种于10 cm皿中,分别使用含10% Stembo血清替代物的RPMI 1640培养基及高糖DMEM培养基培养48 h后收集上清,300×g离心10 min,2 000×g离心10 min,10 000×g离心30 min去除所有的细胞及细胞碎片。随后上清在10 kDa分子截流中空纤维膜浓缩管中以2 500×g浓缩10 min。上述上清于0.22 μm滤器过滤除菌后以110 000×g超速离心70 min,PBS洗涤1次并再次以110 000×g超速离心70 min。BCA法检测蛋白浓度,Nanosight检测外泌体粒径分布,透射电镜鉴定外泌体形态,蛋白电泳检测Alix、CD9、CD81的表达。为检测内皮细胞内吞外泌体,使用PKH26对外泌体进行染色,细胞内吞12 h后固定,鬼笔环肽细胞骨架染色并于激光共聚焦显微镜下观察并摄片。
1.3 脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)分离、分组及处理 收集2017年11月至2017年12月温州医科大学附属第一医院产科弃用的健康新生儿脐带3例(已通过本院伦理委员会审查,所有产妇均充分知情并签署知情同意书)。PBS冲洗残留血液,1 mg/mL I型胶原酶37 ℃消化脐静脉内腔30 min,随后予含10% FBS的M199终止反应。收集消化液400×g离心5 min,PBS清洗1次并予含10% FBS的ECM重悬,接种于T25培养瓶中。24 h后更换全部培养基。所有实验均使用第3~第6代HUVEC。HUVEC分为PBS、exoHIBEC及exoCCLP3组,分别使用PBS、5 μg/mL HIBEC外泌体(exoHIBEC)和5 μg/mL CCLP外泌体(exoCCLP)处理48 h并进行相关检测。
1.4 内皮细胞层通透性检测 HUVEC铺被于0.4 μm孔径transwell的上室中并充分生长至融合,同时予PBS、5 μg/mL exoHIBEC及5 μg/mL exoCCLP处理48 h。随后于上室中加入10 mg/mL 70 kDa FITC标记的右旋糖酐,分别于10 min、30 min及60 min吸出下室中的培养基50 μL,并于多功能酶标仪中检测OD值(488 nm激发波长,520 nm发射波长)。
1.5 免疫荧光 细胞铺被于载玻片上予PBS、5 μg/mL exoHIBEC或5 μg/mL exoCCLP处理并生长至融合,予预冷丙酮固定10 min,PBS洗3次,5% BSA封闭15 min,一抗4 ℃孵育过夜(ZO-1,21773-1-AP,1∶100稀释;CLDN5,ab15106,1∶100稀释)。Alexa Fluor®488荧光二抗(1∶400稀释)室温避光孵育1 h,DAPI(1∶5 000稀释)染核并予荧光抗淬灭剂封片,激光共聚焦显微镜观察并摄片。
1.6 Western blot检测 经外泌体处理后的细胞予PBS洗1次,冰上RIPA裂解30 min。裂解液4 ℃12 000×g离心15 min收集上清。予BCA定量蛋白浓度。取20 μg蛋白样品上样,SDS-PAGE电泳及转膜。5%脱脂奶粉封闭1 h。一抗(稀释度参照前述)4 ℃孵育过夜。PBST洗膜3次,二抗(1∶5 000稀释)室温孵育1 h,BioRad凝胶成像系统曝光。
1.7 实时定量PCR检测 经外泌体处理后的细胞予TRIzol裂解提取总RNA,分光光度计检测RNA浓度。取1 μg总RNA使用5×PrimerScript RT Master Mix反转录试剂盒反转录成cDNA,进一步使用SYBR Green PCR试剂盒进行实时荧光定量PCR。引物序列参照表1,以GAPDH作为测定内参。
1.8 动物模型建立与处理 实验选择雄性BALB/c裸鼠(6~8周),实验动物许可证号SCXK(苏)2015-0001。实验动物随机分为PBS组、exoHIBEC组、exoCCLP组,上述动物每周3次尾静脉注射PBS、20 μg exoHIBEC或20 μg exoCCLP。血管渗漏模型:上述裸鼠注射4周PBS或相应外泌体后予尾静脉注射100 mg/kg 70 kDa FITC标记的右旋糖酐并在1 h后处死小鼠,收集裸鼠肝脏及肺组织,予OCT包埋并制作冰冻切片。荧光显微镜观察肝脏及肺组织切片中的右旋糖酐渗出情况。肿瘤转移模型:上述裸鼠注射1周PBS或外泌体后尾静脉注射5×106CCLP细胞。此后继续上述处理方式至4周。裸鼠处死后收集肺组织,予制作石蜡切片并予HE染色。光镜下观察并计数肺部转移瘤数量。
1.9 统计学处理方法 采用GraphPad Prism 6.0统计学软件对数据进行分析。计量资料用表示,多组间比较采用单因素方差分析,两两比较用Dunnett’s检验。P<0.05为差异有统计学意义。

表1 PCR引物序列
2 结果
2.1 CCLP外泌体的鉴定结果 应用经典的超速离心法从CCLP细胞上清中提取到的物质行粒径分析,结果显示其粒径分布集中在170 nm左右(见图1A)。电镜结果提示具有典型的“杯口”样形态(见图1B)。Western blot结果提示获得的沉淀表达CD9、CD81及Alix(见图1C)。通过PKH26染色使外泌体膜成分着红色荧光,并予HUVEC内吞12 h。激光共聚焦显微镜提示HUVEC能够内吞外泌体(见图1D)。以上结果表明通过超速离心法提取的物质的确为外泌体,并且外泌体能够被HUVEC摄取。
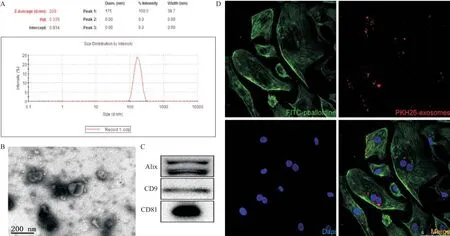
图1 外泌体鉴定和HUVEC对外泌体的内吞作用
2.2 CCLP外泌体破坏血管内皮细胞的紧密连接与PBS组比,exoCCLP明显抑制HUVEC紧密连接蛋白ZO-1及CLDN5的表达(P<0.05)(见图2A-B)。免疫荧光提示经exoCCLP处理后的HUVEC其ZO-1失去完整性,在细胞连接处呈现点状分布,而CLDN5在内皮细胞中仅呈片状表达。PBS及exoHIBEC不影响HUVEC ZO-1及CLDN5表达(见图2C)。内皮细胞通透性实验提示经exoCCLP作用后,上室中FITC标记的右旋糖酐渗漏入下室较PBS及exoHIBEC处理组明显增多(P<0.05)(见图2D-E),提示exoCCLP使HUVEC单细胞层的通透性明显增加。以上结果表明CCLP来源的外泌体能够抑制内皮细胞紧密连接蛋白的表达,增加血管的通透性。
2.3 CCLP外泌体在体内增加血管通透性 与PBS及exoHIBEC相比,尾静脉注射exoCCLP4周后明显增加裸鼠肺部(见图3A)及肝脏(见图3B)内的FITC-右旋糖酐的渗出。另外在持续接受PBS、exoHIBEC、exoCCLP尾静脉注射的裸鼠中注射CCLP细胞,肺组织切片HE染色提示exoCCLP处理组肿瘤灶数量明显增多(见图3C)。以上结果表明CCLP在体内能够增加血管的通透性并促进肿瘤的转移。
2.4 CCLP外泌体引起血管内皮细胞内质网应激导致内皮细胞紧密连接蛋白下降 HUVEC经exoCCLP作用不同时间段后Western blot及PCR检测内质网应激相关指标。与PBS及exoHIBEC相比,exoCCLP提高HUVEC内质网应激相关基因如XBP1、ATF6、PPP1R15A等(见图4A),增加内质网应激相关蛋白如IRE1α、ATF4的表达,并促进PERK及其下游eIF2α的磷酸化(见图4B)。通过小干扰RNA分别下调HUVEC ATF6、IRE1α或PERK后再加入exoCCLP作用48 h,Western blot检测紧密连接蛋白。结果提示PERK及IRE1α敲减能够改善exoCCLP对内皮细胞紧密连接蛋白的下调作用(见图4C)。这些结果表明CCLP来源的外泌体能够通过引起内皮细胞发生内质网应激导致紧密连接蛋白下调。

图2 CCLP外泌体体外破坏血管内皮细胞层紧密连接并增加其通透性
3 讨论
肿瘤血管生成是肿瘤微环境一个重要的特征,在肿瘤的进展中发挥着关键作用。目前已有很多研究证实,外泌体能通过不同的途径参与肿瘤血管的生成[12-14]。但最近的研究显示肿瘤在发展过程中在促进血管新生的同时,也伴随着原有及新生血管的破坏[10-11,15-16]。紧密连接蛋白直接调控着内皮细胞与上皮细胞的通透性。而脱落的肿瘤发生转移的重要一步就是与内皮层相互作用并穿透内皮屏障[17]。因此紧密连接蛋白成为肿瘤发生转移前必须攻克的第一道屏障。我们的研究结果表明胆管细胞癌来源的外泌体能够下调内皮细胞ZO-1、CLDN5的蛋白水平。因此证明该肿瘤来源的外泌体能够破坏血管屏障功能,增加血管的通透性。
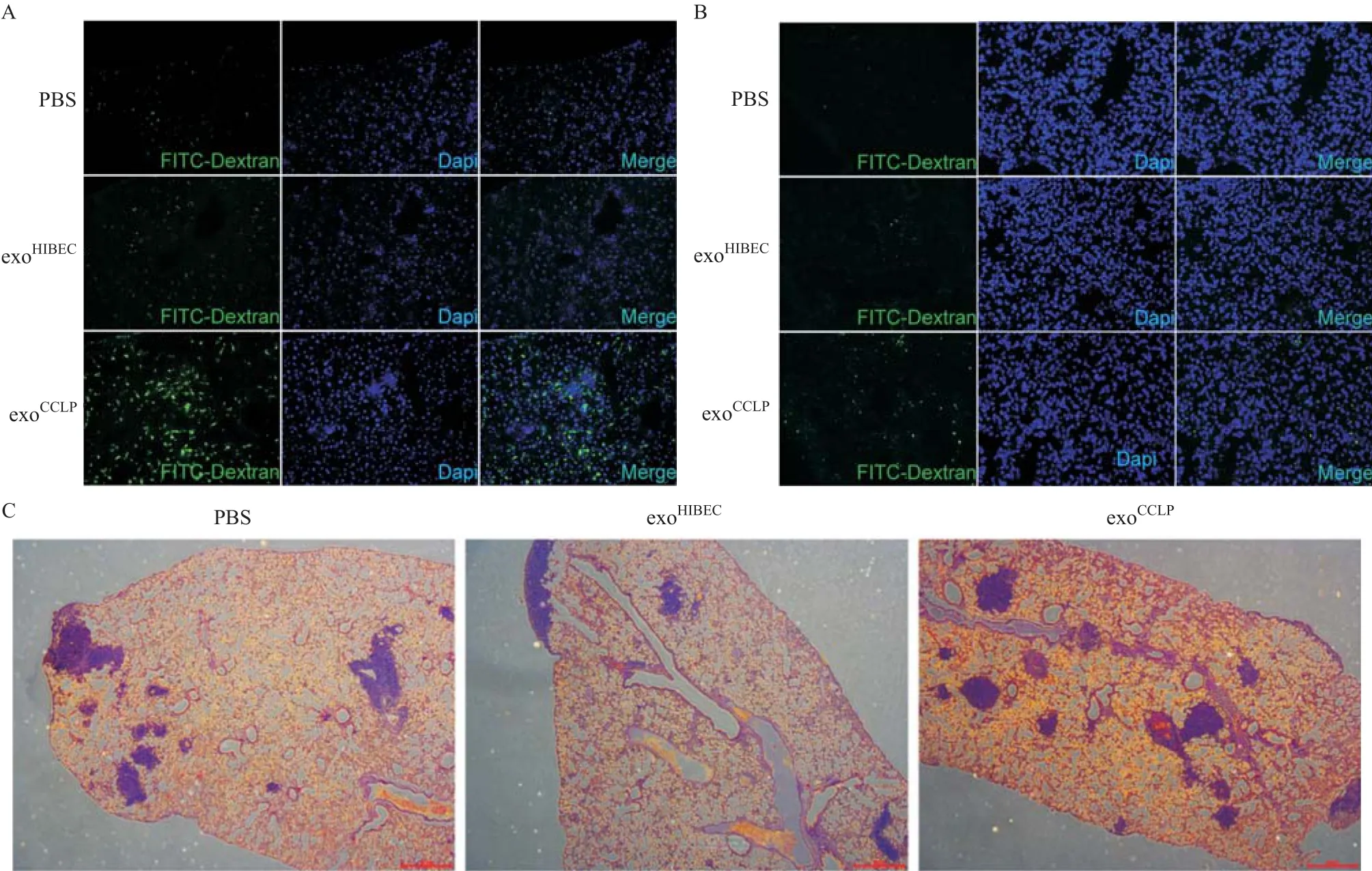
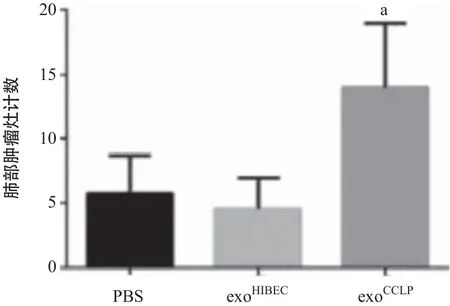
图3 CCLP外泌体在体内增加血管通透性并促进肿瘤转移
未折叠蛋白反应(unfolded protein response,UPR)信号通路由3种定位于内质网上的跨膜蛋白IRE1、PERK和ATF6所始动[18]。通常情况下这3种内质网应激的感受器通过与免疫球蛋白重链结合蛋白(BiP/GRP78)结合而处于非激活状态。当内质网腔内的未折叠蛋白堆积时,BiP脱落并进一步活化未折叠蛋白信号通路。这种适应性的细胞反应通过磷酸化eIF2α下调细胞蛋白合成水平,并通过转录活化XBP-1及ATF6增强内质网的蛋白折叠能力及异常折叠蛋白降解能力,恢复细胞内蛋白折叠的稳态[19-21]。我们的实验观察到HUVEC经exoCCLP处理后PERK、eIF2α磷酸化增强,总IRE1α、ATF4表达增加,其下游拼接型态XBP1 mRNA水平增加,我们也观察到多种内质网相关的基因如DDIT3、PPP1R15A增加,提示exoCCLP引起HUVEC的内质网应激反应。
内质网应激增加PERK激酶的活性,引起eIF2α磷酸化,从而导致翻译停滞及活化下游信号通路,引起全面性细胞蛋白合成和增殖停滞[22]。在本研究中我们发现内皮细胞的紧密连接蛋白ZO-1及CLDN5明显下调。通过小干扰RNA敲减HUVEC的ATF6、PERK或者IRE1α水平,我们发现HUVEC细胞PERK或者IRE1α水平下调能够逆转exoCCLP引起的紧密连接蛋白表达抑制,而敲减ATF6并无此作用。上述结果提示:①exoCCLP通过内质网应激引起内皮细胞紧密连接蛋白下调;②在内质网应激3条通路中,exoCCLP主要通过PERK和IRE1α通路引起紧密连接蛋白下调。
最新的研究发现,在胰腺癌中存在持续内质网应激反应,但缺乏IRE1α的激活并缺乏其下游拼接型XBP1,导致胰腺癌细胞的免疫抵抗及转移[23]。因此其他肿瘤细胞中无法缓解的内质网应激可能是普遍存在的。我们推测未折叠蛋白在肿瘤细胞内堆积,无法通过未折叠蛋白反应清除,因此可能经过外泌体包装被分泌到周边细胞中,引起周边正常细胞的内质网应激反应。另外,研究显示哺乳动物细胞中存在另一种非常规的内质网应激激活方式:细胞内异常饱和度的脂质双分子层能够通过激活PERK及IRE1α的跨膜段而非内质网腔内段引起内质网应激[24]。而外泌体是一类由脂质双分子层包裹的囊泡小体,在肿瘤包装和分泌的过程中可能破坏其脂质饱和度,引起受体细胞的PERK及IRE1α的跨膜段激活而诱发内质网应激。但上述推测需要研究进一步证实。
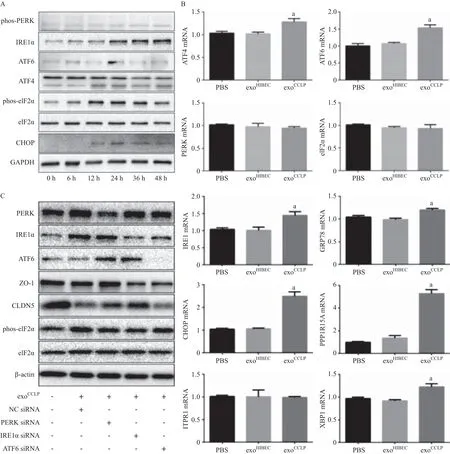
图4 CCLP外泌体激活内皮细胞内质网应激通路
综上所述,胆管细胞癌来源的外泌体能够通过引起内皮细胞内质网应激抑制紧密连接蛋白表达,破坏血管内皮屏障的完整性从而利于转移的发生。

