肝脏外伤与肝脏病变继发出血的介入治疗价值*
刘书林,徐浩铜
成都医学院第一附属医院 放射科(成都610500)
肝破裂出血并不少见,其主要原因包括肝癌、肝脏外伤及肝血管畸形等。肝癌居我国恶性肿瘤死亡率第2位,近年发病率上升较快[1],其自发性破裂是严重并发症,致死率极高。外伤性肝破裂占腹部损伤的15%~20%[2],肝破裂出血采用外科手术治疗,并发症及病死率均较高,分别约为38%、8%~14%[3]。研究[4]普遍认为动脉栓塞术(transcatheter arterial embolization,TAE)治疗肝破裂出血具有显效快、成功率高、并发症少等优点。因此,本研究通过回顾性研究,分析介入栓塞治疗不同原因所致肝破裂出血患者的相关情况,评价TAE治疗肝破裂出血的疗效及不良反应发生情况。
1 资料与方法
1.1 临床资料
选取2008至2016年于成都医学院第一附属医院行TAE治疗肝破裂出血的28例患者作为试验组,纳入标准:1)血流动力学稳定或经积极抗休克、输血、输液后血流动力学稳定患者;2)经影像学检查诊断为肝脏病变或肝脏肿瘤出血者;3)患者或家属自愿签署知情同意书。 排除标准:1) 经积极抗休克、输血、输液后血流动力学仍不稳定患者;2)腹部其他脏器严重损伤需开腹者,如空腔脏器损伤;3)肝静脉或肝后下腔静脉损伤,引起腹腔大量积血者。试验组患者中,女11例,男17例;年龄28~75(51.69±26.16)岁;肝癌破裂出血21例,肝外伤破裂出血4例,特发性肝动静脉畸形出血3例。临床症状及体征:所有患者均有不同程度腹部疼痛,呈急性病容,腹腔穿刺抽出不凝血,血压下降,9例表现为休克。28例患者TAE术前均行CT平扫,显示为肝内低密度结节或肿块或伴腹腔积液。
随机选取同期采用外科手术治疗肝出血的21例患者作为对照组,纳入标准:1) 血流动力学稳定或经积极抗休克、输血、输液后血流动力学稳定者;2)经影像学检查诊断为肝脏病变或肝脏肿瘤出血者;3)患者及家属自愿签署知情同意书。排除标准:1)合并心肺功能障碍、肾功能障碍;2)合并造血系统疾病、活动性肝病、其他恶性肿瘤、神经系统疾病与精神性疾病者。对照组患者中,女7例,男14例;年龄22~70(55.37±18.25)岁;肝癌患者16例,10 例肿瘤位于右肝,6 例肿瘤位于左肝;肝外伤性出血患者5例。
1.2 治疗方法
1.2.1 试验组 试验组患者采用改良Seldinger技术穿刺右侧股动脉,经导管鞘送入4F-RH导管或Cobra导管行腹腔干DSA检查。肝癌破裂不合并动-静脉分流者行供血动脉碘化油栓塞,血流变缓后再用明胶海绵栓塞;合并动-静脉分流者先行肿瘤供血动脉分支碘化油栓塞,再用明胶海绵颗粒栓塞瘘口。外伤性肝破裂者经造影证实动脉破裂后,行出血动脉弹簧圈和明胶海绵栓塞。血管畸形者造影证实病变后,于病变血管内注入300~500 μm PVA颗粒,再用明胶海绵栓塞供血动脉。
1.2.2 对照组 对照组患者均行外科手术治疗,10 例肿瘤位于右肝者行右肝部分切除;6 例肿瘤位于左肝者行左肝部分切除。肝外伤5例:单纯缝合术2例;肝部分切除术2例;肝切开清创、选择性血管结扎、大网膜填塞缝合术1例。显效13例,愈后良好5例,疗效较差3例。
1.3 评价标准与指标
1.3.1 疗效判断标准 1)愈后良好:生命体征、肝功能恢复正常,无胆漏、腹腔感染、腹腔继发出血等并发症。肝脏影像学检查:肝血管畸形及外伤出血完全恢复正常;肝肿瘤血管栓塞完全,无再出血。 2) 显效: 生命体征及肝功能、肝脏影像学检查较之前明显好转,无严重并发症发生。3) 无效:治疗前后症状体征、肝脏影像学及实验室检查均无明显改善,或治疗后患者死亡。
1.3.2 观察指标 记录试验组和对照组患者的手术时间、住院时间及术后并发症发生情况。
1.4 统计学方法
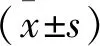
2 结果
2.1 试验组患者介入治疗结果
2.1.1 肝癌患者DSA结果及TAE止血情况 21例肝癌患者中, 巨块型14例、结节型5例、弥漫性2例。DSA可见肿瘤血管,供血动脉增粗,肿瘤染色;8例见活动出血。行TAE后(图1),20例患者成功止血(表1);1例肝顶部巨块型肝癌患者于4 d后再次出血,DSA后发现右膈下动脉参与供血,予以栓塞后出血停止。7例患者再行多次肝动脉灌注与栓塞术;4例行外科切除术;1例弥漫性肝癌患者3周后死亡。
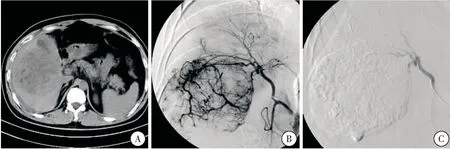
图1 巨块型肝癌 注:A:CT平扫示肝右叶低密度肿块,腹腔积血(液);B:DSA造影示肝动脉增粗,血管丰富;C:栓塞治疗后肿瘤血管未再显像

组别nCT显示腹腔积血(液)DSA显示出血阳性阴性阳性阴性栓塞材料成功止血肝癌21165813碘化油+明胶海绵20外伤44040明胶海绵+弹簧圈4血管畸形31203PVA+明胶海绵3
2.1.2 肝外伤患者DSA结果及TAE止血情况 4例肝外伤患者中,3例DSA显示肝右叶呈浓淡不均片絮状影(图2),对比剂外渗较局限,用明胶海绵颗粒栓塞;1例显示肝右动脉分支受压,对比剂外溢,并见假性动脉瘤,用3 mm弹簧圈(2枚)、明胶海绵颗粒栓塞出血动脉(表1)。TAE后患者血压、脉搏趋于稳定,无严重并发症发生。
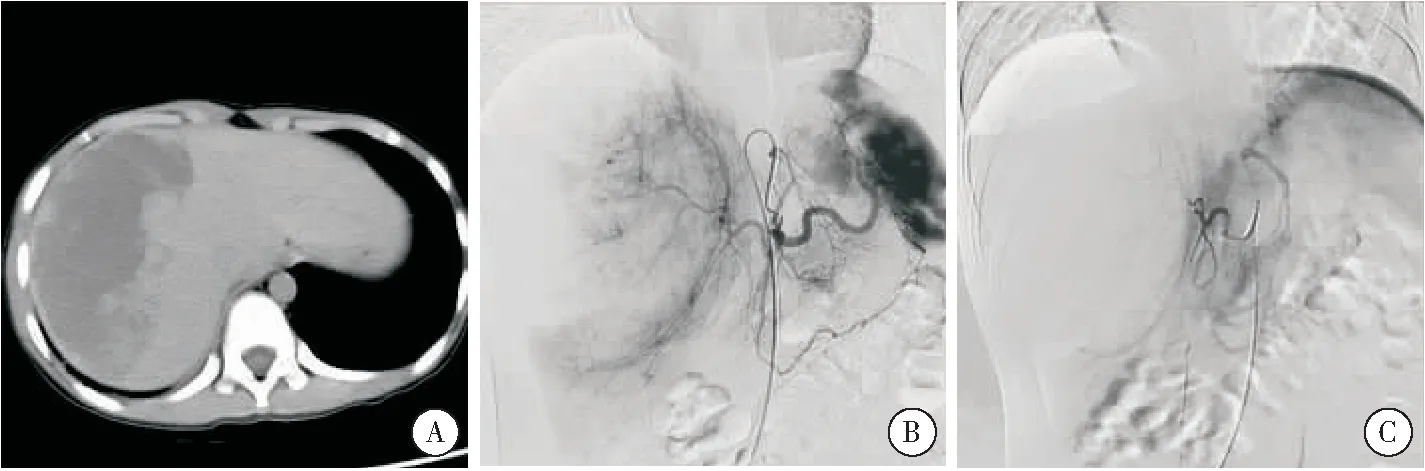
图2 肝脏外伤 注:A:肝右叶大片低密度影;B:DSA见肝右叶浓淡不均片絮状影,造影剂外溢;C:栓塞后责任动脉未见显示
2.1.3 肝血管畸形患者DSA结果及TAE止血情况 1例肝动脉畸形位于肝左叶,显示肝左动脉增粗、扭曲,行300 μm PVA颗粒、明胶海绵颗粒栓塞(图3)。2例肝动静脉畸形均位于肝右叶,显示肝右动脉增粗、门静脉早显,行500 μm PVA颗粒瘘口栓塞,明胶海绵颗粒供养动脉栓塞(图4)。3例患者TAE后均未见严重并发症发生,平均随访13月均无复发。

图3肝左动脉畸形
注:A:肝左动脉扭曲、增粗;B: PVA颗粒及明胶海绵颗粒栓塞后,畸形血管未见显示;C:术后5个月CT增强示左外叶低密度结节,周围未见畸形血管
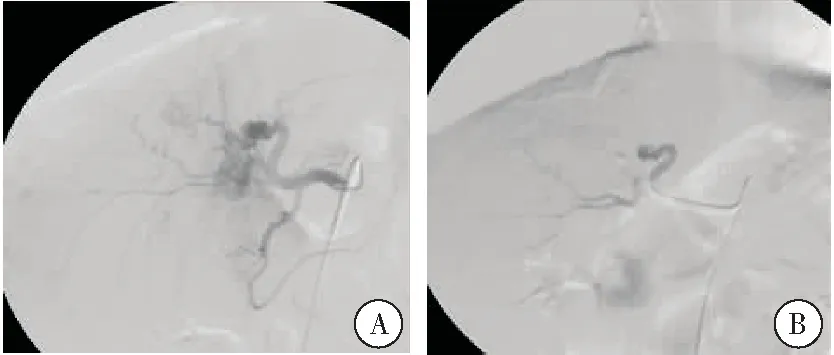
图4肝动-静脉畸形
注:A: DSA造影显示肝动脉增粗,门静脉早显,见畸形血管团;B:行PVA及明胶海绵颗粒栓塞后,畸形血管团及供养动脉闭塞
2.2 试验组与对照组患者治疗情况比较
对照组:肝癌16例,10 例肿瘤位于右肝, 6 例肿瘤位于左肝;肝外伤5例,单纯缝合术2例,肝部分切除术2例,肝切开清创、选择性血管结扎、大网膜填塞缝合术1例。其中愈合良好5例,显效13例,疗效较差3例。
试验组患者愈合良好情况明显优于对照组,差异有统计学意义(P<0.05);试验组患者中,手术时间和住院时间均明显低于对照组,两组比较,差异有统计学意义(P<0.05) ; 试验组患者并发症发生情况较对照组低,两组间比较,差异有统计学意义(P<0.05) (表2)。
表2 试验组和对照组患者治疗情况比较
注:与试验组比较,*P<0.05
3 讨论
肝癌破裂出血与肿瘤生长部位、生长速度、肿瘤坏死致瘤内压增高、凝血功能障碍、肿瘤血管受侵等因素有关。研究[5-7]指出,肝癌破裂出血相关独立危险因素包括:APTT、HBeAg、肿瘤突出肝脏表面;肝硬化程度、血液白细胞数>10×109/L、谷草转氨酶升高、肝硬化、门脉高压、肿瘤直径>5 cm、门静脉癌栓等。肝癌破裂出血既往首选的治疗方法为外科手术,但其存在手术时间长、术中失血量大和临床疗效欠佳的缺点。因此,随着介入治疗技术的进步和推广,目前TAE已成为肝癌破裂出血的主要治疗手段[8]。本研究试验组21例肝癌患者中20例止血成功,成功率约95%,与黄祥忠等[9]研究结果相仿。1例肝顶部巨块型肝癌患者4 d后再次出血,行DSA显示系右膈下动脉参与供血所致,栓塞后止血成功,提示肿瘤多动脉供血现象需引起重视,有必要先行猪尾导管降主动脉造影了解肿瘤供血动脉变异等情况[10-11]。
本研究试验组4例肝外伤出血患者的DSA表现较典型[12],所用的明胶海绵、钢圈栓塞材料与赵永昌等[13]研究报告一致,全部有效止血,提示该技术能有效控制肝外伤活动性出血,具有创伤小、恢复快等优点,具有较大临床应用价值。
肝动静脉畸形较少见,可分为特发性和继发性畸形。陈斌等[14]报道了1例肝动静脉畸形弹簧圈栓塞病例,短期随访复发,因此笔者主张用Onyx胶栓塞畸形血管。本研究试验组3例肝血管畸形患者,用PVA颗粒和弹簧钢圈联合栓塞治疗后,随访疗效较好,与研究[15]报道相仿。
肝动脉TAE术后并发症包括假性动脉瘤、肾功能衰竭和栓塞综合征等。研究[16]认为,TAE术后假性动脉瘤与明胶海绵栓塞剂有关,建议使用弹簧圈。本研究试验组21例肝癌患者均行碘化油栓塞后明胶海绵颗粒肝动脉主干栓塞,以期利用碘化油栓塞肿瘤血管治疗肿瘤,而明胶海绵则可延缓碘化油的清除。3例肝外伤出血患者采用的栓塞剂为明胶海绵和弹簧圈,1例单纯采用明胶海绵颗粒,随访均未发现动脉瘤形成。至于TAE术后肾功能衰竭,主因为失血导致肾脏低灌注及对比剂的肾毒性。本研究采用TAE,未行化疗,也是为了避免药物对肝肾功能的进一步损害。当然,TAE治疗肝破裂出血不良反应的发生率与破裂程度有关[17],在肝外伤出血治疗时需予以考虑。
综上所述,肝外伤破裂与肝脏病变继发出血患者,采用TAE治疗后大多可及时止血,可为部分肝癌患者赢得后续进一步治疗的机会。针对不同原因导致的肝破裂出血,快速、准确找到供血动脉,选择合适的栓塞剂,是成功止血的关键。