PI3Kγ抑制剂AS605240抗小鼠乳腺癌实验研究*
金 科,朱剑梅,赵 丹
四川省医学科学院·四川省人民医院东院 肿瘤科(成都 610072)
乳腺癌是女性常见的恶性肿瘤之一,当前在我国的发病率呈现逐年上升趋势,发病年龄亦趋年轻化[1]。乳腺癌是一种具备局部病理特征的全身性疾病,其发病机制十分复杂,病因涉及细胞代谢、转录、翻译、细胞凋亡、细胞周期调控等多种重要细胞生物学过程[2-4]。磷脂酰肌醇3-激酶(phosphoinostide 3'-kinase,PI3K)是一种细胞内磷脂酰肌醇激酶,同时拥有磷脂酰肌激酶和丝氨酸/苏氨酸(Ser/Thr)激酶活性,是多种细胞信号通路的关键转导激酶,尤其是B 细胞受体(B-cell receptor,BCR)信号,是导致乳腺癌发病的关键信号通路[5-7]。PI3Kγ在B细胞的生存分化以及功能维持方面扮演重要角色,AS605240为PI3Kγ的高度选择性抑制剂,在多种肿瘤中被证实可促进肿瘤细胞凋亡[8-9],但在乳腺癌中的研究还有待深入分析。本研究通过建立乳腺癌小鼠模型,探讨PI3Kγ抑制剂AS605240抗小鼠乳腺癌的效果与相关机制,现报道如下。
1 材料与方法
1.1 动物模型与研究材料
30只BALC小鼠购自四川医学科学院动物研究所,小鼠周龄为3~4周,体重为15~20 g,在SPF二级动物饲养室饲养;小鼠毛色均匀,反应良好,性情温和,无脱毛、断尾现象(动物合格证号:20128903A)。4T1小鼠乳腺癌细胞株为本实验室保存,用RPMI 1640培养基培养,乳腺癌细胞呈ER表达阳性并HER2表达阴性。PI3Kγ选择性抑制剂CAL-101为美国Selleck公司产品,MTT试剂盒购自美国Sigma公司,一抗兔抗人ERK1/2、p-ERK1/2单克隆抗体购自美国Cell Signaling Technology公司,胎牛血清为中国医学科学院血研所生产,TUNEL试剂盒购自Roche公司。
1.2 动物模型建立与分组
取对数生长期4T1乳腺癌细胞4×109/ mL,接种于1只BALC小鼠右侧腹部,将50 μL 4T1乳腺癌细胞从皮下均匀接种到各只小鼠体内,每两周接种1次,待肿瘤生成停止接种,待肿瘤体长约5.0 mm3时,将符合实验要求的小鼠随机分为对照组、空载组与AS605240组各10只,对小鼠进行干预治疗。对照组口服与AS605240组等体积DMSO;空载组口服Ad-vector、DMSO溶液各10 μL;AS605240组口服AS605240溶液10 μL。各组小鼠的干预治疗实验都采用原位多点口服形式进行,治疗频率为1次/3 d,治疗观察4周。
1.3 观察指标
1)肿瘤体积测定:对每组各10只肿瘤小鼠进行干预治疗后,每3 d对肿瘤大小进行测量,即采用游标卡尺测量肿瘤的宽径(b)和长径(a),并计算肿瘤体积V=(ab2)/2。2)蛋白杂交:每组各10只小鼠实验结束后拉颈处死,将肿瘤组织取出,裂解液处理组织,待组织充分裂解,将裂解后的混合物高速离心,获取上清总蛋白。通过BCA试剂盒测量总蛋白浓度。取20~30 μg总蛋白进行蛋白质印迹实验,先进行SDS-PAGE电泳,接着通过电转方法将蛋白从PAGE胶转移至PVDF 膜,接着进行封闭-一抗-洗膜-二抗-洗膜过程,ECL发光法显色,将所得的蛋白条带图像用Image J灰度分析软件对其灰度值进行分析,然后以PCNA、cyclin D1、Caspase-3 蛋白条带的灰度值作为分子,β-actin 蛋白条带的灰度值作为分母,用两者比值表示PCNA、cyclin D1、Caspase-3的相对表达量。选择的抗体都为抗-PCNA、抗-CyclinD1、抗-Caspase-3。3)凋亡检测:采用原位末端标记(TUNEL)法测定每组各10只小鼠肿瘤组织细胞凋亡情况,根据TUNEL试剂盒说明书开展实验,并采用荧光显微镜下观察实验后结果,显微镜下的绿色荧光区域为凋亡细胞。4)巨噬细胞吞噬功能实验:实验前3 h每组中各选取2只小鼠腹腔注射6%无菌淀粉液1 mL;实验中腹腔注射鸡红细胞1 mL,30 min后将小鼠拉颈处死,打开腹腔,取腹腔液,滴1滴0.03%冷亚甲蓝溶液,进行镜下观察。
1.4 统计学方法
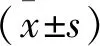
2 结果
2.1 肿瘤体积对比
治疗后各组BALC小鼠均未死亡,AS605240组肿瘤体积为(378.41±56.11)mm3,小于空载组(2 533.42±123.33)mm3和对照组(2 440.42±186.48)mm3,差异有统计学意义(F=837.948,P<0.001)。空载组和对照组之间,肿瘤体积差异无统计学意义 (P>0.05)。相对于对照组与空载组,AS605240组可观察到巨噬细胞吞噬鸡红细胞的现象,且可看到部分鸡红细胞聚集到吞噬细胞附近。
2.2 肿瘤组织细胞凋亡对比
经过检测,治疗后AS605240组(图1C)的细胞凋亡指数为(22.81±3.12)%,高于空载组(图1A)与对照组(图1B)的(3.79±1.33)%和(3.29±1.92)% ,差异有统计学意义(F=244.587,P<0.001)。空载组和对照组之间,细胞凋亡指数差异无统计学意义 (P>0.05)。
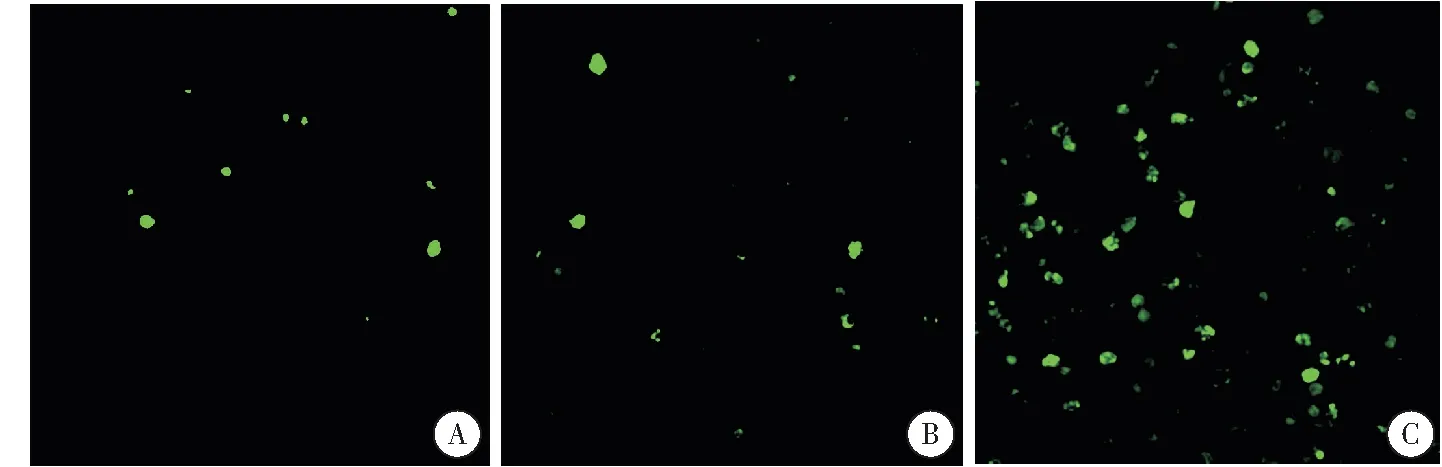
图13组肿瘤细胞凋亡染色分析
注:A:空载组;B:对照组;C:AS605240组
2.3 蛋白质印迹结果对比
经过蛋白质印迹检测,与空载组、对照组对比,治疗后AS605240组肿瘤组织标本的PCNA、CyclinD1、Caspase-3蛋白表达量降低,差异有统计学意义(P<0.05)。空载组和对照组之间,蛋白表达量差异无统计学意义(P>0.05)(图2、表1)。
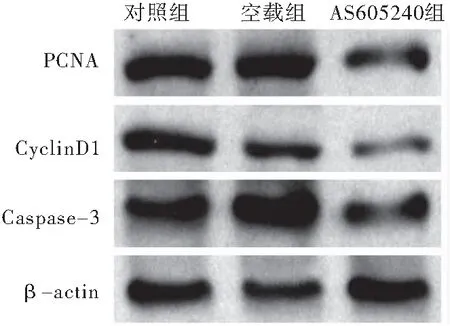
图2 3组肿瘤组织的PCNA、CyclinD1、Caspase-3蛋白质印迹分析
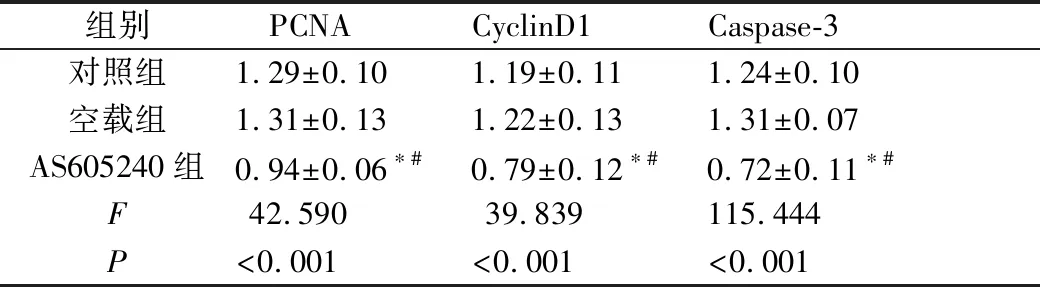
组别 PCNACyclinD1Caspase-3对照组1.29±0.101.19±0.111.24±0.10空载组1.31±0.131.22±0.131.31±0.07AS605240组0.94±0.06∗#0.79±0.12∗#0.72±0.11∗#F42.59039.839115.444P<0.001<0.001<0.001
注:与对照组比较,*P<0.05;与空载组比较,#P<0.05
3 讨论
乳腺癌是女性的常见肿瘤,容易发生侵袭、转移,当前乳腺癌患者的治疗方法普遍为手术治疗与药物治疗相结合的综合疗法,这种疗法显著提高了乳腺癌患者的生存率[10]。然而部分乳腺癌接受综合治疗后,进展甚微,常常因耐药引发死亡,因此有必要进一步研究乳腺癌治疗机制,为治疗提供更有效的策略[11]。作为乳腺癌综合治疗的重要组成部分,当前生物靶向治疗得到了广泛应用,其主要是通过抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡和逆转肿瘤细胞耐药性改善患者预后[12-13]。
根据激酶底物、结构以及调节亚基可将PI3K划分为PI3Kα、PI3Kβ和PI3Kγ 3种[14]。磷脂酰肌醇3-激酶(phosphoinostide 3'-kinase,PI3K)拥有磷脂酰肌激酶和丝氨酸/苏氨酸(Ser/Thr)激酶活性,是多种细胞信号通路的关键转导激酶,可调节细胞生存、分化和凋亡,在乳腺癌的形成与发展中发挥重要作用[15]。P13K抑制剂可避免由于抑制mTOR而产生Akt的反馈性激活,PI3Kγ抑制剂AS605240抑制效果显著,其作用原理是可共价结合P13K的活性位点-833位点赖氨酸,使该氨基酸发生不可修饰,丧失功能活性[16]。且PI3K小分子抑制剂有更好的化学稳定性,能显著控制肿瘤诱发的血管生成和肿瘤生长[17]。迄今为止,关于PI3Kγ抑制剂AS605240对乳腺癌的作用及其机制的研究甚少。细胞学研究[18]表明,PI3K抑制剂能抑制肿瘤细胞的增殖,诱导其凋亡,抑制其向基质细胞迁移,特别是该类抑制剂还可共同抑制ERK通路,是诱导癌细胞凋亡的一种重要机制。另外,单核巨噬细胞系统具有直接吞噬和杀伤病原体和肿瘤细胞的功能,以及参与抗原加工、递呈免疫调节的重要作用,恶性肿瘤患者的巨噬细胞吞噬功能下降。本次实验中观察到AS605240能增强乳腺癌小鼠的巨噬细胞吞噬功能,具体机制尚未明确,考虑在下一步研究中分析原因。本研究显示,AS605240能抑制小鼠乳腺癌的增殖,诱导肿瘤细胞凋亡。从机制上分析,P13K信号功能广泛,可抑制Forkhead家族转录因子的功能,进而抑制PCNA细胞凋亡路径;可抑制前凋亡蛋白caspase-3的激活,进而减缓细胞凋亡;活化的P13K可增加核转录因子的转录活性,增加肿瘤细胞的运动;P13K信号通路可调节细胞周期活动和CyclinD1的表达,激活氧诱导因子-1的表达路径,促使细胞生长紊乱[8]。
综上所述,PI3Kγ抑制剂AS605240在体内具有一定的抑制小鼠乳腺癌增殖的作用,可促使肿瘤组织细胞凋亡,其作用机制可能与调节PCNA、CyclinD1、Caspase-3表达有关。