维生素D水平与成人死亡风险的量效关系研究*
孙 勤 ,张 敏& ,张 韬, 陈 平, 陈 树Δ, 邓绍平
1.四川省医学科学院·四川省人民医院 老年内分泌科(成都 610072);2.成都中医药大学·第二临床医学院 (成都 610075);3.四川省医学科学院·四川省人民医院 糖尿病中心(成都 610072)
近年来,人们对维生素D产生了越来越大的兴趣,研究表明其除参与骨代谢外,对人体健康也有广泛作用。维生素D在人体皮肤合成或摄入后进入血液,被维生素D结合蛋白转运到肝脏,在肝脏中被转变为25-羟维生素D(25OHD)。 25OHD是循环中存在最多的代谢物,可反映机体维生素D的营养水平,因此其血清浓度已被公认为是反映维生素D状态的最合理指标。目前多数机构和专家认为:血清25OHD<20 μg/L(50 nmol/L)为维生素D缺乏;20~30 μg/L(50~75 nmol/L)为维生素D不足;>30 μg/L(>75 nmol/L)为维生素D充足;<10 μg/L(<25 nmol/L)为维生素D严重缺乏[1-2]。
既往研究[3-4]显示,维生素D浓度和全因死亡风险呈显著负相关,在冠状动脉疾病、淋巴瘤、上消化道肿瘤和呼吸衰竭中尤为突出[5]。最近一些研究[6-8]指出维生素D浓度过量将导致死亡率增加。因此,维生素D与成人全因死亡风险的关系存在争议。本研究检索文献完成了25OHD与成人全因死亡风险的剂量-效应meta分析,现报道如下。
1 资料与方法
1.1 研究资料
国内外公开发表的有关25OHD浓度对成人全因死亡率影响的病例对照研究、队列研究或横断面研究。
1.2 文献资料检索
由3位研究者分别独立进行文献检索。从 Elsevier-Science Direct、Springer、EMBASE、Ovid、PubMed、Web of Science、中国知网(CNKI)、维普(VIP)、万方数据库及中国生物医药文献数据库,收集有关维生素D水平与成人全因死亡率的关系。其中英文关键词为:“全因死亡率/all cause mortality”、“死亡率/mortality”、“死亡/death”、“生存/survival”、“25-羟维生素D /25OHD”、“维生素D/vitamin D”。检索时间从2000年1月1日至 2017年12月31日。通过阅读标题和摘要选择可能的入选文献。重复阅读全文,对纳入研究的参考文献和相关研究进行全面筛选,以确定纳入文献。同时对相关文献的参考文献进行二次扩大文献追溯。
1.3 纳入和排除标准
纳入标准:1)研究对象为一般人群或疾病稳定期患者,年龄>18岁; 2)暴露因素: 25OHD至少有3种水平等级的具体数值; 3)结局指标为全因死亡; 4)研究类型为队列研究、病例对照研究、横断面研究;5)语言限中文、英文; 6)报告了每个25OHD水平组的关键效应值:全因死亡人数、随访人数、随访时间、RR/OR及95%CI等。7)一项研究的样本与另一项研究的样本重合时,取样本量相对较大的文献纳入研究。
排除标准:1)无法获取全文的摘要、会议记录及综述文献;2)文章中没有使用或不能明确是否使用血清25OHD浓度作为评估人体维生素D营养状态的指标;3)因补充活性维生素D制剂(骨化三醇、阿法骨化醇)不会影响血清25OHD浓度,但可能影响全因死亡风险,故剔除研究对象随访期内补充活性维生素D制剂的文献;4)原文未提供每个25OHD水平组的关键效应值,且通过联系作者也无法获得这些数据。
1.4 文献信息提取
提取的数据包括第一作者,发表年份,研究对象所属地区(国籍),研究对象总人数、年龄(平均值)、性别比,提取不同浓度25OHD中死亡人数、随访人数、暴露水平、RR值(OR值)、95%CI等。数据提取由2位研究者(孙勤、张韬)重复进行,然后交叉核对。如有分歧,提交第3位研究者(张敏)仲裁。
1.5 文献质量评价
采用Newcastle-Ottawa Scale (NOS)文献质量评价量表评估观察性研究的原始文献质量,0~3、4~5和6~9分分别代表低、中、高质量的研究。
1.6 统计学方法
应用 RevMan 5.3软件及 Stata 12.0软件进行统计学分析。在每项研究中报告了血清25OHD与全因死亡率的效应值大小,由于巢式病例对照研究的OR值、HR值与RR相似,本研究使用RR作为所有参考文献的共同风险估计。在纳入的研究中,部分研究者使用ng/mL作为25OHD的度量单位,本研究统一换算为nmol/L(1 ng/mL=2.5 nmol/L)。
本研究采用常规 Meta分析,使用Stata 12.0 软件,剂量反应 Meta 分析使用 R 3.2.2软件,文献中的效应指标OR、RR、HR值均直接视为RR值。在meta分析过程中,根据是否存在明显的异质性来决定是采用固定效应模型还是随机效应模型,通过2检验和I2值来评价异质性,当P≥0.1、I2≤50%时,则认为异质性可以接受,采用固定效应模型进行 meta 分析;当P<0.1、I2>50% 时,则认为异质性不可以接受,采用随机效应模型进行meta分析,并分析异质性可能产生的原因。检验水准α设定为0.05。
2 结果
2.1 文献检索纳入结果
初检共获得相关文献1 376篇,经逐层筛选,最终获得22篇符合要求的研究纳入系统评价(图1)。采用Newcastle-Ottawa Scale (NOS)文献质量评价量表评价原始文献质量,纳入的文献均为高质量研究(表1)。
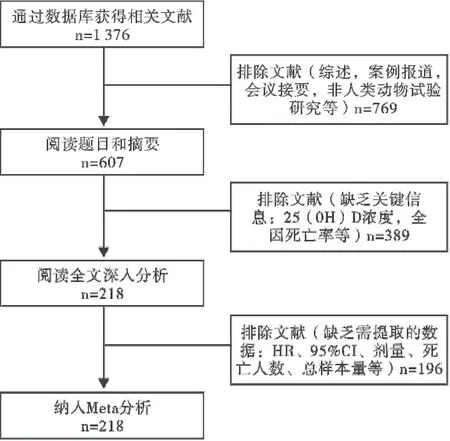
图1 文献筛选流程及结果
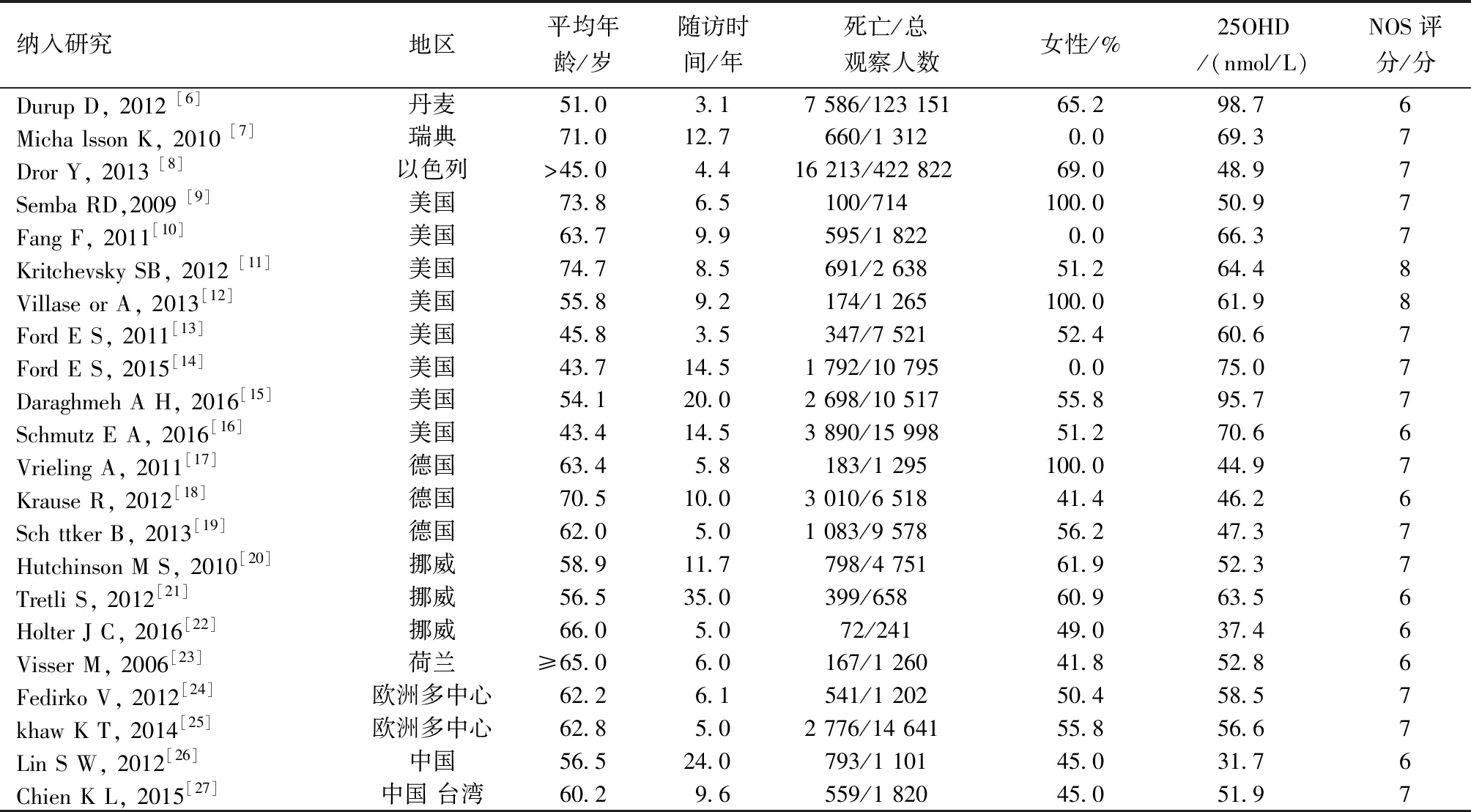
纳入研究地区平均年龄/岁随访时间/年 死亡/总 观察人数女性/%25OHD/(nmol/L)NOS评分/分Durup D, 2012 [6]丹麦51.03.17 586/123 15165.298.76Micha lsson K, 2010 [7]瑞典71.012.7660/1 3120.069.37Dror Y, 2013 [8]以色列>45.04.416 213/422 82269.048.97Semba RD,2009 [9]美国73.86.5100/714100.050.97Fang F, 2011[10]美国63.79.9595/1 8220.066.37Kritchevsky SB, 2012 [11]美国74.78.5691/2 63851.264.48Villase or A, 2013[12]美国55.89.2174/1 265100.061.98Ford E S, 2011[13]美国45.83.5347/7 52152.460.67Ford E S, 2015[14]美国43.714.51 792/10 7950.075.07Daraghmeh A H, 2016[15]美国54.120.02 698/10 51755.895.77Schmutz E A, 2016[16]美国43.414.53 890/15 99851.270.66Vrieling A, 2011[17]德国63.45.8183/1 295100.044.97Krause R, 2012[18]德国70.510.03 010/6 51841.446.26Sch ttker B, 2013[19]德国62.05.01 083/9 57856.247.37Hutchinson M S, 2010[20]挪威58.911.7798/4 75161.952.37Tretli S, 2012[21]挪威56.535.0399/65860.963.56Holter J C, 2016[22]挪威66.05.072/24149.037.46Visser M, 2006[23]荷兰≥65.06.0167/1 26041.852.86Fedirko V, 2012[24]欧洲多中心62.26.1541/1 20250.458.57khaw K T, 2014[25]欧洲多中心62.85.02 776/14 64155.856.67Lin S W, 2012[26]中国56.524.0793/1 10145.031.76Chien K L, 2015[27]中国 台湾60.29.6559/1 82045.051.97
2.2 血清25OHD浓度对成人全因死亡风险的影响
纳入系统评价的原始研究共有641 620名调查对象,其血清25OHD浓度中位数为5.0~240.1 nmol/L,随访时间3~35 年,随访期间死亡45 127例。GLST法评估线性检验结果显示:2= 160.5,P<0.001, 表明25OHD与全因死亡率呈非线性剂量反应关系。拟合曲线显示25OHD与全因死亡率为L型关系(图2),Meta分析显示血清25OHD浓度每升高25 nmo/L时,全因死亡风险下降11%(RR=0.89,95%CI:0.86~0.92)(图3)。亚组分析提示:25OHD浓度升高伴随研究对象死亡风险下降这一特点不受人群的年龄和随访年限影响,但不同地域的研究对象血清25OHD浓度与全因死亡风险的关系,差异有统计学意义(P<0.05)(表2)。
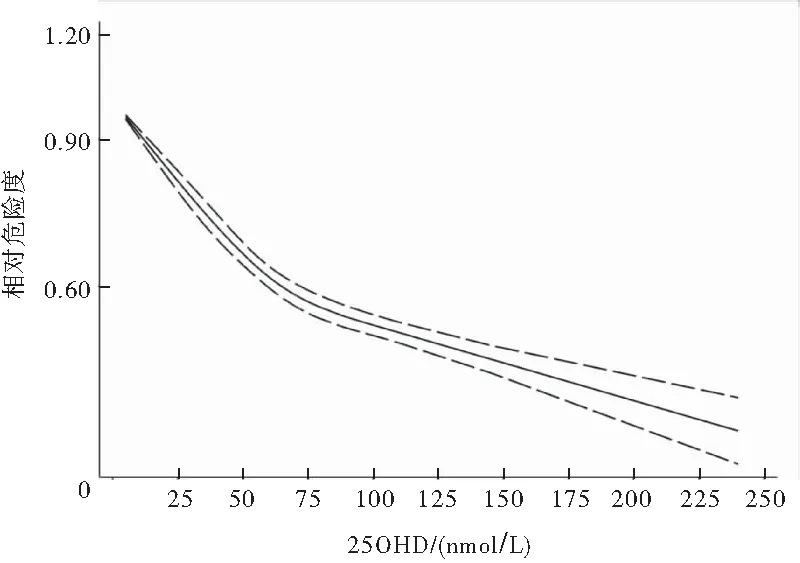
图2 25OHD浓度与全因死亡风险剂量-效应曲线图
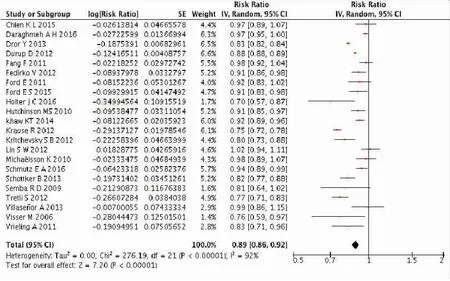
图3 25OHD浓度与全因死亡风险森林图
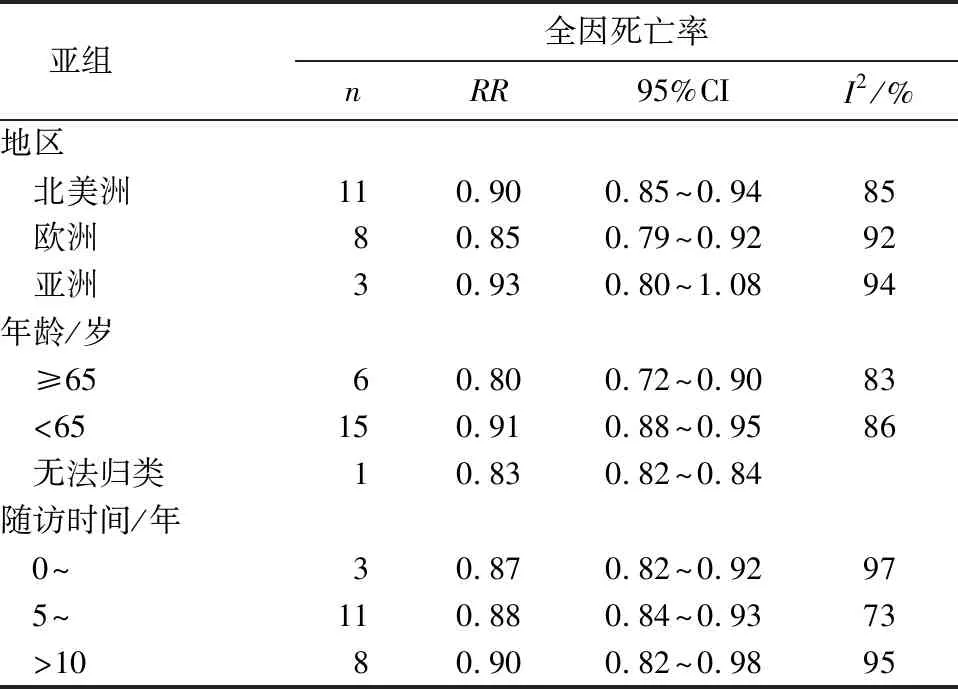
亚组 全因死亡率nRR95%CII2/%地区 北美洲110.900.85~0.9485 欧洲80.850.79~0.9292 亚洲30.930.80~1.0894年龄/岁 ≥6560.800.72~0.9083 <65150.910.88~0.9586 无法归类10.830.82~0.84随访时间/年 0~30.870.82~0.9297 5~110.880.84~0.9373 >1080.900.82~0.9895
2.3 发表偏倚分析
对纳入的22项研究进行漏斗图分析,两侧大致对称,结果显示,无明显发表偏倚存在(图4)。
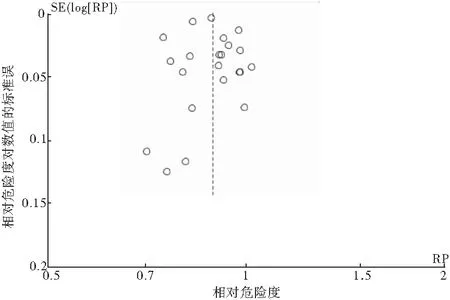
图4 25OHD浓度与全因死亡率漏斗图
3 讨论
尽管不少研究指出维生素D缺乏导致死亡风险升高,但其中许多细节并不清晰和完善,本研究系统评价了血清25OHD浓度与成人全因死亡风险的量效关系,旨在深入理解维生素D营养状态与机体健康的关系。
本研究评估25OHD浓度与全因死亡率的关系,由于纳入研究中对25OHD的范围(缺乏、不足、正常、过量)使用了不同的截断值,因此本研究使用了Greenland[28]和Orsini等[29]提出的方法对25OHD浓度与死亡进行了剂量-效应meta分析:1) 将各暴露水平组的组中值作为剂量点值,若是开区间(如最低暴露水平和最高暴露水平),采取最低剂量的0.5倍和最高剂量的1.2倍作为剂量点值。 2) 先用相应回归模型计算出每单个研究中25OHD每增加25 nmol/L,人群全因死亡风险的效应值,再结合拟合优度检验结果选择相应模型合并上一步计算出的每项研究的死亡风险效应值, 再采用回归参数检验判断是否存在线性关系,当P>0.05 时, 呈线性关系,反之为非线性关系,并拟合图形[30]。结果提示25OHD浓度与全因死亡率存在负性的非线性关系。
Zhang等[31]指出25OHD浓度每升高25 nmo/L,心血管疾病死亡风险下降10%。本研究发现25OHD浓度与全因死亡风险呈负相关,25OHD浓度每升高25 nmo/L时,全因死亡风险下降11%;此外,本研究更深入的亚组分析有两点值得注意:1)与北美洲和欧洲不同,亚洲地区的研究对象中未发现25OHD浓度与全因死亡风险的相关性(OR=0.93,95%CI:0.80~1.08),这可能是因为亚洲地区相关研究过少造成的,但结果的偏差是否真的存在人种选择性差异有待于进一步的研究。2)>65岁人群中,25OHD浓度每升高25 nmo/L,全因死亡风险下降20%(OR=0.8,95%CI:0.72~0.90),显著高于<65岁人群的获益水平,这提示老年人群的健康对维生素D缺乏可能更敏感。
许多机制可以解释维生素D不足导致全因死亡率增加:1)维生素D受体及其自身激酶存在于大多数人类细胞和组织中,表明维生素D在“非骨骼”生理过程中起关键作用[32]。2) 尽管存在一定争议,部分研究者认为人体机体维生素D浓度与白细胞端粒长度呈正相关,这与年龄相关细胞代谢紊乱密切联系,强调了维生素D对于机体长寿、良好预后的积极作用[33-35]。总之,活化的维生素D可能影响细胞生长、增殖、凋亡和免疫系统功能等一系列生物学反应[36-37],维持恰当的25OHD浓度有助于机体健康长寿。
尽管本研究及前述类似研究未发现25OHD浓度与全因死亡风险的“拐点”,但我们并不认为25OHD浓度越高,全因死亡风险越低;研究[7]指出25OHD浓度>98nmol/L后,死亡风险反而增加。近期中华医学会骨质疏松和骨矿盐疾病分会发布的《维生素D及其类似物临床应用共识》指出:对维生素D缺乏所有成年人,应补充以使血清25OHD水平达30 μg/L(75 nmol/L),但血清25OHD浓度超过150 μg/L(375 nmol/L)则可能出现维生素D中毒[2]。维生素D中毒可能引发高钙血症, 进而导致动脉硬化、高血压、各种结石症和肾功能损害,这可能缩短预期寿命[14]。
但我们的meta分析存在一定不足。当评价25OHD浓度与全因死亡率关系时,尽管纳入的原始文献针对年龄、性别、体重、是否吸烟饮酒等进行矫正,但不同文献矫正的因子并不完全一致,且影响全因死亡率的因素极多(如社会地位、潜在疾病等),无法完全排除这些潜在因素对人体全因死亡率的间接影响。本研究限制原始文献语言为中文、英文,因而在文献检索中剔除了其他语言的文献,可能对整体结果有一定程度的影响。纳入研究中以我国人群为研究对象、符合纳入标准的原始文献极少,因此本研究部分结果适用于中国人群应十分谨慎。
总之,本meta分析显示25OHD浓度不足或缺乏导致成人全因死亡率风险增加,这种负性关系在老年人群中更突出。有meta分析指出补充维生素D3可以减少成人全因死亡风险,因此维持适宜浓度25OHD可能是降低成人全因死亡风险的有效手段。本研究证实了25OHD浓度与全因死亡风险的负性关系,亚组分析使这种负性关系显得更为复杂,值得在未来深入研究。