阿托伐醌通过ROS介导的自噬抑制结直肠癌细胞增殖的研究
兰景彬,杨 铃,潘克俭
1.成都医学院 基础医学院(成都610500);2.成都医学院 生物科学与技术学院(成都610500)
结直肠癌是常见高发的恶性消化道肿瘤之一,尽管结直肠癌的诊断和治疗都已取得了一些进展,但其发病和病死率仍逐年上升,是全球癌症致死的主要原因之一[1]。迄今为止,结直肠癌的主要治疗方法是手术切除与放化疗结合,但由于结直肠癌的易复发和远端转移,常导致治疗失败,因此寻找高效的抗癌药物成为迫切需解决的临床问题[2]。目前,传统的抗癌药物选择性低、毒性大,而新药开发成本高、周期长且成功率低,所以近年来“旧药新用”给结直肠癌治疗提供了新的思路。阿托伐醌是一种萘醌类化合物,具有广谱的抗原虫活性,长期以来主要用于治疗卡氏肺囊虫肺炎和疟疾等疾病[3-4]。目前,研究发现阿托伐醌在甲状腺癌[5]、前列腺癌[6]等恶性肿瘤中具有很好的抗肿瘤效应,但其在结直肠癌的治疗研究中尚未见报道。此外,细胞自噬属于Ⅱ型程序性细胞死亡,其相关机制研究已成为肿瘤治疗的一个研究新热点。因此,本研究拟采用人结直肠癌SW480细胞和HCT116细胞为研究对象,探究阿托伐醌对结直肠癌细胞的抑制作用及作用机制,现报道如下。
1 材料与方法
1.1 材料
人结直肠癌细胞SW480、HCT116(购自中科院上海细胞所);噻唑蓝(MTT)和3-甲基腺嘌呤(3-MA)(购自美国Sigma公司);阿托伐醌(质量分数≥98%)、乙酰半胱氨酸(NAC)和羟基氯喹(CQ)[购自阿拉丁试剂(上海)有限公司];活性氧(ROS)检测试剂盒(购自南京建成生物工程研究所);胎牛血清、细胞培养基Dulbecco's Modified Eagle Medium(DMEM)(购自以色列BI公司);蛋白质预染Marker(购自美国ThermoFisher公司);Atg5siRNA(购自上海吉玛制药技术有限公司);Cleaved-PARP、Cleaved-Caspase3、β-actin、LC3、p62、Beclin-1单克隆抗体(购自Cell Signaling Technology公司);鼠二抗、兔二抗均购自成都正能生物技术有限责任公司;PVDF膜、ECL显影液(购自美国Millipore公司;其余试剂均为国产分析纯。
1.2 方法
1.2.1 细胞培养 SW480、HCT116细胞采用DMEM培养基(含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素)于37 ℃,5%CO2下培养,隔天换液,用于实验的细胞均处于对数生长期。
1.2.2 细胞活力 实验将SW480、HCT116细胞分别接种于96孔板(密度为3×103个/孔),于37 ℃,5%CO2培养箱中培养过夜。待细胞贴壁后,对照组给予DMEM培养基,实验组加入含不同浓度(0.12、0.25、0.5、1、2、4、8、16、32、64、128 μmol/L)阿托伐醌的DMEM培养基,放入37 ℃培养箱中继续培养24 h,每组设置5个复孔,另设置不含细胞仅有培养基的空白对照孔。药物处理完毕后,避光下每孔加入5 mg/mL的MTT试剂20 μL,继续37 ℃培养4 h,而后弃去液体,每孔加入150 μL的DMSO振荡溶解,以空白对照孔调零,用酶标仪于490 nm波长处测定吸光度(A)值,检测细胞活力。
1.2.3 细胞克隆 形成实验取对数期生长的结直肠癌细胞接种于无菌6孔板中,接种密度为100个细胞/孔,铺匀后于37 ℃,5%CO2培养箱中培养过夜。待细胞贴壁后,加入2 mL含不同浓度(0、4、8 μmol/L)阿托伐醌的培养基进行培养,每2~3 d更换一次培养基,2周后终止培养,弃六孔板中培养液,用PBS小心清洗3次,加入1 mL的4%多聚甲醛固定细胞15 min,然后弃去多聚甲醛,并用PBS清洗3次,加入1 mL的结晶紫染液,室温染色20 min,PBS清洗结晶紫,观察细胞克隆情况并拍照。
1.2.4 免疫荧光检测 自噬体的形成参照文献[7]方法,在6孔板中放入多聚赖氨酸处理过的盖玻片,然后将结直肠癌细胞以合适的密度接种到盖玻片上,于37 ℃,5%CO2培养箱中培养过夜。待细胞贴壁后,加入不同浓度的阿托伐醌,继续培养24 h,用4%多聚甲醛固定细胞15 min,0.5%TritonX-100室温通透20 min,PBS清洗3次,5 min/次。然后用含3%牛血清白蛋白的PBS封闭30 min,4 ℃下用LC3一抗孵育过夜,随后用FITC-荧光二抗室温孵育1 h,荧光显微镜下过LC3抗体免疫荧光强弱检测细胞自噬体的形成。
1.2.5 活性氧(ROS)的检测 采用流式细胞仪检测经荧光探针DCFH-DA标记的用阿托伐醌处理后的细胞内活性氧(ROS)的表达情况。参考试剂盒方法,将用阿托伐醌处理好后的结直肠癌细胞用以双无培养基稀释成终浓度为10 μmol/L的DCFH-DA溶液进行悬浮,于37 ℃,5%CO2培养箱中培养1 h,每5 min颠倒混匀1次,使得细胞与探针能充分接触,然后将处理过的细胞清洗并重新悬浮在PBS中,用流式细胞仪测量DCF荧光强弱。
1.2.6 免疫印迹检测 蛋白表达收集药物处理后的细胞,按1×106个细胞/mL的密度加入含蛋白酶抑制剂的RIPA细胞裂解液100 μL,涡旋振荡混匀,于冰上裂解30 min, 4 ℃下以转速13 000 r/min,离心半径7 cm,离心15 min,取上清液进行蛋白定量,加入5×上样缓冲液制成电泳样品,于沸水浴中加热10 min。将制好的蛋白样品经SDS-PAGE电泳分离后,用湿转法把胶上的蛋白转至PVDF膜上,5%脱脂奶粉溶液37 ℃下封闭1 h,而后用稀释好的目的蛋白相应一抗于4 ℃孵育过夜。用TBST洗涤膜以去除残留未结合的一抗后,辣根过氧化物酶标记的二抗室温孵育1 h,TBST洗涤5次,10 min/次,加入ECL显影剂后曝光仪成像观察蛋白表达情况。
1.3 统计学方法
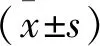
2 结果
2.1 阿托伐醌抑制结直肠癌细胞的增殖
MTT实验结果显示,阿托伐醌可增强结直肠癌SW480细胞和HCT116细胞的细胞内毒性,细胞活力下降,且呈药物浓度依赖性(图1A)。细胞克隆形成实验结果显示,随着阿托伐醌浓度的增加,SW480细胞和HCT116细胞的克隆数逐渐减少(图1B)。以上结果表明,阿托伐醌能抑制结直肠癌细胞的增殖,且呈浓度依赖性。
注:A:MTT实验检测阿托伐醌处理结直肠癌细胞后的细胞活力(与对照组相比,ns:差异无统计学意义;*P<0.05,**P<0.01,***P<0.001);B:细胞克隆形成情况及细胞克隆数的统计(与对照组相比,**P<0.01)
2.2 阿托伐醌对结直肠癌细胞凋亡的影响
采用免疫印迹法检测阿托伐醌处理结直肠癌细胞后凋亡相关标志蛋白的变化,实验结果显示,阿托伐醌处理结直肠癌SW480细胞和HCT116细胞后,Cleaved-PARP、Cleaved-Caspase3等凋亡相关标志蛋白的表达无明显变化,表明凋亡不是阿托伐醌抑制结直肠癌细胞增殖的作用机制,提示阿托伐醌可能通过其他机制抑制结直肠癌细胞增殖(图2)。

图2 Western Blot检测阿托伐醌处理结直肠癌细胞后凋亡相关标志蛋白的变化
2.3 阿托伐醌促进结直肠癌细胞自噬
免疫荧光实验结果(图3A)显示,阿托伐醌处理结直肠癌SW480细胞和HCT116细胞后,胞内LC3荧光斑点数增加,表明阿托伐醌能促进自噬体的形成;与此同时,采用自噬阻断剂氯喹(CQ)与阿托伐醌共处理结直肠癌细胞后,CQ与阿托伐醌共处理组的LC3荧光斑点数较阿托伐醌单独处理组和CQ单独处理组多,说明阿托伐醌能激活完整的自噬流。此外,蛋白免疫印迹也检测了阿托伐醌处理细胞后自噬相关标志蛋白的变化,结果显示,阿托伐醌处理结直肠癌SW480细胞和HCT116细胞后,自噬相关基因LC3-Ⅱ、Beclin-1的表达增加,p62表达减少(图3B);且较阿托伐醌或CQ单独处理,CQ与阿托伐醌共处理后LC3-Ⅱ的表达增加(图3C),这与免疫荧光的结果一致。以上结果表明,阿托伐醌能够明显激活结直肠癌细胞的自噬水平。
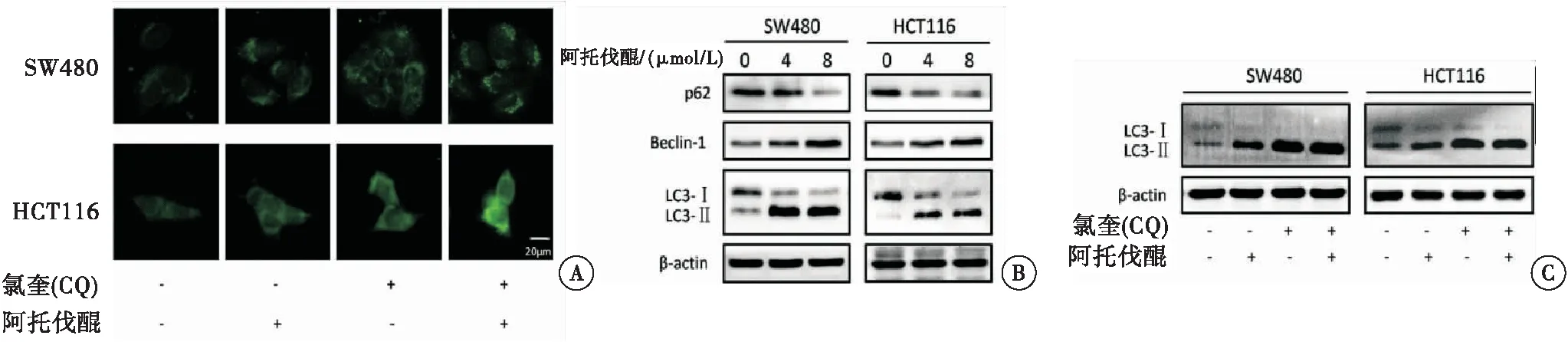
图3 阿托伐醌促进结直肠癌细胞自噬
注:A:免疫荧光检测结直肠癌细胞中的LC3荧光斑点;B:Western Blot检测自噬相关标志蛋白的变化;C:阿托伐醌与自噬抑制剂氯喹(CQ)共处理结直肠癌细胞后检测LC3-Ⅱ表达情况
2.4 阿托伐醌激活自噬进而抑制结直肠癌细胞增殖
采用siRNA沉默自噬相关基因Atg5后检测阿托伐醌对结直肠癌细胞的影响,结果发现,与对照组相比, Atg5沉默组细胞活力有明显回升(图4A)。且与阿托伐醌单独处理相比,3-MA与阿托伐醌的共处理组的细胞克隆数增加(图4B)。以上结果表明,阿托伐醌能通过激活结直肠癌细胞自噬,进而抑制结直肠癌细胞增殖。
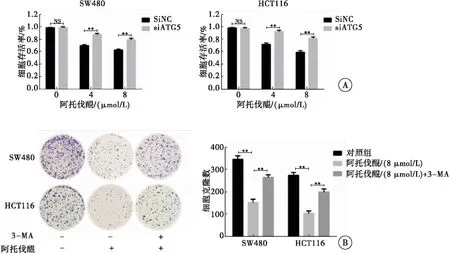
图4 阿托伐醌激活自噬进而抑制结直肠癌细胞增殖
注:A:MTT法检测siRNA沉默Atg5后阿托伐醌对结直肠癌细胞活力的影响(与siNC组比较,ns:差异无统计学意义,**P<0.01);B:3-MA抑制自噬后阿托伐醌对结直肠癌细胞克隆形成的影响(与对照组相比,**P<0.01;阿托伐醌组与阿托伐醌和3-MA的共处理组相比,**P<0.01)
2.5 阿托伐醌促进ROS的产生进而激活结直肠癌细胞自噬
采用DCFH-DA探针检测胞内ROS的表达变化,结果发现,阿托伐醌能诱发结直肠癌细胞内ROS的表达(图5A)。且加入ROS清除剂NAC能抑制阿托伐醌诱导的结直肠癌细胞自噬(图5B)。以上结果说明,阿托伐醌通过促进结直肠癌细胞胞内ROS的产生,从而激活细胞自噬,进而抑制结直肠癌细胞增殖。
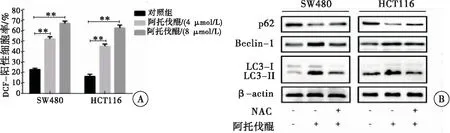
图5 阿托伐醌促进ROS的产生进而激活结直肠癌细胞自噬
注:A:阿托伐醌处理结直肠癌后胞内ROS的产生情况(与对照组相比,**P<0.01);B:阿托伐醌与ROS清除剂NAC共处理结直肠癌细胞后自噬标志蛋白的变化
3 讨论
结直肠癌是世界范围内第三高发的恶性肿瘤,同肺癌、乳腺癌并列世界三大癌症,由于结直肠癌的早期诊断较困难,加之结直肠癌具有无限增殖、侵袭和转移等特点,所以多数结直肠癌患者在明确诊断时己经进入中晚期。尽管目前结直肠癌的治疗已趋向于手术治疗、辅助化疗和放疗的综合疗法,但其对中晚期结直肠癌患者的效果不佳,且治疗后的各种并发症发生仍然较多,因此进一步寻找治疗结直肠癌的新型药物具有重要意义。目前,较不良反应大的传统化疗药物和研发困难的新药相比,重新利用现存药物并找出其新应用已成为治疗肿瘤的一大新研究方向。近年来,一些美国FDA批准的抗感染药物被研究发现具有很好的抗癌活性,其中阿托伐醌这种长期被用于抗寄生虫的药物就显示出对甲状腺癌[5]、乳腺癌[8]具有抑制作用。本研究证实了阿托伐醌能够有效抑制结直肠癌细胞的增殖,并呈药物浓度依赖性。肿瘤细胞常因凋亡缺陷或细胞周期异常而导致恶性增殖,激活肿瘤细胞凋亡可抑制肿瘤细胞增殖治疗癌症[9]。为研究阿托伐醌抑制结直肠癌细胞增殖的机制,本研究采用免疫印迹法检测阿托伐醌处理结直肠癌细胞后凋亡情况的发生,结果发现Cleaved-PARP、Cleaved-Caspase3等凋亡相关标志蛋白的表达无明显变化,说明阿托伐醌抑制结直肠癌细胞增殖的作用机制不是凋亡而可能是通过其他机制。
近年来,有研究[10]表明,治疗肿瘤的药物除了能引起肿瘤细胞凋亡,还可诱导其发生自噬等其他非凋亡形式的细胞死亡。自噬是一种进化上保守的细胞内自我防御机制,可清除细胞内受损的细胞器和蛋白质,并重新利用以满足细胞本身的代谢需要[11]。自噬作为一种复杂的细胞内降解方式,在细胞死亡中具有两重性,温和的自噬可促进细胞存活,而过度的自噬则将诱发细胞死亡,被称为自噬性死亡[12]。因此,自噬在抗肿瘤药物治疗中发挥着非常重要的作用。本研究采用免疫荧光和免疫印迹分别检测了阿托伐醌处理结直肠癌细胞后自噬体的形成以及自噬相关标志蛋白的变化,结果发现,阿托伐醌处理结直肠癌细胞后,胞质中LC3荧光斑点数明显增加,自噬相关标志蛋白LC3-Ⅱ、Beclin-1的表达增加,p62的表达减少,且在加入自噬抑制剂氯喹后,胞内LC3-Ⅱ的表达进一步增加,这提示阿托伐醌能促进结直肠癌细胞自噬。此外,本研究发现,在阿托伐醌处理结直肠癌细胞的同时,沉默自噬相关基因Atg5或加入自噬抑制剂3-MA可抑制阿托伐醌对结直肠癌细胞的增殖抑制作用,表明阿托伐醌是通过诱导结直肠癌细胞自噬进而抑制结直肠癌细胞增殖。
自噬能被病原体感染[13]、营养压力[14]以及氧化应激[15]等多种刺激因素所激活。其中,活性氧成为了近年来研究的热点。活性氧是细胞有氧代谢产生的一类性质比较活泼的含氧化合物的总称,这些化合物会破坏不同细胞过程所必需的生物大分子,同时又在重要生物事件所需的氧化还原信号中发挥至关重要的作用[16]。研究[17]表明,过量ROS的产生能诱发氧化应激,破坏细胞内的代谢平衡,引起细胞损伤。研究[18]显示,ROS可通过调控mTOR、p53的相关信号通路诱导自噬的发生,最终导致细胞死亡。本研究发现,阿托伐醌处理结直肠癌细胞后ROS的表达增加,且在阿托伐醌处理结直肠癌细胞的同时加入ROS清除剂NAC可抑制结直肠癌细胞自噬的发生,表明阿托伐醌能通过诱导结直肠癌细胞胞内ROS的产生进而促进结直肠癌细胞自噬。
综上所述,阿托伐醌可通过诱导ROS介导的自噬抑制结直肠癌细胞增殖,为结直肠癌的治疗提供了新的研究思路。