磷酸哌喹分散片的处方前研究
唐嘉曦,许小红
成都医学院 药学院(成都 610500)
磷酸哌喹(piperaquine phosphate,PQP)为 4-氨基喹啉类抗疟药,通常与双氢青蒿素合用,具有协同增效作用,可延缓疟原虫耐药性的产生[1]。目前临床常用剂型为复方片剂(规格为320 mg),由于PQP临床剂量较大,不利于小孩或吞咽困难者服用,本研究拟研究开发为分散片,以提高患者服药的顺应性。PQP原料药基本理化性质研究文献报道较少[2-4],本研究测定了PQP的平衡溶解度、油水分配系数、吸湿性、稳定性等参数,旨在为处方设计及研究提供依据[5]。
1 仪器与试药
1.1 仪器
安捷伦1260高效液相色谱仪;分析天平(梅特勒-托利多);优普系列超纯水器(UPH-II-10T,四川优普超纯科技有限公司);超声波清洗机[致微(厦门)仪器有限公司,功率:900 W,频率:(40±2) kHz];药品稳定性试验箱(上海博讯实业有限公司医疗设备厂);YG120药物光照试验箱(上海实验仪器厂有限公司);数显气浴恒温振荡器(常州普天仪器制造有限公司)。
1.2 试药
PQP原料药(江苏斯威森生物医药工程研究中心有限公司,批号:150806);PQP对照品(江苏斯威森生物医药工程研究中心有限公司,批号:161203);乙腈为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 PQP HPLC测定方法的建立
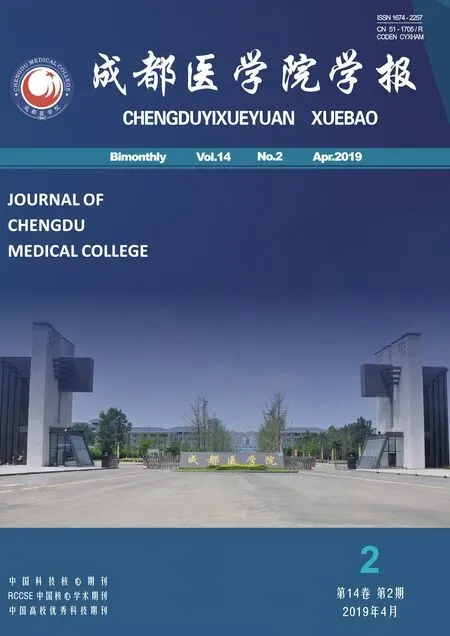
2.1.1 色谱条件[6]Nu-Analutical(250 mm×4.6 mm,5 μm);流动相:乙腈-0.1 %三氯乙酸(磷酸调pH=2,25:75);流速:1 mL/min;柱温:35 ℃;检测波长为349 nm;进样量:10 μL(图1)。

图1系统适用性色谱图
注:A: PQP对照品溶液色谱图;B:PQP原料药色谱图
2.1.2 线性关系考察 精密称取PQP对照品,加流动相配制1 mg/mL的PQP对照品储备液。精密量取储备液适量,加流动相稀释得2、5、15、20、25、30、40、60、100 μg /mL的一系列对照品溶液。按照“2.1.1”项下色谱条件进样,记录色谱图。以质量浓度(X)为横坐标、峰面积(Y)为纵坐标,绘制标准曲线,得回归方程为Y=18.394X-4.6748(R2=0.999 9)。结果表明,PQP的质量浓度在0.002~0.1 mg/mL范围内与峰面积呈良好线性关系。
2.1.3 检测限与定量限 取线性研究中所用的PQP对照品的低浓度(2 μg /mL),进行逐级稀释,分别按照“2.1.1”项下色谱条件进样,按信噪比法,在PQPS/N ≥10,确定PQP的定量限,在PQPS/N≥3,确定PQP的检测限,结果检测限为检测限为0.4 ng,定量限为1 ng。
2.1.4 进样精密度 取25 μg /mL PQP对照品溶液10 μL,注入高效液相色谱仪中,照“2.1.1”项下色谱条件,连续进样6次,记录色谱图,考察主峰峰面积变化,结果峰面积RSD为0.36%,进样精密度良好。
2.1.5 重复性试验 取同一批PQP原料药共6 份,用加流动相适量超声溶解,冷却后定容至刻度,制成25 μg /mL的PQP供试品溶液,按照“2.1.1”项下色谱条件进样测定,结果PQP含量RSD为0.56 %,表明该方法重复性良好。
2.1.6 稳定性试验 取25 μg/mL的供试品溶液,照色谱条件,分别于0、2 、4 、6 、8 、12 、24 h精密量取10 μL注入液相色谱仪,照“2.1.1”项下色谱条件进样,记录色谱图,结果峰面积RSD为0.30 %,表明供试品溶液在24 h内稳定性良好。
2.1.7 破坏性试验 精密称取PQP25 mg置于50 mL量瓶中,加1 mol/L HCl溶液2 mL,在50 ℃水浴中加热2.5 h,放冷,用1 mol/L NaOH调节pH至中性,用流动相稀释并定容至刻度,作为酸破坏溶液;精密称取PQP25 mg置于50 mL量瓶中,加1 mol/L NaOH溶液2 mL,在50 ℃水浴中加热2.5 h,放冷,用1 mol/L HCl调节pH至中性,用流动相稀释并定容至刻度,作为碱破坏溶液;精密称取PQP 25 mg置于50 mL量瓶中,加30 %过氧化氢溶液2 mL,在50 ℃水浴中加热2.5 h,放冷,用流动相稀释并定容至刻度,作为氧化破坏溶液;将上诉3个破坏性溶液照“2.1.1”项下色谱条件进样,结果表明该方法能有效检出各破坏试验产生的杂质,且各杂质峰均能与主峰达到基线分离,专属性较好(图2)。
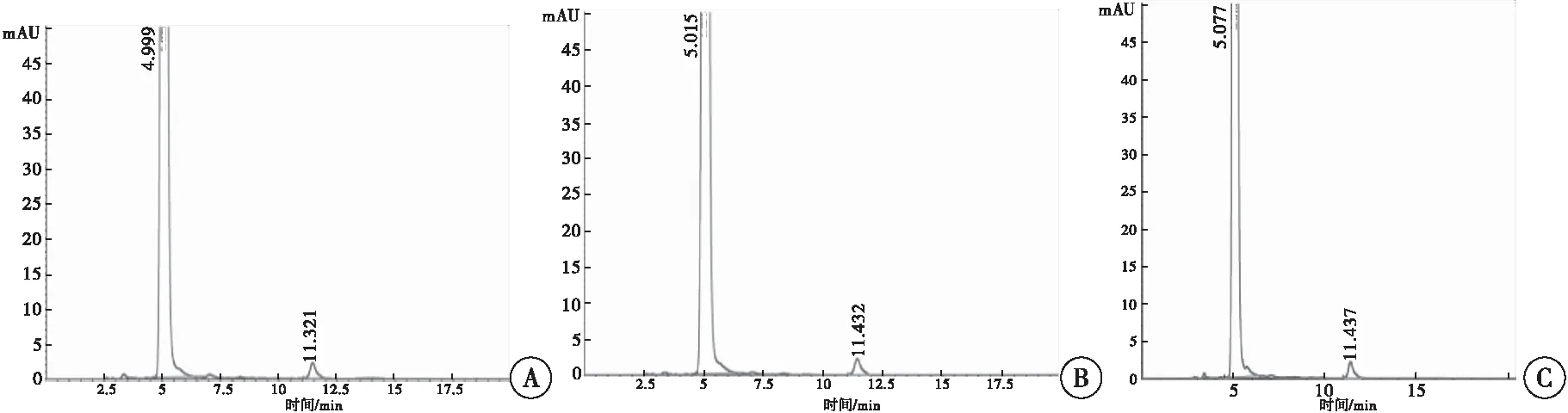
图2 破坏性试验色谱图注:A:酸破坏色谱图; B:碱破坏色谱图;C:氧化破坏色谱图
2.2 PQP在不同pH缓冲溶液中的平衡溶解度测定[7]
取过量PQP原料于带塞塑料管中,分别加入10 mL配制的pH分别为1.0、1.2、1.5、2.0、3.8、4.5、5.8、6.8、7.4、8.0的系列缓冲液中,摇床振荡8 h至药物不再溶解。将饱和溶液于12 000 rpm/min离心5 min,离心半径8.5 cm,取上清液,样品浓度超过线性范围时用流动相稀释一定倍数,照色谱条件进样,记录峰面积,并将结果代入标准曲线方程计算浓度。在37 ℃下, PQP的平衡溶解度随着缓冲液pH的增大而减小(图3)。

图3 PQP不同pH溶液中的溶解度
2.3 PQP油水分配系数的测定[8]
精密称取PQP原料药4 mg,用纯水饱和的正辛醇溶解并定容至50 mL,得88 μg/mL PQP的正辛醇溶液母液;取母液适量,用正辛醇定容至25 mL,得10、33、55 μg/mL的正辛醇PQP溶液。准确量取已配制的pH分别为1.0、1.2、1.5、2.0、3.8、4.5、5.8、6.8、7.4和8.0的系列缓冲液各2 mL至5 mL至离心管中,再配制高、中、低浓度PQP水饱和正辛醇溶液2 mL,强力涡旋5 min,然后12 000 r/min离心5 min,离心半径8.5 cm,分别取正辛醇层、水层 ,照“2.1.1”项下色谱条件进样,计算油相浓度(Co)和水相浓度(Cw)。结果采用公式P=CO/CW计算PQP表观油水分配系数P,并计算其对数值log P, 高、中、低浓度下PQP的log P值在pH(1.0~4.5)中的油水分配系数<0,亲水性较好;在pH(5.8~8.0)中的油水分配系数>0,亲油性较好(表1)。
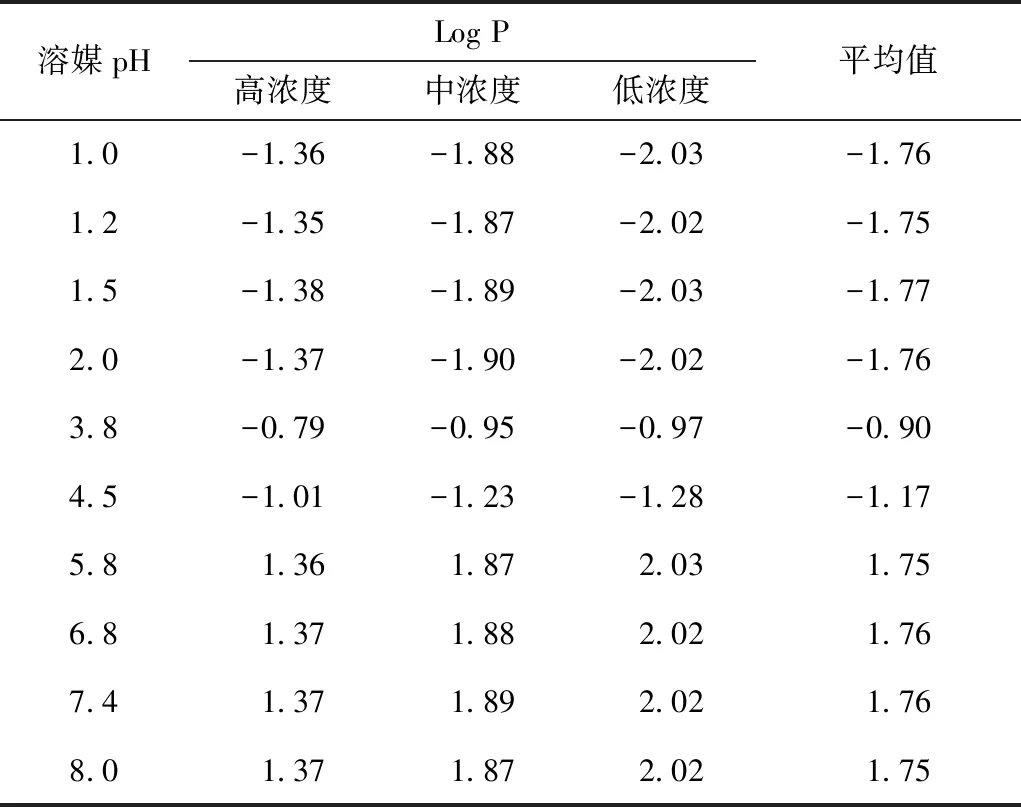
表1 PQP在不同pH条件下Log P
2.4 PQP吸湿性测定[9]
将底部盛有氯化铵过饱和溶液的玻璃干燥器放入 25 ℃的恒温培养箱内恒温 24 h ,此时干燥器内的相对湿度为(80±2)%, 将恒重后的PQP样品粉末放入已恒重的称量瓶中,厚度约 2 mm, 精密称定后置于上述玻璃干燥器内,称量瓶盖打开于 25 ℃保存,分别于0、2、4、6、12、24、48、72 h 精密称重,计算吸湿百分率,并以时间为横坐标,吸湿百分率为纵坐标进行作图,结果表明PQP样品在24 h 后吸湿百分率约 0.69 % ,48 h后吸湿达到饱和,说明PQP略有引湿性(表2)。

表2 PQP原料药吸湿试验结果
2.5 PQP影响因素实验
2.5.1 高温试验 根据《中华人民共和国药典》2015 版[6],9001 原料药物与制剂稳定性试验指导原则要求,供试品开口置适宜洁净容器中(培养皿中摊成≤5 mm 厚薄层),60 ℃温度下放置 10 d,于第0、5、 10 天取样,考察其外观、含量及有关物质的变化。
2.5.2 高湿试验 根据《中华人民共和国药典》2015 版第 4 部,9001 原料药物与制剂稳定性试验指导原则要求,供试品开口置适宜洁净容器中(培养皿摊成≤5 mm 厚薄层),在 25 ℃于相对湿度(90±5)%条件下放置10 d,于第0、5、10 天取样,考察其外观、含量及有关物质的变化。
2.5.3 强光照射试验 根据《中华人民共和国药典》2015 版[6],9001 原料药物与制剂稳定性试验指导原则要求,供试品开口置适宜洁净容器中(培养皿中摊成≤5 mm 厚薄层),于照度(4 500±500)Lx 条件下放置10 d,于第0、5、10 天取样,考察其外观、含量及有关物质的变化。影响因素试验结果显示,相对于0 d的样品,高温高湿光照条件下单个杂质和总杂都没有明显增长(表3)。

表3 PQP影响因素试验结果
3 讨论
药物的溶解度直接影响药物的吸收与药物在体内的生物利用度,是制备药物制剂首先应掌握的信息[10]。本研究旨在开发PQP分散片,在pH 1.0时PQP溶解度最大,说明PQP在胃中溶解度最大,制成分散片后能在胃中迅速溶出。油水分配系数可预测药物的亲水亲脂性[11],PQP随着pH值的增大 LogP也增大,说明药物在胃中快速溶出之后随着消化道pH值的增大,能够较容易地透过细胞膜而吸收入血。
影响因素试验结果表明,PQP在光照条件下相对不稳定,湿度和温度对其影响不大,因此在今后的处方设计及制备工艺中,应适当避免光照,后期考虑进一步研究光照对PQP降解速率的影响,为实验操作过程避光程度提供更充分的实验数据。