石菖蒲抗癫痫活性成分α-细辛醇鼻腔给药大鼠的药代动力学研究
李玥璇,梁丽红,许茹,程培萱,肖超妮
(西北大学生命科学学院,陕西 西安 710069)
α-细辛醇[反式-3-(2,4,5-三甲氧基苯基)丙-2-烯-1-醇,MW=224]是抗癫痫中药石菖蒲和“胆南星-石菖蒲”复方中的活性成分,也是“远志-石菖蒲”及临床药物α-细辛脑胶囊体内代谢的核心效应物[1]。依据美国国立卫生研究院实施的抗癫痫药物开发程序,在3种不同癫痫模型的研究中发现,α-细辛醇的抗癫痫活性优于α-细辛脑胶囊、司替戊醇和卡马西平而其神经毒性却较低[2]。α-细辛醇可预防H2O2介导的SH-SY5Y细胞凋亡,具有一定的神经细胞保护作用[3]。α-细辛醇主要通过苯二氮卓结合位点对GABAA受体进行调控、通过抑制神经元细胞和神经胶质细胞LDH活性,从能量代谢角度控制癫痫发生和通过促进氧化物酶体增殖激活受体PPAR-γ发挥活性[4]。2016年,α-细辛醇获得中国发明专利证书(ZL201410692696.9)。
灌胃给药α-细辛醇在正常大鼠和癫痫大鼠的生物利用度较低,到达脑内的浓度更低从而影响疗效;静脉注射α-细辛醇在大鼠脑、心、脾、肾脏组织中均有分布,但是脑靶向特性却不甚清楚[5]。癫痫发作时患者意识丧失、肢体抽搐、精神异常、牙关紧闭,口服或注射等常规给药方式出现一定的难度,不适合于癫痫发作的急救和自救治疗。鼻腔给药利用大脑和鼻室通过嗅觉/三叉神经通路和外周循环相互连接,绕过血脑屏障将药物传递至大脑,避免胃肠和肝脏代谢提高药物的生物利用度[6-7]。鼻腔给药作为脑靶向给药方式之一,与口服和透皮给药相比,具有快速起效、非侵入性、易于给药等优点[8]。
为了探讨α-细辛醇鼻腔给药在抗癫痫疾病方面的可行性,本研究采用高效液相色谱法分析比较鼻腔给药、静脉注射和灌胃给药α-细辛醇后大鼠血浆的药代动力学特性及脑组织的分布情况,评价3种给药方式的生物利用度和脑靶向特性,为α-细辛醇抗癫痫创新药物研究提供实验依据。
1 材料与方法
1.1 药品与试剂α-细辛醇(本实验室合成,纯度>99.0%);α-细辛醚(上海麦克林生化科技有限公司);吐温-80(国药集团化学试剂有限公司);0.9%生理盐水(西安京西双鹤药业有限公司);甲醇、乙腈(色谱级,Fisher Scientific);甲酸、乙醚(分析纯,天津市大茂化学试剂厂)。
1.2 动物 SPF级成年雄性Sprague-Dawley大鼠[合格证:SCXK(陕)2018-001],体重180.0~220.0 g,购于西安交通大学医学部动物研究中心。置于动物笼饲养,环境温度保持为(20±2)℃,湿度为45%±3%,昼夜周期为12 h,可自由摄食和饮水。
1.3 仪器 1100型高效液相色谱仪(美国Agilent公司);BF2000氮气吹干仪(北京八方世纪仪器);UPD-Ⅱ-10T超纯水机(四川优普超纯科技有限公司);TGL-16G高速离心机(上海安宁科学仪器);SCIENTZ-48高通量组织研磨器(宁波新芝生物科技股份有限公司)。
1.4 方法
1.4.1 药液配制 称取α-细辛醇0.050 0 g,置于研钵中,将1 mL生理盐水和1 mg吐温-80分次加入研钵中,研磨至完全溶解,配制α-细辛醇药液(50 mg·mL-1)用于滴鼻给药。称取α-细辛醇0.768 0 g,置于研钵中,将96 mL生理盐水和1.5 mg吐温-80分次加入研钵中,研磨至完全溶解,配制α-细辛醇药液(8 mg·mL-1)用于灌胃给药和尾静脉注射给药。药液置于4 ℃冰箱冷藏。
1.4.2 动物实验 动物实验经西北大学动物伦理委员会批准,符合要求。大鼠72只,禁食12 h,自由饮水,随机分为滴鼻给药组、静脉注射给药组和灌胃给药组,每组24只。腹腔注射7%水合氯醛对大鼠进行麻醉,仰卧位固定,在大鼠颈部正中剪开约3 cm切口,用镊子剥离颈部肌肉,暴露出食道、气管以及颈动脉血管,肺部端的气管插入约2 cm的塑料管保证大鼠正常呼吸,头部端的气管用细线扎紧。滴鼻给药组结扎食道、封闭口腔防止药物进入胃肠道或肺部,α-细辛醇给药剂量为25 mg·kg-1;静脉注射给药组和灌胃给药组α-细辛醇的给药剂量分别为25和50 mg·kg-1。
1.4.3 样品采集与处理 将动物颈动脉血管的近头端用细线系紧,近心端夹上止血夹,在距离止血夹约0.8 cm处用注射器头扎孔后,将颈动脉插管插入血管后用细线系紧。在给药后0、2、5、10、15、20、30、45、60、75、90、120 min取血0.5 mL,取血后立即夹上止血夹,用生理盐水和肝素冲洗颈动脉插管防止血液凝固。血液经离心(9 000 r·min-1,10 min,4 ℃)后,取上清180 μL置于离心管中,加入内标物α-细辛醚20 μL(50 μg·mL-1)和乙腈600 μL,涡旋混匀,再次离心得上清液,用氮气流吹干,残留物用200 μL色谱流动相复溶,涡旋1 min,得血浆样品用于HPLC测定。
在给药后2、15、30 min,快速脱颈处死大鼠,低温下迅速取脑,用生理盐水冲洗干净,对嗅区、嗅球、海马、小脑、大脑皮层分区取材,用滤纸吸干表面水分进行称重,加入5倍量溶剂(生理盐水∶甲醇=1∶2)后用组织研磨器进行匀浆。匀浆液经离心(9 000 r·mim-1,10 min,4 ℃),取上清100 μL置于离心管中,加入乙腈300 μL,再次离心后,上清液用氮气流吹干,残留物用100 μL色谱流动相进行复溶,涡旋1 min,得脑组织提取液用于HPLC测定。
1.4.4 色谱条件 采用Agilent C18色谱柱(4.6 mm×250 mm,5 μm),柱温30 ℃,流速为0.7 mL·min-1,检测波长为314 nm,进样量为20 μL。流动相为甲醇(B)和2‰甲酸水(A),血浆样品的流动相梯度洗脱:40%B→70%B(0~15 min),70%B→90%B(15~25 min),脑组织提取液样品的流动相梯度洗脱:40%B→70%B(0~15 min)。
1.4.5 方法学考察 专属性:对空白血浆、α-细辛醇溶液(含α-细辛醚)、α-细辛醇和血浆混合液(含α-细辛醚)和灌胃给药α-细辛醇后的血浆样品,在相同HPLC检测条件下进行分析。分别对空白脑组织提取液、α-细辛醇和空白脑组织提取液的混合液、灌胃给药α-细辛醇后脑组织的样品溶液,在相同HPLC检测条件下进行分析。
线性曲线:精密配制α-细辛醇储备液,稀释后得到系列标准溶液(1 000、500、250、100、50、25、10、5、2.5、1 μg·mL-1),取10份空白血浆(160 μL),加入α-细辛醇各系列标准溶液20 μL和α-细辛醚溶液20 μL(50 μg·mL-1),得到α-细辛醇(100、50、25、10、5、2.5、1、0.5、0.25、0.1 μg·mL-1)的血浆混合液,经处理后采用HPLC进行测定,以α-细辛醇与α-细辛醚的色谱峰面积之比值与α-细辛醇的浓度进行回归拟合,得线性方程。取10份空白组织提取液180 μL,分别加入α-细辛醇系列标准溶液20 μL,得到α-细辛醇(50、25、10、5、2.5、1、0.5、0.25、0.1 μg·mL-1)组织提取混合液,经处理后采用HPLC进行测定,以α-细辛醇色谱峰面积与α-细辛醇浓度进行回归拟合,得线性方程。
精密度和加样回收率、稳定性:取空白血浆/空白脑组织,加入α-细辛醇标准溶液,配制成低(0.5 μg·mL-1)、中(5.0 μg·mL-1)、高浓度(50.0 μg·mL-1)的样品。在一天内重复进样分析(n=6),计算日内精密度和加样回收率,连续6 d重复(n=6)进样分析,计算日间精密度和加样回收率。在室温下放置2、4、8 h,考察α-细辛醇的短期稳定性;于-80 ℃下冷冻30、60、90 d后取出,考察α-细辛醇的长期稳定性;于-80 ℃下冷冻24 h,取出,室温融解,重复操作3次,考察α-细辛醇的冻融稳定性。
2 结果
2.1 方法学考察 图1为α-细辛醇在血浆样品中的专属性考察结果,α-细辛醇与内标物α-细辛醚色谱峰保留时间相差较大,分离度好,且血浆内源性代谢物的色谱峰对其无干扰。图2为α-细辛醇在不同脑组织中的专属性考察结果,α-细辛醇色谱峰峰形良好,且脑组织内源性代谢物色谱峰对其均无干扰,分离度较好。这表明采用HPLC方法测定大鼠血浆和脑组织中α-细辛醇的含量时,方法专属性良好。

A.空白血浆;B.α-细辛醇溶液(含内标物α-细辛醚);C.含α-细辛醇的大鼠血浆混合溶液(含内标物α-细辛醚);D.灌胃给药α-细辛醇后的大鼠血浆
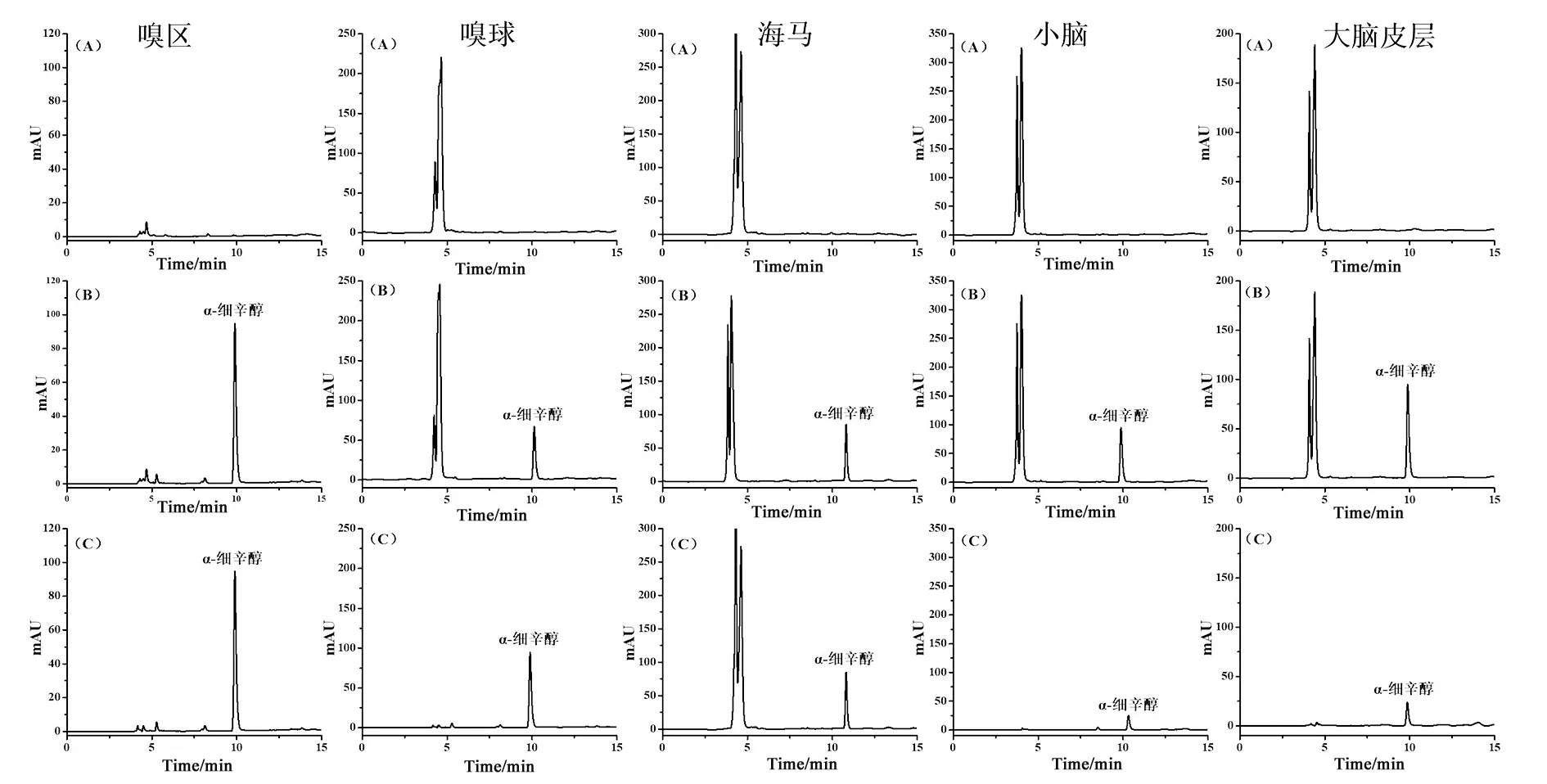
A.空白组织;B.含α-细辛醇的空白组;C.灌胃给药α-细辛醇后的组织样品
图3为α-细辛醇在血浆和脑组织样品中的标准曲线。其线性方程和相关系数分别为:血浆Y=0.400 3X-0.146 2(R2=0.993 8);嗅区Y=36.76X-10.17(R2=0.998 9);嗅球Y=30.10X+15.34(R2=0.993 6);海马Y=42.98X-15.59(R2=0.998 8);小脑Y=21.09X-0.85(R2=0.992 3);大脑皮层Y=19.48X+24.05(R2=0.993 9)。线性范围均为0.1~50 μg·mL-1。
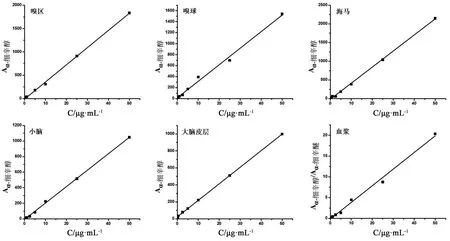
图3 血浆和不同组织样品中α-细辛醇的标准曲线
表1为α-细辛醇在血浆和脑组织样品中日内精密度和日间精密度及相对应的加样回收率考察结果,α-细辛醇的日内精密度和日间精密度RSD<7.2%,加样回收率在89%~105%,参照生物样品的药物含量限度要求,精密度和回收率良好,表明该方法可靠。

表1 α-细辛醇在血浆和脑组织中的精密度和加样回收率(Mean±SD,n=6)
表2~4分别为α-细辛醇在血浆和脑组织样品中的短期、长期和冻融稳定性考察结果。可见RSD<11%,回收率在86%~101%,表明α-细辛醇在血浆和脑组织样品中的短期稳定性、长期稳定性以及冻融稳定性均良好。
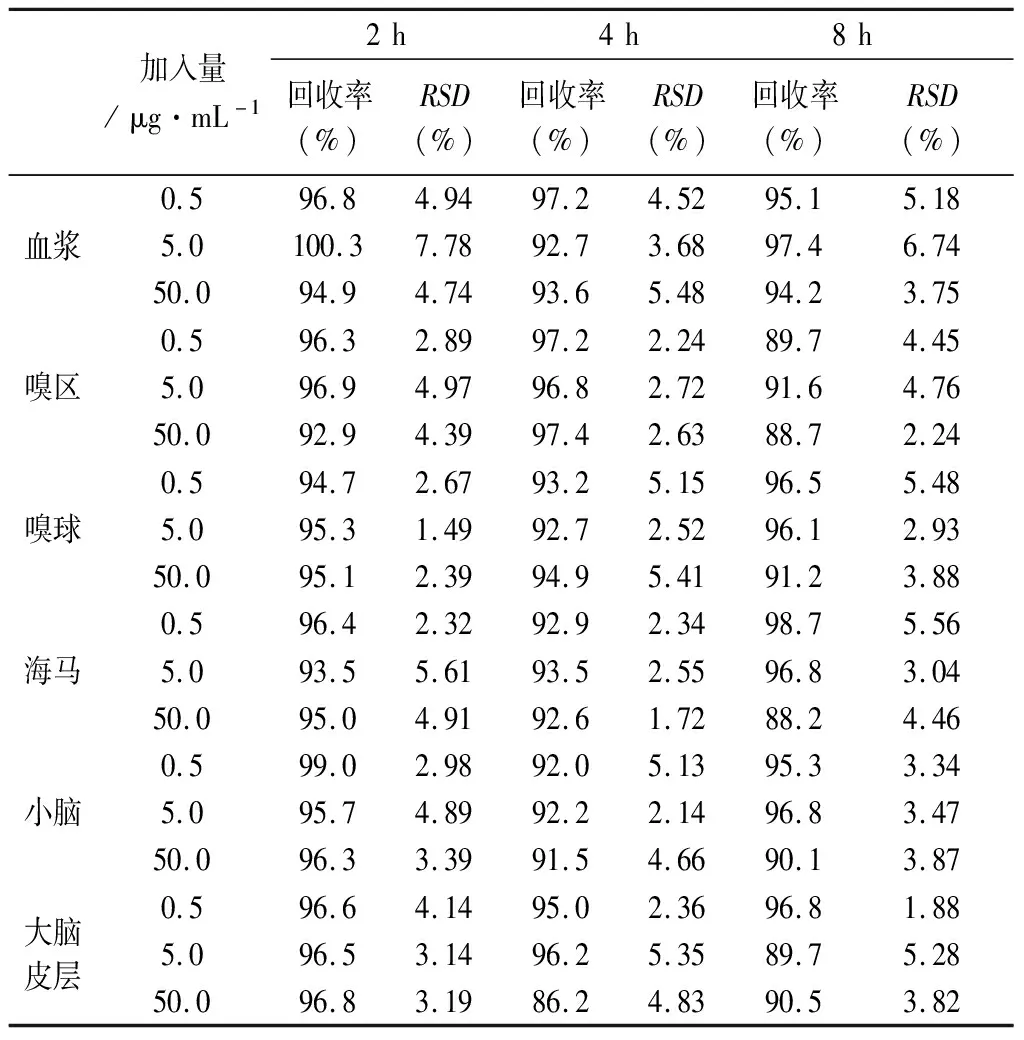
表2 α-细辛醇在血浆和脑组织样品中的短期稳定性
2.2 α-细辛醇的血浆药代动力学和生物利用度 对给药后不同时间点的大鼠血浆进行HPLC分析,记录相应的α-细辛醇色谱峰面积,由线性方程计算血浆中α-细辛醇的浓度。以取血时间点为横坐标,以α-细辛醇浓度为纵坐标,绘制药-时曲线(见图4)。可以看出,灌胃给药α-细辛醇在血浆中的浓度先升高再降低,而静脉注射和滴鼻给药α-细辛醇在血浆中的变化趋势相似,均随着时间增长而逐渐降低。灌胃给药、滴鼻给药和静脉注射分别在45、75、120 min后均未检测出α-细辛醇。

表3 α-细辛醇在血浆和脑组织样品中的长期稳定性

图4 滴鼻给药(i.n.)、静脉注射(i.v.)和灌胃给药(i.g.)α-细辛醇在大鼠血浆的药-时曲线

表4 α-细辛醇在血浆和脑组织样品中的冻融稳定性
表5列举了3种给药方式下α-细辛醇在大鼠血浆中的药代动力学参数。滴鼻给药比静脉给药α-细辛醇的药-时曲线下面积(AUC0~t)稍小,却是灌胃给药AUC0~t的2倍。体内平均滞留时间(MRT)依次为静脉给药、滴鼻给药和灌胃给药,表明α-细辛醇滴鼻给药在体内停留时间较长。滴鼻给药与静脉给药α-细辛醇后的最大血药浓度(Cmax)相当,而滴鼻给药剂量仅为灌胃给药剂量的1/2,但其Cmax却较大。滴鼻给药与灌胃给药α-细辛醇后血药浓度达峰时间(Tmax)均为2 min,表明滴鼻给药吸收迅速。滴鼻给药和灌胃给药α-细辛醇后的半衰期(T1/2)几乎无差别,却明显低于静脉给药的半衰期;清除率(CL)依次为静脉给药、滴鼻给药和灌胃给药,发现鼻腔给药远大于灌胃给药在体内的消除速度。根据药时曲线下面积(AUC)和给药剂量D,计算滴鼻给药α-细辛醇的绝对生物利用度为70.57%,而灌胃给药的绝对生物利用度为19.31%。
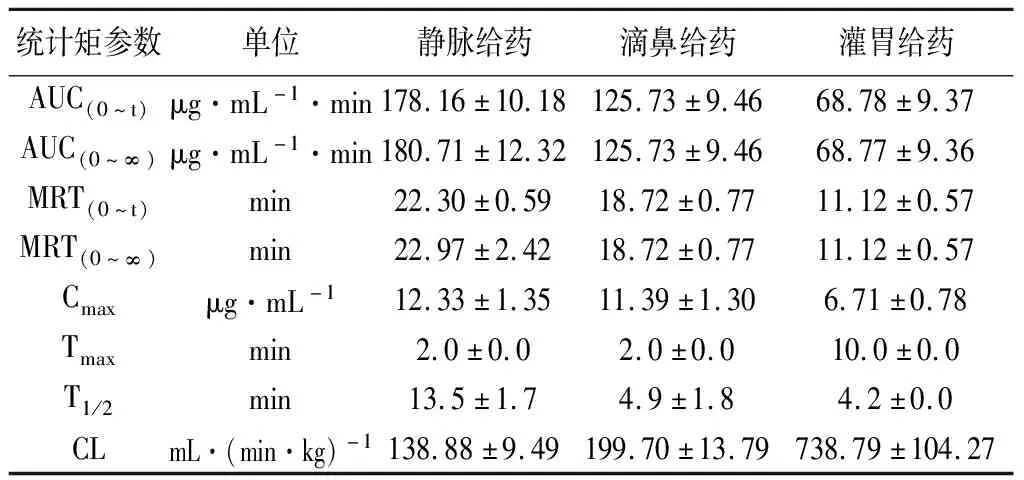
表5 不同给药方式下大鼠血浆中α-细辛醇的药代动力学参数(Mean±SD,n=6)
2.3 α-细辛醇的脑组织分布及脑靶向性评价 图5为不同时间点大鼠脑组织中α-细辛醇浓度的变化。当给药2 min后,滴鼻给药和静脉给药在大鼠5个脑区(嗅区、嗅球、海马、小脑、大脑皮层)有α-细辛醇的分布,灌胃给药仅在1个脑区(海马)有α-细辛醇的分布;当给药15 min后,滴鼻给药和静脉给药在大鼠4个脑区(嗅区、嗅球、海马、小脑)有α-细辛醇的分布,灌胃给药在2个脑区(海马和嗅区)有α-细辛醇存在,大脑皮层中均未检测到α-细辛醇;给药后30 min,滴鼻给药和静脉给药仍在大鼠4个脑区(嗅区、嗅球、海马、小脑)发现α-细辛醇,而灌胃给药后在3个脑区(嗅区、海马、和小脑)有α-细辛醇存在。
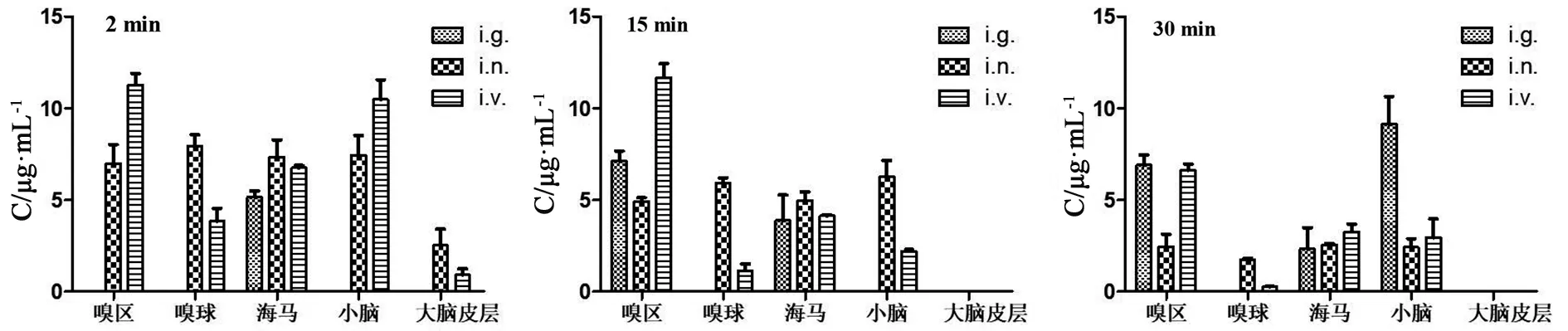
图5 滴鼻给药(i.n.)、静脉注射(i.v.)和灌胃给药(i.g.)大鼠脑组织中α-细辛醇浓度
Bi.v.为静脉注射给药大脑AUC,Pi.v.为静脉注射给药血浆AUC,PT为其他给药方式血浆AUC,BT其他给药方式大脑AUC,当DTP%>0表示药物具有脑靶向潜能。表6列举了α-细辛醇在大鼠嗅区、嗅球、海马、小脑和大脑皮层的DTI和DTP%值。滴鼻给药α-细辛醇在嗅球、海马、小脑和大脑皮层的DTI值均大于1且DTP%值均大于0,嗅球的DTI和DTP%显著高于其他脑区。相比而言,灌胃给药α-细辛醇在嗅区、海马和小脑的DTI值大于1且DTP%值大于0,海马区域的DTI和DTP%高于其他脑区。
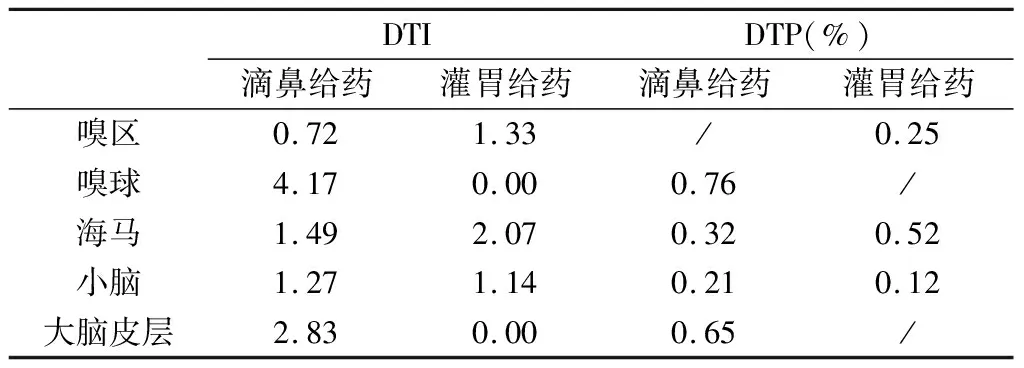
表6 大鼠嗅区、嗅球、海马、小脑和大脑的DTI和DTP值
3 讨论
对α-细辛醇在3种给药方式下大鼠血浆的药代动力学参数进行了系统分析。滴鼻给药和静脉注射α-细辛醇均在2 min达到相近的最大血药浓度,表明滴鼻的药物吸收迅速之快,可与静脉注射的药物吸收速度相媲美。滴鼻给药与静脉给药α-细辛醇的药时曲线下面积相近,表明α-细辛醇通过鼻黏膜更好地吸收进入体循环,这可能与α-细辛醇的亲脂性和低分子量有关[10]。与灌胃给药相比,滴鼻给药α-细辛醇的达峰时间明显缩短,这与芬太尼鼻腔给药的药代动力学特征相似,其鼻腔给药比灌胃给药的吸收速度大,具有起效快的特点[11]。滴鼻给药比灌胃给药α-细辛醇的最大血药浓度稍大,这是由于滴鼻给药剂量仅为灌胃给药剂量的1/2。文献报道了α-细辛脑的大鼠口服剂量是鼻腔给药剂量的4倍时,两种给药方式的血药浓度才比较相近,这表明鼻腔能有效吸收药物入血[12-13]。滴鼻给药比灌胃给药α-细辛醇的平均滞留时间较长,清除速率较小、半衰期几乎无差别,表明α-细辛醇滴鼻给药在体内停留时间长,可更好的发挥治疗作用。
灌胃给药α-细辛醇的绝对生物利用度为19.31%,这与文献报道其在正常大鼠的绝对生物利用度接近[5]。而滴鼻给药是灌胃给药α-细辛醇绝对生物利用度的3.6倍。Hussain等[14]发现灌胃给药普萘洛尔的生物利用度为15%,而鼻腔给药和静脉给药生物利用度相似,且远大于灌胃给药。有文献报道脂溶性药物咪达唑仑经鼻喷雾剂给药的绝对生物利用度达到88%[15]。分子量小的化合物(Mw<1 000)鼻腔给药后吸收效果好、生物利用度较高,亲脂性药物鼻腔给药后生物利用度明显高于灌胃给药,而亲水性药物鼻腔给药后生物利用度与灌胃给药几乎没有差别,这表明分子量和药物脂溶性是影响鼻黏膜吸收的重要因素[16],有机小分子更适合通过鼻内给药到达循环系统[17]。由此推断,α-细辛醇鼻腔给药的绝对生物利用度高,与其分子量小、亲脂性好有关。此外,鼻腔给药途径可以避免首过效应,也是α-细辛醇鼻腔给药绝对生物利用度高的主要因素。
滴鼻给药α-细辛醇在2 min之内快速且均匀地分布到各个脑区,而灌胃给药在30 min内仅在脑部3个脑区有分布,分布速度较慢且分布量不均匀。滴鼻给药α-细辛醇在嗅球中药物浓度明显高于静脉注射和灌胃给药,这与经鼻给药α-细辛脑在嗅球中的浓度高于其余两种给药途经的结果相一致[13]。相比于灌胃给药,滴鼻给药α-细辛醇的脑靶向指数和脑靶向潜能较高,表明滴鼻给药α-细辛醇的脑靶向性更好。这是由于鼻腔给药后,药物通过鼻黏膜更好的吸收到嗅觉上皮,绕过血脑屏障直接进入大脑的缘故[18]。从脑靶向指数和脑靶向潜能指标上推断,α-细辛醇在的脑靶向在嗅球区域,而灌胃给药脑靶向在海马区域。
本文建立了血浆和脑组织中α-细辛醇的HPLC测定方法,方法学考察显示专属性、回收率、精密度和稳定性均良好,可用于α-细辛醇在大鼠血浆药代动力学和脑组织的分布研究。鼻腔给药α-细辛醇具有吸收迅速、体内滞留时间长和生物利用度高等特点,能够快速分布到海马、小脑、嗅球和大脑皮层,且在嗅球中的脑靶向性最高。鼻腔给药α-细辛醇通过嗅球直接从鼻腔的嗅上皮进入脑组织,可以作为一种有效给药途径用于癫痫的及时救治。

