KAI1基因在胃腺癌细胞株中的表达及意义
邹盛楠,李春鸣,杨 华,梁 娜
(1.遵义医科大学附属医院 病理科,贵州 遵义 563099;2.遵义医科大学 组胚学教研室,贵州 遵义 563099)
胃癌是人类最常见的恶性肿瘤之一,位居消化道恶性肿瘤的首位[1]。据统计,全世界每年有990 000例新诊断的胃癌病例[2]。目前,临床上以手术治疗为主,辅以放化疗。随着治疗方法的不断改进,胃癌患者的生存率得到显著提高。然而,由于胃癌的早期症状不典型,容易被忽视,患者就诊时多伴有明显浸润和广泛转移,手术后中位存活时间常为12~20个月[2]。胃癌患者生活质量的大大降低,给患者及其家庭,乃至社会造成了沉重的精神及经济负担。因此,探索潜在的肿瘤抑制基因,明确其新的治疗靶点,对于胃癌的临床治疗是极其必要的。
KAI1又称为CD82,研究发现它不仅与细胞分化、生长和增殖等生理过程有关,还与肿瘤浸润和转移等病理状态有关。近年研究表明,KAI1基因是前列腺癌、肺癌、肝癌、甲状腺癌和胰腺癌等诸多恶性肿瘤的转移抑制基因[3],但不同胃癌细胞中KAI1基因的表达是否有差异,其对体内外生长、迁移是否有影响,尚未有相关研究报道。本研究拟采用Western Blot、RT-PCR等方法对不同分化程度胃腺癌细胞中KAI1蛋白及mRNA表达水平进行检测,结合MTT、细胞周期和Transwell实验,进一步通过构建裸鼠腹腔移植瘤模型,比较与分析不同分化程度胃腺癌细胞在体内、外生长及迁移情况,旨在为KAI1基因高低表达胃癌细胞株的筛选以及KAI1基因分子机制的研究提供实验基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂 人胃腺癌低分化BGC823细胞株由遵义医科大学病理教研室保存,人胃腺癌中分化SGC7901细胞株、人胃腺癌高分化MKN28细胞株购自广州吉妮欧生物有限公司;南美胎牛血清、DMEM培养基购自于GIBCO公司;兔抗人KAI1单克隆抗体购自美国Abcam公司;鼠抗人Tubulin单克隆抗体、逆转录试剂盒、扩增试剂盒购自北京全式金生物;KAI1、Actin正反向引物由南京金斯瑞生物科技有限公司合成; MTT试剂盒、细胞周期试剂盒购自北京索莱宝公司;Transwell小室(24孔板)购自美国康宁;4 周龄健康雌性 BALB/c-nu 裸鼠购自重庆滕鑫公司SCXK(京)2014-0004。
1.1.2 仪器 酶标仪(1500) 美国Thermo,细胞计数仪(IC1000)中国睿珏仪器,流式细胞器(CytoFLEX)德国Beckman,实时定量 PCR 仪(MyiQ2)、蛋白曝光系统 (ChemiDoc)美国 BIO-RAD。
1.2 方法
1.2.1 细胞培养 选取含有10%胎牛血清的DMEM培养基对人胃腺癌BGC823细胞、SGC7901细胞和MKN28细胞进行培养。分别置于37 ℃、5%CO2孵箱中孵育,每隔1~2天进行换液,待细胞长至80%以上时胰酶消化细胞传代。
1.2.2 Western blot检测KAI1蛋白表达 在对数生长期的3种胃腺癌细胞中分别加入RIPA裂解液及PMSF提取总蛋白(100∶1),BCA法进行蛋白定量,加入5×上样缓冲液,煮沸5 min使蛋白变性,用SDS-PAGE电泳进行条带分离,再转移到PVDF膜上,脱脂奶粉封闭1.5 h,一抗4 ℃冰箱孵育过夜(兔抗人KAI1单克隆抗体稀释倍数1∶1 000,鼠抗人Tubulin单克隆抗体稀释倍数1∶5 000),次日TBST清洗PVDF膜3次,每次15分钟,二抗常温孵育1 h(羊抗兔、羊抗鼠二抗稀释倍数均1∶10 000),洗膜,ECL曝光显影,Image J软件进行灰度值计算。
1.2.3 RT-PCR检测KAI1 mRNA表达 采用Trizol法提取对数生长期的3种胃腺癌细胞总RNA,测定RNA浓度及纯度(纯度要求在1.8~2.0之间),根据制造商说明,通过使用逆转录酶,将RNA逆转录为cDNA(转录参数:25 ℃ 10 min,42 ℃ 15 min,85 ℃ 5 s,4 ℃ forever),KAI1的正义和反义的引物分别是5’-TGTCCTGCAAACCTCCTCCA-3’和5'-CCATGAGCATAGTGACTGCCC-3'。以Actin为对照,它的正义和反义的引物分别是5'-CCTGGCACCCAGCACAAT-3'和5'-GGGCCGGACTCGTCATAC -3'。荧光定量PCR仪进行扩增(扩增体系10μL),PCR循环参数(95 ℃ 3 min,95 ℃ 10 s,55 ℃ 30 s,40个循环),利用2-△△Ct法进行相对定量分析。
1.2.4 MTT检测细胞生长曲线 用胰酶将对数生长期的3种胃腺癌细胞消化为单个细胞悬液,在96孔板中每孔加入5×103个细胞,体积100 μL,每组设置至少3个复孔,待细胞贴壁后的0、24、48、72 h,每孔分别加入MTT溶液20 μL,孵箱孵育4 h,倒掉上清液,每孔加入100 μL DMSO,振荡10 min,使结晶物充分溶解,测定490 nm波长处各孔吸光度,并绘制生长曲线图。
1.2.5 流式细胞术检测细胞周期 用胰酶将对数生长期的3种胃腺癌细胞消化为单细胞悬液,1 000 rpm离心5 min,用预冷的PBS洗3次,离心弃上清,加入-20 ℃预冷的70%乙醇,吹打均匀,封口膜封闭后4 ℃保存过夜。检测前离心、洗涤,用RNase和PI处理细胞,流式细胞仪检测各周期DNA含量。
1.2.6 Transwell检测细胞迁移 用胰酶将对数生长期的3种胃腺癌细胞消化为单细胞悬液,每个transwell小室中接种5×104个细胞(200 μL),下层加入含10%胎牛血清的培养基550 μL,放入37 ℃、5%CO2孵箱中孵育,24 h后取出小室;用PBS清洗小室两遍,多聚甲醛固定30 min,结晶紫染色,清洗,晾干,切膜放入载玻片,中性树胶封片,显微镜随机选取5个视野IPWIN32计数。
1.2.7 构建裸鼠腹腔移植瘤 选取4周龄雌性裸鼠15只,随机分为3组,实验前在SPF条件下饲养3d适应环境(SPF环境温度控制在20 ℃,湿度在50%左右),操作前对所需器械进行紫外照射消毒。胰酶消化对数生长期的3种胃腺癌细胞,计数,取0.2 mL浓度为 1×107/mL接种于裸鼠腹腔,操作迅速,动作轻柔,棉球按压防止漏液。接种后观察并记录裸鼠的精神、饮食情况,尤其注意观察腹部有无变大、膨出。在SPF条件下饲养4周后颈部脱臼处死各组裸鼠,解剖裸鼠并观察体内移植瘤生长、转移情况(肠系膜、腹膜、大网膜、肝、肾、胃、脾、胰腺、肺等出现移植瘤的每个脏器计数为1),并切取相应的组织行病理组织学检查判断重要脏器转移情况。
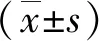
2 结果
2.1 3组胃腺癌细胞KAI1蛋白的表达 人胃腺癌BGC823细胞、SGC7901细胞和MKN28细胞的KAI1蛋白相对表达量呈依次递增趋势,且3组细胞间比较差异有统计学意义(P<0.05,见图1)。

*:3组细胞中KAI1蛋白的相对表达量两两比较,P<0.05。 图1 KAI1蛋白在BGC823、SGC7901、MKN28的相对表达量
2.2 3组胃腺癌细胞KAI1 mRNA的表达 BGC823细胞、SGC7901细胞和MKN28细胞的KAI1mRNA相对表达量也是呈依次递增趋势,且3组细胞间比较差异有统计学意义(P<0.05),与蛋白的表达水平相一致(见图2)。

*:3组细胞中KAI1mRNA的相对表达量两两比较,P<0.05。 图2 KAI1 mRNA在BGC823、SGC7901、MKN28的相对表达量
2.3 3组胃腺癌细胞生长曲线 检测3组细胞0、24、48、72 h光密度值,将0 h OD值设为标准,分别计算出3组细胞24、48、72 h的相对增殖率(见图3)。24 h BGC823、SGC7901和MKN28细胞相对增殖率呈依次递减趋势,且3组细胞之间两两比较差异有统计学意义(P<0.05);48 h MKN28细胞相对增殖率,低于人胃腺癌BGC823、SGC7901细胞,且差异有统计学意义(P<0.05);72 h 3组细胞两两比较,相对增殖率差异无统计学意义(P>0.05);BGC823细胞72 h相对增殖率明显高于24 h和48 h(P<0.05);SGC7901细胞在24、48、72 h间细胞相对增殖率比较差异均有统计学意义(P<0.05);MKN28细胞在72 h相对增殖率高于24 h和48 h的细胞相对增殖率(P<0.05)。
2.4 3组胃腺癌细胞周期差异 BGC823、SGC7901和MKN28细胞S期的比例呈逐渐下降的趋势,其中BGC823细胞S期比例最高,DNA合成最多,增殖能力最强,且3组间两两比较差异有统计学意义(P<0.05)(见图4,表1)。

★:24 h 3组细胞间相对增殖率比较,▲:48 h MKN28细胞与BGC823细胞及SGC7901细胞相对增殖率比较;#:BGC823细胞在72 h与24 h及48 h细胞相对增殖率比较;*:SGC7901细胞在24、48、72 h细胞相对增殖率比较;◆:MKN28细胞在72 h与24 h及48 h时细胞相对增殖率比较,P<0.05。 图3 BGC823、SGC7901、MKN28细胞的生长曲线

图4 BGC823、SGC7901、MKN28细胞周期对比


细胞S期(%)BGC82323.25±0.70∗SGC790118.70±1.00∗MKN2814.47±1.55∗
* :3组细胞S期两两比较,P<0.05。
2.5 3组胃腺癌细胞迁移对比 BGC823、SGC7901和MKN28细胞的迁移数目呈逐渐减少的趋势,且3组细胞间两两比较差异有统计学意义(P<0.05,见图5)。

* :3组细胞迁移细胞数两两比较,P<0.05。图5 BGC823、SGC7901、MKN28迁移细胞数对比
2.6 3组裸鼠腹腔移植瘤对比 在构建腹腔移植瘤模型过程中,无裸鼠死亡,且注射部位无皮肤溃烂、流脓。4周后将裸鼠脱颈处死,BGC823组、SGC7901组和MKN28裸鼠肠系膜移植瘤数目、重量依次减少(见图6~8,表2),3组之间两两比较差异有统计学意义(P<0.05)。观察3组裸鼠腹腔移植瘤转移部位,BGC823组腹腔移植瘤转移脏器数最多,主要是在肠系膜、大网膜、腹膜、胃、肝、胰腺、脾脏、肾脏及横隔,而MKN28组主要是肠系膜和大网膜,3组裸鼠腹腔移植瘤转移脏器数对比,差异有统计学意义(P<0.05,见表2)。

A:BGC823组;B:SGC7901组;C:MKN28组。图6 3组裸鼠肠系膜移植瘤表现

图7 3组裸鼠肠系膜移植瘤对比

A:BGC823组;B:SGC7901组;C:MKN28组;HE×200。图8 3组裸鼠移植瘤组织病理染色


组别成瘤率(%)移植瘤数(肠系膜)瘤重(肠系膜,g)转移器官BGC82310078.20±7.25★1.37±0.23◆8.40±0.89▲SGC790110038.40±5.94★0.25±0.06◆ 6.20±1.30▲MKN2810011.20±3.03★0.01±0.01◆ 1.40±0.55▲
★:3组裸鼠腹腔肠系膜移植瘤数目两两比较,P<0.05;◆:3组裸鼠腹腔肠系膜瘤体重量两两比较,P<0.05;▲:3组裸鼠腹腔移植瘤转移器官数两两比较,P<0.05。
3 讨论
胃癌是常见的四大恶性肿瘤之一,也是肿瘤中导致死亡的第二大原因[4],严重影响人类的健康水平。中国是胃癌发病率较高的国家,但目前进展期胃癌患者5年生存率不足30%[5],因此寻求新的治疗靶点对于提高胃癌患者的生存率极为重要。肿瘤抑制因子可通过影响肿瘤细胞粘附、增殖、迁移等能力,从而控制肿瘤细胞的转移。因此,当肿瘤抑制因子丢失时,恶性肿瘤的进展则显著加快。
KAI1基因是一个80KB大小的DNA,由10个外显子和9个内含子组成[6]。KAI1基因的结构与CD82相同,其编码的蛋白质由267个氨基酸组成,相对分子质量为29 600,是具有广谱生物学功能的4次跨膜超家族成员之一[7]。1995年,Dong等[8]将KAI1基因引入大鼠AT6.1前列腺癌细胞中后,发现前列腺癌的肺转移率大大减少,KAI1基因的表达与恶性肿瘤的侵袭性和转移性呈负相关关系。Wang等[9]研究发现,KAI1基因在具有低转移潜力的鼻咽癌细胞中呈高表达,而在具有高转移潜力的鼻咽癌细胞中呈低表达。Zhang等[10]研究表明KAI1在肝细胞癌中表达水平较低,且患者血清中KAI1的表达与TNM分期、肝内转移、淋巴结或腹膜转移相关。喉癌中KAI1表达与TNM分期、淋巴结转移也呈负相关[11]。此外,在胃癌组织中,KAI1基因与淋巴结转移、侵入深度、TNM分期及存活时间也是相互关联的[12]。但关于不同胃癌细胞中KAI1基因表达是否有差异以及KAI1基因对不同胃癌细胞的生长、迁移是否有影响却尚未研究。
为初步探讨KAI1基因对胃癌细胞株的影响,本课题根据分化程度选取了3种胃腺癌细胞株,应用Western Blot及RT-PCR对KAI1基因的蛋白及mRNA的表达水平进行检测。实验结果显示,人胃腺癌BGC823、SGC7901和MKN28细胞中KAI1基因的表达呈依次递增趋势,且组间比较差异有统计学意义(P<0.05)。这表明分化程度越低的胃腺癌细胞,KAI1基因的相对表达量越低,从而提示KAI1基因的表达水平可能与胃腺癌分化程度有关,这与康丽霞等[13]研究KAI1基因与胃癌分化关系时所得结果一致。
本研究体外通过MTT检测发现人胃腺癌BGC823、SGC7901、MKN28细胞相对增殖率呈依次递减趋势(P<0.05),同时结合流式细胞术检测发现人胃腺癌BGC823、SGC7901、MKN28细胞S期所占的比例也呈依次递减(P<0.05),其中S期占比越高的细胞株,DNA合成越多,增殖能力越强,说明分化程度越低的胃腺癌细胞,增殖能力越强,这与KAI1基因的相对表达量恰恰相反。从而提示KAI1基因的表达水平可能与细胞增殖有关。Chai等[14]通过研究KAI1过表达后的口腔癌细胞,发现其体外增殖能力明显减弱,这与本实验结果相符。通过Transwell实验得出人胃腺癌BGC823、SGC7901和MKN28细胞的迁移数目依次呈下降的趋势(P<0.05),与胃腺癌细胞相对增殖率、S期占比结果一致,与KAI1的相对表达量结果相反。说明KAI1基因表达水平越高的胃腺癌细胞株,体外迁移能力越弱,与Si等[15]在肝癌细胞中发现的结果一致,这提示KAI1基因对细胞的体外迁移可能有负向调控作用。
本研究通过进一步构建裸鼠腹腔移植瘤模型,成功模拟体内胃腺癌细胞的种植转移情况。实验结果显示,BGC823组、SGC7901组、MKN28组裸鼠移植瘤数量、重量以及转移脏器数目均呈依次递减趋势(P<0.05)。这说明KAI1表达越低的胃腺癌细胞,移植瘤的重量、数量及转移脏器数越多,从而提示KAI1基因的表达对胃腺癌细胞移植瘤生长及转移有影响。Xu等[16]研究发现KAI1基因过表达的胰腺癌细胞株,其裸鼠移植瘤大小、转移结节数及转移脏器数较未转染细胞株低,这与本实验结果相符,并且在乳腺癌中KAI1基因也是乳腺癌细胞体内转移的负调控因子[17]。因此推测,KAI1基因不仅对体外生长、迁移具有调控作用,对体内也有相应调控作用,预示KAI1基因可以作为判断胃癌发生、发展及预测预后的有效指标。基于KAI1基因调控胃癌细胞生长、迁移的能力,这可能通过与MiR-99b、MMP-2、MMP-9、TAp73等[18-20]相互作用来调控,具体有待后续进一步研究。
综上所述,我们推测KAI1基因的表达可能与胃腺癌细胞的生长、迁移能力有关,KAI1基因高表达的细胞株,其生长、迁移能力弱,反之则生长、迁移能力强,这将为后续实验筛选KAI1高低表达的胃癌细胞株以及开展胃癌转移分子机制研究提供理论依据。

