尖锐湿疣皮损中Foxp3、IL-10的表达及意义
黄银浩,陈永艳,王宝仁
(1.遵义医科大学附属医院 皮肤科,贵州 遵义 563099; 2.毕节市第一人民医院 皮肤科,贵州 毕节 551700)
尖锐湿疣(Condyloma acuminata,CA)是由人乳头瘤病毒(Human Papilloma Virus,HPV) 感染引起的临床常见性传播疾病,多见于肛周及泌尿生殖器等部位,目前认为CA的发生及转归与机体的免疫功能特别是由T细胞介导的细胞免疫抑制密切有关,但确切机制尚不完全清楚[1]。有研究发现Tregs细胞在CA细胞免疫抑制中起重要作用[2-4]。本课题采用免疫组织化学方法检测Foxp3和IL-10在CA皮损中的表达,探讨Tregs细胞在CA局部细胞免疫抑制中可能的作用,为减少CA的发病及复发提供理论依据。
1 材料与方法
1.1 研究对象 收集2016年7月至2017年7月在我院皮肤性病门诊初诊且未治疗的30例尖锐湿疣患者,均符合CA诊断标准[5],其中男17例,女13例;年龄20~56岁,平均(31.4±11.1)岁;病程0.5~3个月,平均28d,所有患者6个月内未使用过免疫调节剂并排除感染性疾病、自身免疫性疾病、严重系统性疾病和妊娠。15例为在我院泌尿外科行包皮切除术的健康男性的正常包皮组织(正常对照组),年龄19~40岁,平均(25.4±9.2)岁。
1.2 主要试剂 浓缩型兔抗人Foxp3多克隆抗体和IL-10多克隆抗体分别购于武汉博士德生物技术有限公司和北京博奥森生物技术有限公司;Maxvision法免疫组化试剂盒为Dako公司产品。
1.3 方法
1.3.1 标本制备 所有标本首先用10%甲醛溶液固定,常规石蜡包埋,3 μm连续切片,除1张做HE染色外,其余均做免疫组化染色。
1.3.2 HE染色 置于60 ℃烤箱内烘烤切片,分别采用二甲苯、梯度酒精脱蜡至水后染色进行封片,最终完成镜检。
1.3.3 免疫组化染色 常规脱蜡、水化,Foxp3采用 pH=9.0的EDTA微波加热15 min进行抗原修复,IL-10则采用pH=6.0的0.01%柠檬酸盐高压锅煮沸后保压3 min抗原修复,室温下自然冷却后采用Maxvision二步法:一抗 4 ℃孵育过夜,滴加二抗37 ℃孵育30 min,切片经 DAB 显色,苏木精复染,封片。Foxp3和IL-10一抗工作浓度为1∶100。扁桃体组织作为阳性对照,PBS代替一抗作为空白对照。
1.3.4 结果判断 Foxp3 、IL-10均以细胞核和(或)细胞质出现棕黄色或棕褐色颗粒为阳性表达。每张切片随机选5个400倍视野的阳性表达区域采用Olympus相机在固定条件下采图。采用图像分析软件测量每张图片平均积分光密度(IOD)和总测量面积(Area),然后用OD值=IOD/Area进行半定量分析。
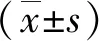
2 结果
2.1 正常包皮及尖锐湿疣皮损HE染色结果(见图1)。

A:正常对照组;B:尖锐湿疣组; IHC×100。图1 IHC下两组HE染色结果
2.2 Foxp3在尖锐湿疣皮损和正常对照组中的表达 Foxp3阳性细胞主要位于真皮层,正常对照组观察到少量Foxp3+淋巴细胞(见图2A),尖锐湿疣组均能见到大量Foxp3+淋巴细胞(见图2B)。尖锐湿疣组较正常对照组对比发现Foxp3+淋巴细胞在尖锐湿疣组的表达明显高于正常对照组,差异具有统计学意义(P<0.001,见表1,图2)。
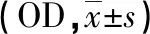

组别 例数Foxp3tP正常对照15 0.016±0.02038.020<0.001尖锐湿疣30 0.201±0.084∗
*:与对照组比较,P<0.001。

A:正常对照组;B:尖锐湿疣组; IHC×400。图2 IHC下观察两组Foxp3阳性细胞
2.3 IL-10 在尖锐湿疣皮损和正常对照组中的表达 IL-10阳性细胞主要位于真皮层,正常对照组观察到少量IL-10阳性细胞(见图3A),尖锐湿疣组均能见到大量IL-10阳性细胞(见图3B)。IL-10阳性细胞的表达在尖锐湿疣组中明显高于正常对照组,差异具有统计学意义(P<0.001,见表2,图3)。
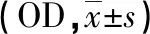

组别 例数IL-10tP正常对照15 0.021±0.00564.916<0.001尖锐湿疣30 0.206±0.091▲
▲:与对照组比较,P<0.001。

A:正常对照组;B:尖锐湿疣组; IHC×400。图3 IHC下观察两组IL-10阳性细胞
2.4 Foxp3与IL-10表达的相关性 尖锐湿疣皮损中Foxp3与IL-10的表达存在正相关(r=0.873,P<0.01),见图4。

图4 尖锐湿疣皮损中Foxp3和IL-10相关性分析
3 讨论
机体局部或全身细胞免疫功能低下是造成病毒持续感染、复发以及恶变的主要原因,CA局部细胞免疫功能在其发病及复发中起重要作用[6],感染HPV后可通过多种机制使机体细胞免疫受到抑制而逃脱免疫监视,但导致CA细胞免疫抑制的机制目前尚不完全清楚。CD4+CD25+调节性T细胞(Tregs)是具有负性调节作用的CD4+T细胞亚群[7],通过分泌IL-10和TGF-β等抑制性细胞因子抑制T、B细胞的活化及IL-2的产生,在维持机体免疫自稳、调控免疫应答方面具有重要作用。在病毒感染性疾病中,Tregs细胞具有平衡作用,不仅可以抑制过度免疫反应造成的组织损伤,还抑制某些病原体感染宿主而发挥有效的保护性免疫反应,不利于宿主对病原体的清除,因此Tregs细胞数量和功能异常与病毒感染性疾病的发生、发展密切相关[8]。叉头状/翅膀状螺旋转录因子(Forkhead/winged helix transcription factor,Foxp3)是Tregs细胞最特异的分子标记,也是其生长发育和发挥免疫抑制功能的关键[9]。成熟小鼠或人类Tregs细胞缺失Foxp3将失去其抑制能力,同时增强组织炎症反应,提示Foxp3持续表达对Tregs细胞的稳定是必需的[10],同时Foxp3能促进潜在HPV的复活[11]。对Tregs在CA 患者外周血中的研究表明,CA患者外周血中CD4+CD25+Foxp3+Tregs数量增加,Foxp3mRNA表达水平升高[2,12],提示CA患者存在全身细胞免疫抑制并与外周血Tregs数量增加相关。有资料表明,CA患者皮损中Foxp3的阳性表达率明显高于正常包皮组织[13-14],提示Tregs在CA局部细胞免疫抑制中可能也起重要作用[15]。IL-10是由Tregs细胞分泌的一种具有广泛免疫效应的细胞因子[4],有抑制细胞免疫和抵抗炎症反应两大作用,可抑制单核细胞、巨噬细胞及T细胞等释放促炎因子,对树突状细胞、B细胞、T细胞和NK细胞等的生成与分化具有调节作用,诱导它们分化为Tregs细胞[16]。有研究发现CA患者皮损组织中IL-10mRNA的表达水平高于正常人对照组[17]。为进一步阐明CA局部细胞免疫抑制的可能发生机制,我们采用免疫组织化学Maxvision方法检测CA患者皮损中Tregs细胞特异性转录因子Foxp3和抑制性细胞因子IL-10的表达,结果显示CA皮损中Foxp3和IL-10的表达水平均明显高于正常对照组,差异具有统计学意义(P<0.001),且Foxp3与IL-10的表达存在正相关(P<0.001)。我们推测,HPV感染人体后可在感染局部组织诱导Tregs细胞的活化及增殖,使皮损局部Tregs增多,导致IL-10、TGF-β等抑制性细胞因子分泌增加,激活免疫反应的负向调节,抑制了机体局部针对HPV的特异性细胞免疫反应,导致CA皮损局部存在明显细胞免疫抑制,从而使HPV能够逃避机体的免疫监视而长期存在及复发。

