非强心甾类Na+/K+-ATP酶小分子抑制剂的研究进展
梁光平,江仁望
(1.遵义医药高等专科学校 药学系,贵州 遵义 563006;2.暨南大学 药学院,广东 广州 510632)
随着世界范围内的人口老龄化进程的加快,高血压、冠心病等心血管疾病的发病率逐年上升,致使心衰的患病率也逐渐升高[1]。目前,我国的心衰患者约400万[2]。由于心脏结构或功能异常而导致心脏射血能力受损,临床上主要表现为呼吸困难和乏力,严重影响患者的生活质量,其五年生存率和恶性肿瘤相似[3-4]。研究表明[4],心衰主要是由于生物体内Na+/K+-ATP酶(简称NKA)对细胞膜电位的调节功能失去平衡所致。利用一些特殊的小分子配体对NKA进行抑制性调节可有效的改善心衰的症状,而这些对NKA具有抑制活性的小分子配体也被称为NKA抑制剂。天然产物及其结构修饰产物作为NKA抑制剂的主要来源,经过大量的实验已积累了丰富的研究资料,集中归纳可分为以地高辛、洋地黄毒苷为代表的强心甾类成分以及其他的非强心甾类成分。本文根据文献调研,重点对非强心甾类NKA小分子抑制剂的研究进展进行综述。
1 Istaroxime及其类似物
Istaroxime,即(z,e)-3-[O-(2-氨基乙基)酮肟]-(5α)-雄甾-3,6,17-三酮,最初是由意大利Sigma-Tau公司旗下的Gobbini等学者发现的。他们以来源于豆科植物几内亚格木(Erythrophleumsuaveolens(Guill.& Perr.) Brenan)中的二萜生物碱Cassaine(1)作为模型,通过化学合成获得具有酮肟结构的化合物(图1,2)[5-6]。对二者进行活性测试发现,istaroxime对NKA的抑制活性(IC50= 0.2 μM)高于卡洒因(cassaine,IC50= 5.0 μM),是cassaine对NKA抑制活性的25倍[7]。此外,istaroxime除了可以抑制NKA,还可以通过影响肌质网对Ca2+的摄取[8-9],引起心肌细胞内Ca2+浓度升高,发挥正性肌力作用。与传统的甲型强心苷类药物(如地高辛)相比,istaroxime对NKA的抑制活性更强,不良反应也更少[10-12]。目前,istaroxime已作为新型强心药进行开发,并通过FDA审批完成II期临床研究[13],有望成为代替地高辛等强心甾类药物的新型强心药。
鉴于istaroxime对NKA具有良好的抑制活性,Gobbini等[14]合成了一系列C3位和C6位具有不同取代基的istaroxime类似物,并通过活性测试以考察C3位、C6位不同取代基对其NKA抑制活性的影响。对于将C3位取代基变换为其他含氮取代基时,所有化合物对NKA都具有抑制活性。但是,只有少数几个化合物对NKA的抑制活性强于istaroxime,并且当C3位的含氮取代基呈链状时,这些化合物对NKA的抑制活性随着取代基的增长而显著减低。当C3位取代基为氮杂环时,化合物对NKA的抑制活性随着含氮杂环与甾核的距离或氮杂环的增大而减弱。同时,大部分化合物对NKA的抑制活性似乎也与胺的种类有关,C3位被一级胺、二级胺取代的化合物,其活性比三级胺取代的化合物更强(见表1)。

图1 Cassaine和Istaroxime的结构
表1 C3位不同取代基的istaroxime类似物及其NKA抑制活性

编号构型RIC50(μM)编号构型RIC50(μM)3z,e0.3710z,e0.244z,e0.3811z,e40.55z,e28.512z,e0.0266z,e0.6913z,e1.307z,e0.2314z,e11.08z,e1.8015z,e23.09z,e0.1016e1.10
对于将C6位的羰基变换为其他常规取代基时,大部分化合物的活性也同样减弱[15]。例如,C6位被乙酰胺取代时,化合物对NKA的抑制活性相对于istaroxime降低了近400倍;C6位被羟肟或甲氧肟基取代时,化合物的活性则提升了4倍以上。但是,当C6位肟取代基的空间体积越大时,化合物的活性则越弱。说明C6位被没有构型变化以及空间体积小的基团(如-C=N-)取代时,有利于提高化合物的活性,而当C6位被具有空间构型变化的基团(如-OH、-COOH、-NHAc等)取代时,由于该位置具有构型的不确定性,化合物的NKA抑制活性呈减弱趋势(见表2)。
表2 C6位不同取代基的istaroxime类似物及其NKA抑制活性

编号RIC50(μM)编号RIC50(μM)17=CH20.04226α-Me0.3018=CF20.1927α-OMe0.7119(e)=NOH0.02428α-COOH16.020(e)=NOMe0.01729α-NHAc45.021(e)=NOEt1.730β-OH2.122(e)=NOAllyl43.031β-CH2OH1.623α-OH0.5232β-CH2OMe3.024α-CH2OH0.1833β-Me6.025α-CH2OMe0.5034β-OMe1.5
此外,Cerri A等[16]学者还利用C17被羰基以及醛基取代的雄甾酮为原料,对C17位的取代基进行了结构修饰,并评价了这些化合物的NKA抑制活性(见表3)。结果表明,当修饰发生在C17位醛基时,化合物末端被含氮取代的NKA抑制活性普遍优于末端为-H、-Me、-OH、-COOH的化合物。但是,当肟醚片段的双键被还原以后,这些末端含氮化合物的NKA抑制活性则呈不同程度的降低。同时,当修饰直接发生在C17位时,即使是末端被含氮取代的化合物,其NKA抑制活性也很弱。根据研究结果可知,甾核C17位被6个原子长度的氨基侧链取代的化合物具有最强的NKA抑制活性。
表3 C17位不同取代基的肟醚化合物及其NKA抑制活性

编号构型RIC50(μM)35eCH=NOH10036zCH=NOH>10037eCH=NOCH33238eCH=NO(CH2)2N(CH3)21.039eCH=NO(CH2)3N(CH3)20.2540eCH=NO(CH2)4N(CH3)22.041eCH=NO(CH2)2NH20.1642eCH=NO(CH2)3NH20.0243eCH=NO(CH2)4NH20.5044e,eCH=CHCH=NOCH34.045e,eCH=CHCH=NO(CH2)2CH31046e,eCH=CHCH=NO(CH2)2OH6.347e,ezCH=CHCH=NOCH2COOH>10048e,eCH=C(CH3)CH=NOCH31049e,eCH=C(CH3)CH=NO(CH2)2OH7.950e,eCH=C(CH3)CH=NO(CH2)2NH20.0351e,eCH=C(CH3)CH=NO(CH2)3NH20.2052e,eCH=C(CH3)CH=NO(CH2)4NH21.2653CH2NHOCH37954CH2NHO(CH2)2N(CH3)25055CH2NHO(CH2)2NH21.5856CH2NHO(CH2)3NH20.4057eCH=CHCH2NHOCH34058eNO(CH2)2N(CH3)2>10059eNO(CH2)3N(CH3)2>10060eNO(CH2)4N(CH3)2>10061eNO(CH2)4NH2>100
2 多羟基呫吨酮
多羟基呫吨酮主要是由Zijian Xie等[18]人为了寻找和开发非甾体类NKA抑制剂所开展的研究工作。这些多羟基呫吨酮对NKA的抑制活性受呫吨酮骨架中酚羟基数量和位置的影响(见表4)。当酚羟基的连四取代位置处于靠近吡喃环的氧端,化合物对NKA的抑制活性最强(见表4,67),其IC50为1.5 μM,与乌本苷(ouabain)相当。值得一提的是,呫吨酮类化合物与NKA的相互作用不受Na+、K+或ATP的影响。与ouabain等[17]强心甾不同的是,它在发挥NKA抑制活性的同时,不激活Src,因而不影响下游信号通路。而当呫吨酮骨架上的羟基被甲氧基取代时,这些呫吨酮类化合物对NKA的抑制活性减弱。此外,Zijian Xie等[18]以呫吨酮为药效团还设计了很多个类似于化合物67的新型NKA小分子配体。
表4呫吨酮类化合物及其NKA抑制活性

编号R1R2R3R4R5R6R7R8IC50 (μM)62OHHOHHHHHH>10063HHOHOHHHHH>10064OHHOHHOHHHH6565HHOHOHOHHHH1066OHHOHHOHOHHH6067HHOHOHOHOHHH1.568HHOMeOMeHOMeHH>10069HHHHHHHH>10070OHHOMeHHHOHOMe>10071OHHOMeHHHOMeOH>10072OMeOMeOMeHHHOMeH>100
3 萜类
萜类化合物在自然界中分布广泛、种类繁多、结构复杂且具有多种生物活性。在这些萜类天然产物中,从褐藻Sargassumsiliquastrum(Mertens ex Turner,C.Agardh)分离得到一系列具有苯并吡喃结构的二萜化合物(见表5),对NKA具有不同程度的抑制活性[19-20]。其中,化合物76、80对NKA的抑制活性与ouabain(IC50= 4.6 μM)的强度接近(见表5)。化合物78、84对NKA抑制活性的IC50也在10 μM以内,这些化合物似乎可以作为NKA抑制剂进行开发。但是,这些化合物与NKA抑制活性的构效关系以及它们与NKA具体的作用方式尚不清楚。
表5具有苯并吡喃结构的二萜化合物及其NKA抑制活性

编号RIC50(μM)编号RIC50(μM)7330.48160.67443.68220.27583.18330.5763.6847.07714.085>100786.08645.07924.487>100804.688>100
除了上述的二萜化合物以外,一些诸如人参皂苷、熊果酸、柴胡皂苷等三萜类天然产物对NKA也具有抑制活性(见图2)。在这些化合物中,以人参皂苷Rh2(Ginsenoside Rh2,89,IC50= 37.5 μM)和熊果酸(Ursolic acid,90,IC50= 76.7 μM)的活性最强[21]。但是,它们对于NKA抑制活性的强度还是远低于ouabain、蟾毒灵等强心甾类成分。

图2 具有NKA抑制活性的三萜类天然产物
4 黄酮
黄酮是以2-苯基色原酮为基本母核的一类天然产物。根据结构的特点又分为黄酮、二氢黄酮、黄酮醇、黄烷醇、查尔酮等16种类型。据文献报道[22],具有儿茶素结构的(-)epicatechin(95)、(-)epicatechin-3-gallate(96)、(-)epigallocatechin(97)、(-)epigallocatechin-3-gallate(98)对NKA具有抑制活性。并且当C3-OH被没食子酰基取代以后(96,98),化合物NKA抑制活性的IC50可达到1.0 μM。并且(-)epigallocatechin-3-gallate为非特异性的NKA抑制剂,它不仅对NKA具有抑制活性,对H+/K+-ATP酶以及Ca2+-ATP酶亦具有微弱的抑制作用。换言之,(-)epigallocatechin-3-gallate属于多种P型ATP酶的小分子配体。在黄酮类化合物中,除了上述的几种儿茶素对NKA具有抑制活性,槲皮素(99,见图3)对NKA的抑制活性也可达到微摩尔级(IC50= 73.68 μM)[23]。

图3 具有NKA抑制活性的黄酮类化合物
5 丹酚酸
丹酚酸是常用中药丹参水溶性成分的总称,多具有酚酸性结构,如丹酚酸A(见图4,100)和丹酚酸B(见图4,101)。它们对心脏具有多种保护作用,如心肌缺血再灌注损伤、心脏微血管内皮细胞的延迟保护以及对动脉粥样硬化的防治等,尤以丹酚酸B的作用最显著[24]。研究表明,丹酚酸B主要是通过增加细胞内Ca2+浓度来实现对NKA产生抑制作用,进而对心脏产生多种药理活性[25-27]。同时,丹酚酸B与Mg2+形成配合物(见图4,102)后,可以提高与NKA结合的稳定性。并且通过分子对接模拟发现,化合物102与NKA相互作用的氢键区域和ouabain类似[28]。此外,利用不同的金属离子对一些与丹酚酸B具有相似结构的化合物进行配位后(见图4,103),所形成的配合物也具有与丹酚酸B镁相似的NKA抑制作用[29]。

图4 具有NKA抑制活性的丹酚酸类化合物
6 生物碱
生物碱是一类含氮的碱性有机化合物,具有多种生物活性,是中草药中重要的有效成分之一。其广泛分布于植物界,迄今为止在动物中发现的生物碱极少。在这些生物碱中,血根碱(见图5,104)对NKA具有较好的抑制活性(IC50= 5.6 μM),并且血根碱可能作用于强心苷结合位点[30]。除了血根碱以外,盐酸小檗碱(见图5,105)也有较弱的抑制活性。但与血根碱不同的是,盐酸小檗碱主要是通过关闭K+通道,刺激Na+/Ca2+离子交换来实现强心作用[31]。而且,盐酸小檗碱在100 μM的浓度下,对来源于猪脑的NKA不会产生抑制活性,通过实验测得其IC50仅为0.69 mM。

图5 血根碱与盐酸小檗碱的结构
此外,几种来源于苦豆子的生物碱(苦参碱、氧化苦参碱、槐果碱、槐定碱、苦豆碱、野靛碱)对NKA也具有一定的抑制活性(见图6)。在这6种生物碱中,以苦豆碱、野靛碱对NKA的抑制活性最强(抑制率分别为37.2 %、35.6 %),并且它们对NKA的抑制活性存在剂量依赖性,其抑制率随着浓度的增大而升高。槐定碱、氧化苦参碱对NKA的抑制率分别为25.9 %和18.3 %,处于6个生物碱的中间水平。而苦参碱和槐果碱对NKA的抑制率均低于15.0 %,且没有剂量依赖性[32]。

图6 几种苦豆子生物碱的结构
7 其它化合物
由于NKA普遍存在于各个器官组织中,对NKA具有抑制活性的化合物很多。具有Coumestan骨架的蟛蜞菊内酯(112,IC50= 0.7 μM)及其类似物也具有较强的NKA抑制活性(见图7,113~122)。化合物113对NKA的抑制活性与蟛蜞菊内酯相当(IC50= 0.7 μM)。而化合物114~122对NKA抑制活性的IC50为3 ~ 30 μM不等[33-35]。

图7 具有Coumestan骨架的化合物结构
除了具有Coumestan骨架的化合物,还有如图8所示的苍术酮(123)、紫苏醇(124)、Ustalic acid(125)对NKA都有不同程度的抑制活性。苍术酮对ATP酶的抑制活性为非竞争性的,它可以对NKA、Mg2+-ATP、H+/K+-ATP、H+-ATP、Ca2+-ATP等多种酶都具有抑制活性。但对NKA的抑制活性最强,其IC50为8.9 μM,而且在升高K+浓度时不影响Na+的浓度[36]。紫苏醇和Ustalic acid对NKA的抑制活性均弱于苍术酮,其活性均为毫摩尔级。其中,紫苏醇对来源于猪脑、猪肾NKA抑制活性的IC50分别为1.0 mM、1.5 mM[37]。Ustalic acid对来源于老鼠肠粘膜细胞NKA抑制活性的IC50为0.77 mM[38]。
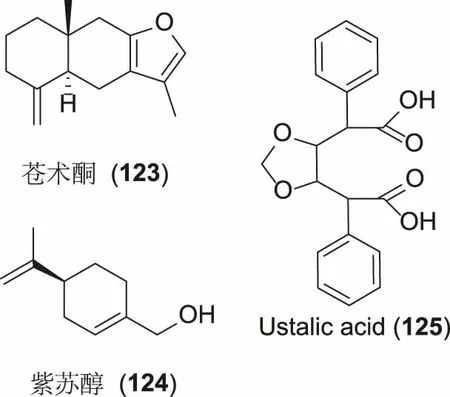
图8 具有NKA抑制活性的其它化合物
8 展望
地高辛、洋地黄毒苷等强心甾类药物虽然是临床上用于治疗心衰的主要药物,但是这些强心甾治疗剂量相当于中毒量的60%,其安全窗口较小。同时,大量的临床研究也表明了这些药物容易引起致命性心律失常,例如异位节律点自律性增高、房室传导阻滞、窦房结抑制等不良反应,严重时还会造成患者死亡。对于大多数患者而言,这些强心甾类药物并不是理想的强心药物。因此,积极寻找和开发非强心甾类强心药具有重要的临床意义。
天然产物因具有来源丰富、成分结构复杂多变、毒副作用小、价格低廉特点而成为了药学工作者寻找新型强心药的热点对象。虽然从中也发现了一些非强心甾类化合物对NKA具有抑制活性,但这些化合物的NKA抑制活性都比较弱,为了获得具有更好活性的NKA小分子抑制剂,则需要结合有机合成技术对其进行结构改造。其中,关于istaroxime的研究就是最具代表性的例子。随着科学技术的发展,有理由相信将会有越来越多的高效低毒的非强心甾类小分子用于抑制NKA的活性,进而用于治疗心力衰竭。

